肾透明细胞癌患者CT表现与Fuhrman核分级的相关性
赵盼盼,康旭,杨浩
咸阳市第一人民医院放射科1、CT室2,陕西 咸阳 712000
世界卫生组织将肾细胞癌(renal cell carcinoma,RCC)分为乳头状细胞癌(papillary renal cell carcinoma,PRCC)、集合管癌、肾透明细胞癌(clear cell renal cell carcinoma,CCRCC)及其他较为少见的类型,其中以CCRCC在临床上最为常见,占RCC的75%~80%[1]。CCRCC 相较于其他亚型恶性程度更高,部分患者在接受治疗后仍存在预后较差的情况,且相关报道称CCRCC 的五年生存率较PRCC、CRCC 更低,仅为68.9%[2]。临床上常根据病理Fuhrman 分级作为判定CCRCC恶性程度与患者预后的标准及重要指标,尽管相关研究机构提出了新的CCRCC病理分级系统,但目前Fuhrman核分级仍是使用最为广泛的分级方法[3]。相比于传统的根治性手术,将肾单位保留的手术方式更易被接受,是一种安全有效的治疗手段[4]。在行手术治疗前,采用影像学的方式对患者进行检查可以获取所需相关集合系统结构及血管的解剖信息以确保正常肾组织得以保留[5],故及早确定CCRCC 的Fuhrman核分级与肿瘤的相关性对临床治疗具有重要意义。本研究旨在分析CCRCC 患者不同Fuhrman 核分级的影响因素以明确其与患者CT表现的关系。
1 资料与方法
1.1 一般资料 选取2020 年5 月至2022 年5 月咸阳市第一人民医院收治的125例经手术病理证实的CCRCC 患者作为研究对象。纳入标准:(1)首次诊断为CCRCC 者且均为单发病灶;(2)近期未参与相关试验或CT 检查前未接受相关治疗者;(3)患者或家属知悉同意。排除标准:(1)存在手术禁忌证者;(2)无病理结果或病理结果不明确者;(3)临床资料不完整者。125 例CCRCC 患者中男性68 例,女性57 例;年龄25~85岁,平均(54.83±5.46)岁;左侧77例,右侧48例。
1.2 检查方法 采用螺旋CT 机(GE LightSpeed VCT 64 排),嘱患者呈仰卧位,双手高举过头顶,采用平扫+延迟期、动脉期及静脉期三期增强扫描,为减少呼吸运动伪影,扫描时需嘱患者屏气,注射对比剂后15 s、40 s、115 s 为三期扫描时间,平扫参数:层厚、层距均为5 mm,管电压及电流分别为120 kV、375 mA,矩阵512×512,螺距0.984:1;增强扫描参数:管电压与店里分别为120 kV、375 mA,矢状位、冠状位2 mm 多平面重组(MPR),对比剂采用1.5~2.0 mL/kg 的碘帕醇(300 mg/L),注射速率2.5 mL/s,扫描范围为双侧髂嵴与膈顶水平连线。
1.3 图像分析
1.3.1 病理图像 由工作年限>5 年的手术医师对标本进行诊断,对确诊标本进行病理分级,Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级的Fuhrman核分级方法判定标准分别为核仁不明显,细胞核直径<10 μm、呈相同圆形且均匀;核仁明显,细胞核直径达15 μm、增大且不规则;核仁直径达20 μm 且不规则;细胞核直径≥20 μm 且不规则,可见梭形癌细胞,具有凝块状核染色质。分级越高恶性程度越高,低级别组为Ⅰ~Ⅱ级标本,高级别组为Ⅲ~Ⅳ级标本。
1.3.2 CT 图像 (1)测量肿瘤实质平扫、肾动静脉期、延迟期CT值:选取面积为0.1 cm2的椭圆形感兴趣区域(ROI),避开肿瘤非实质部分进行测量。衰减值(△P)为三期相互之间的差值,强化率(△R)为肿瘤平扫与三期增强CT 值之比,△P1、△P2、△P3 分别为动脉期与静脉期、动脉期与延迟期、静脉期与延迟期的CT 值差值,△R1、△R2、△R3分别为动脉期、静脉期、延迟期与平扫CT 值之比。(2)肿瘤最大径:在MPR上测量瘤体最大量,连续测量3 次求平均值。(3)肿瘤强化环有无、假包膜并评估其完整性情况。由三名工作年限>5 年的影像科医师对图像进行分析,若判断有无假包膜、强化环及完整性不一致时以多数观点为最终结果。
1.4 统计学方法 应用SPSS24.0 统计软件分析数据。计量资料以均数±标准差(±s)表示,组间比较采用t 检验;计数资料比较采用χ2检验,采用Logistic回归分析CCRCC 患者不同Fuhrman 核分级的影响因素。检验水准α=0.05,以P<0.05 表示差异具有统计学意义。
2 结果
2.1 125 例CCRCC 患者Fuhrman 的核分级结果 125 例CCRCC 患者中Fuhrman 核分级为Ⅰ、Ⅱ、Ⅲ、Ⅳ级者分别为22例、66例、35例、2例,其中低级别组88例,高级别组37例。
2.2 不同Fuhrman 核分级患者的CT 值、衰减值及强化率比较 低级别组患者的动脉期CT 值,衰减值△P2,强化率△R1、△R2 明显高于高级别组,差异均有统计学意义(P<0.05),而两组患者的其他CT表现比较差异均无统计学意义(P>0.05),见表1和图1。
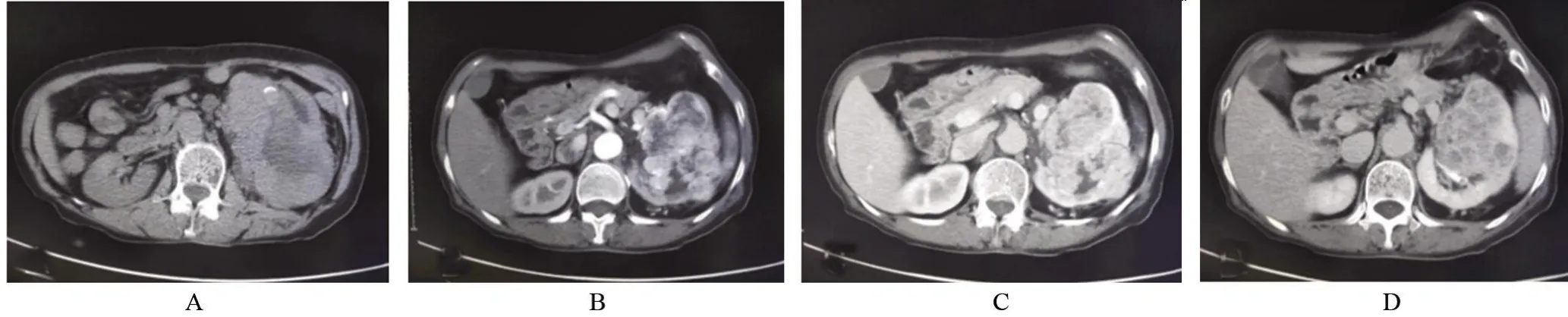
图1 59岁女性患者的CT征象影像图Figure 1 CT images of a female patient aged 59
表1 不同Fuhrman核分级患者的CT值、衰减值及强化率比较(±s)Table 1 Comparison of CT values,attenuation values,and enhancement rates between patients with different Fuhrman nuclear grades(±s)
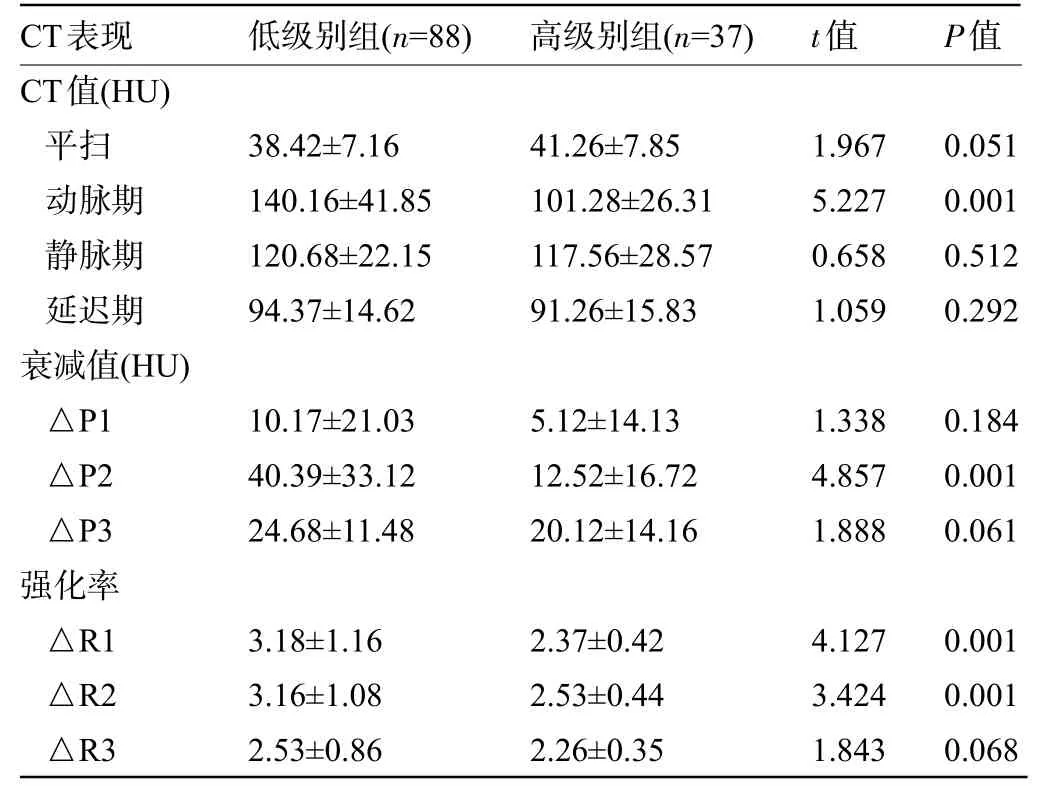
表1 不同Fuhrman核分级患者的CT值、衰减值及强化率比较(±s)Table 1 Comparison of CT values,attenuation values,and enhancement rates between patients with different Fuhrman nuclear grades(±s)
CT表现 低级别组(n=88)高级别组(n=37)t值P值CT值(HU)平扫动脉期静脉期延迟期衰减值(HU)△P1△P2△P3强化率△R1△R2△R3 38.42±7.16 140.16±41.85 120.68±22.15 94.37±14.62 41.26±7.85 101.28±26.31 117.56±28.57 91.26±15.83 1.967 5.227 0.658 1.059 0.051 0.001 0.512 0.292 10.17±21.03 40.39±33.12 24.68±11.48 5.12±14.13 12.52±16.72 20.12±14.16 1.338 4.857 1.888 0.184 0.001 0.061 3.18±1.16 3.16±1.08 2.53±0.86 2.37±0.42 2.53±0.44 2.26±0.35 4.127 3.424 1.843 0.001 0.001 0.068
2.3 不同Fuhrman 核分级患者的假包膜及强化环情况比较 低级别组患者的假包膜完整率及强化环完整率明显高于高级别组,差异均有统计学意义(P<0.05),见表2。
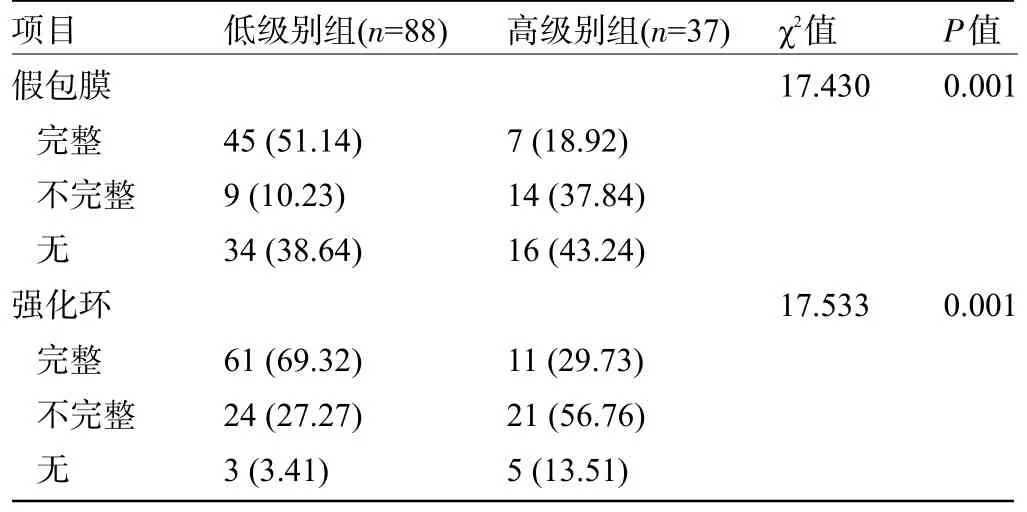
表2 不同Fuhrman核分级患者的假包膜及强化环情况比较[例(%)]Table 2 Comparison of pseudocapsule and enhancement ring between patients with different Fuhrman nuclear grades[n(%)]
2.4 不同Fuhrman 核分级患者的病灶最大直径比较 低级别组患者的病灶最大直径为(5.03±2.21)cm,明显小于高级别组的(6.85±3.01)cm,差异有统计学意义(t=3.759,P<0.05)。
2.5 CCRCC 患者不同Fuhrman 核分级的影响因素 以CCRCC 患者不同Fuhrman 核分级(低级别=0,高级别=1)为因变量,将动脉期CT值、衰减值△P2、强化率△R1、强化率△R2、病灶最大直径单因素分析差异有统计学意义的连续变量以及假包膜(无=0,完整=1,不完整=2)、强化环(无=0,完整=1,不完整=2)单因素分析差异有统计学意义的分类变量纳入多因素Logistic回归模型中,结果显示:动脉期CT值、假包膜、强化环为不同Fuhrman 核分级CCRCC 患者的影响因素(P<0.05),见表3。
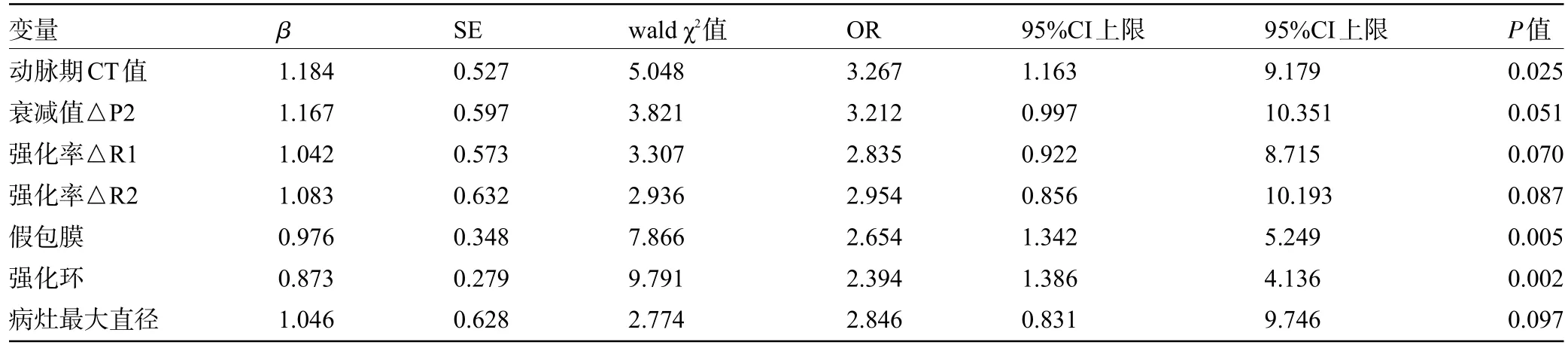
表3 CCRCC患者不同Fuhrman核分级影响因素的Logistic回归分析Table 3 Logistic regression analysis of the influencing factors of different Fuhrman nuclear grades of CCRCC
3 讨论
Fuhrman 核分级根据细胞核形态大小、核仁形态将肿瘤分为Ⅰ、Ⅱ、Ⅲ、Ⅳ级[6]。相关研究表明Fuhrman核分级与肿瘤的转移潜能、病理分期有关,Fuhrman核分级越高,生物侵袭性越强[7]。虽然肾脏穿刺活检可确定组织学来源及肿瘤良恶性,但其在安全及有创方面存在一定局限性,且肾脏肿块活检并不能完全准确地对Fuhrman核分级进行评价[8],故在术前对生物侵袭性进行识别及准确判断肿瘤分期存在一定难度。近年来随着影像学的不断发展与临床应用的逐渐广泛,影像学征象是否可对CCRCC Fuhrman 核分级进行预测尚待探究,为提升判断肿瘤分期的准确性,本研究对CCRCC 患者的CT 表现与Fuhrman 核分级的相关性进行分析。
结果显示125 例CCRCC 患者均为实性肿块,CT平扫显示密度高于正常肾实质或呈等、稍低分别为59例、66例。低级别与高级别CT值、衰减值及强化率结果显示:低级别组动脉期CT 值,衰减值△P2,强化率△R1、△R2显著高于高级别组,表明低级别CCRCC患者强化程度高于高级别患者,与2018 年杨保智等[9]研究结果一致。相关研究表明CCRCC 微血管密度(MVD)与核分级、肿瘤侵袭性呈负相关,表明MVD水平随肿瘤恶性程度增加而降低,患者预后越差[10];究其原因:肿瘤组织生长速度超过血供能力导致血管结构破坏,血供减少进而造成肿瘤组织中存在血管结构改变或坏死,常见于高级别肿瘤中,故可认为病理分级越高,MVD 水平低,肿瘤静脉期、动脉期强化不显著[11-12]。肿瘤强化的病理基础为血管管径粗、密度高且延迟期相对减弱,由此可认为病理分级越高[7],MVD水平越低进而导致动脉期强化不显著、肿瘤内动静脉瘘少,造影剂廓清慢。低密度环位于肿块与正常肾实质之间即为假包膜的CT 表现,在增强过程中假包膜内出现的强化环,厚薄均匀,平扫时为稍高或等密度[13]。两组假包膜及强化环情况显示:低级别组假包膜、强化环完整率较高级别组高,两组假包膜、强化环构成比(完整与不完整/无两组之间)差异有统计意义,表明肿瘤假包膜及强化环的完整性随肿瘤病理分级升高而降低。另两组病灶最大直径比较:低级别组较高级别组小,表明肿瘤直径可对假包膜及强化环完整性造成影响且直径越大完整性越差,肿瘤Fuhrman核分级越高。相关研究认为侵袭性较大的RCC 术后病理可发现残存假包膜,表明侵袭性越强肿瘤假包膜易被破坏,与本研究结果相似[14]。Logistic 回归模型中,结果显示:动脉期CT 值、假包膜、强化环为不同Fuhrman核分级CCRCC患者的影响因素,提示三者对于Fuhrman 核分级具有一定诊断及鉴别价值,临床上可依据动脉期CT值,假包膜、强化环有无及完整性在患者进行相关治疗前预判肿瘤侵袭性从而选择最佳治疗方案,甚至可在确诊后对疾病发展及预后转归进行预测,具有较好的实用价值。
综上所述,CCRCC 的CT 表现与Fuhrman 核分级密切相关,肿瘤增强早期强化程度随Fuhrman 核分级级别增加而逐渐显著,延迟期肿瘤CT 值降低。高肿瘤直径随Fuhrman 核分级的增加而增加,肿瘤侵袭性增强,假包膜被破坏则完整性越差,故通过CT表现可在术前对CCRCC恶性程度进行初步判断。

