miR-375调控RWDD3参与脑胶质母细胞瘤U251细胞增殖的机制研究
程焰红,魏霖,钟国栋,李颜
脑胶质瘤为一种常见的中枢神经系统原发性肿瘤,发病率占全身恶性肿瘤的1%~3%[1]。虽然手术切除联合术后放化疗的综合治疗手段已经取得长足进步,但脑胶质瘤细胞较强的增殖和迁移能力的特点使此类患者治疗效果不佳。因此,深入了解脑胶质瘤增殖、迁移的分子机制有助于为脑胶质瘤的治疗提供理论基础。microRNA在内的多种分子可参与调控肿瘤细胞的增殖、侵袭等诸多病理性行为中,多种microRNA可通过逆调控一些关键基因或者信号通路的表达来抑制肿瘤的发生发展。研究[2]表明,在乳腺癌、肝癌及胃癌等多种肿瘤组织中,miR-375均呈现出差异性的表达;Jia等[3]研究发现,miR-375在脑胶质瘤组织中表达水平显著降低且与患者的预后有关,即miR-375的低表达可促进脑胶质瘤的发生发展。RWDD3是RWD结构小泛素化增强子,最初在垂体瘤细胞中发现[4]。Ji等[5]研究表明,RWDD3在脑胶质瘤组织中表达水平明显升高,且与肿瘤恶性程度和预后密切相关。考虑到RWDD3在脑胶质瘤发生发展中的重要作用,并且miR-375及RWDD3在脑胶质瘤中均呈现差异性表达,因此,miR-375有可能是通过调控RWDD3的表达来对肿瘤的发生发展起调控作用。鉴于此,本研究通过检测miR-375靶向调控RWDD3对脑胶质瘤细胞增殖和迁移能力的影响,探究其在脑胶质瘤中的潜在作用。
1 材料及方法
1.1 脑胶质瘤标本 本研究经我院医学伦理委员会审批同意。49例脑胶质瘤标本来源于2017年12月—2022年8月我院神经外科经手术切除后组织病理学检查证实为恶性胶质瘤的患者,所有患者术前均未接受放化疗及其他免疫治疗。根据2016年WHO中枢神经系统肿瘤分类修订版的标准对肿瘤组织进行分级[6],其中Ⅰ级(毛细胞星型细胞瘤)9例、Ⅱ级(弥散性星型细胞瘤)15例、Ⅲ级(间变星型细胞瘤)13例、Ⅳ级(胶质母细胞瘤)12例,Ⅰ、Ⅱ级为低恶性度组,Ⅲ、Ⅳ级为高恶性度组。正常脑组织取自脑外伤患者颅内减压术后切除的部分组织,共10例。标本采集后立即置于冻存管中液氮保存。
1.2 细胞及试剂盒 U251人脑胶质母细胞瘤细胞购自美国ATCC细胞库;miR-375 mimics及相应阴性对照(NC)购买自中国广州锐博生物科技公司,过表达质粒pRWDD3及相应阴性对照(pNC)购买自中国苏州吉玛基因股份有限公司;兔源抗GAPDH、RWDD3抗体(ab8245,ab28845)购于Abcam公司;总RNA提取试剂盒(R6834),购自Omega公司。逆转录试剂盒(K1622)购自美国Fermentas公司。
1.3 Western blot和RT-PCR法检测脑胶质瘤组织中RWDD3及miR-375的表达 (1)Western blot:向正常对照组脑组织及胶质瘤组织加入液氮后进行研磨,加入适量的蛋白裂解液在冰浴条件下充分裂解30 min。收集至1.5 mL离心管中于4 ℃ 12 000 rpm离心15 min,吸取上清经99 ℃变性10 min后放置于-20 ℃冰箱中备用。将10 μg的各样品加入相应的凝胶孔中,进行12% SDS-PAGE电泳。5%脱脂牛奶封闭1 h后,加入一抗(GAPDH、RWDD3,1∶5 000), 4 ℃ 孵育过夜,TBST洗膜3次,后加入相应的HRP标记的二抗(1∶10 000)孵育2 h。TBST洗膜3次使用ECL液进行显影,并使用ImageJ软件对薄膜带上的蛋白进行半定量分析。(2)RT-PCR:使用总RNA提取试剂盒提取各组细胞的RNA,并利用逆转录试剂盒将提取的RNA逆转录为cDNA。设计miR-375、RWDD3相关基因的上下游引物(如表1所示),进行实时定量PCR反应,并使用ABI 7500 RT-PCR仪器检测胶质瘤组织中miR-375、RWDD3以及各组U251细胞中RWDD3 mRNA水平的表达情况,数据分析采用2-△△ct法进行。见表1。

表1 引物序列
1.4 CCK8法及细胞划痕实验检测miR-375、RWDD3对U251细胞增殖和迁移能力的影响 (1)CCK8实验:使用含10% FBS,1%双抗的DMEM培养基,在37 ℃,5% CO2的条件下培养U251细胞,收集对数生长期细胞,PBS洗涤并重悬后以每孔1×104的密度接种于96孔板中。设立以下几组实验:对照组、转染miR-375组、空载体组、RWDD3过表达组,每一组设置3个复孔。待细胞生长至80%融合后分别根据分组转染相应试剂,培养24 h后,向每孔加入10 L CCK-8溶液并于细胞培养箱中孵育30 min。随后使用酶标仪在450 nm波长下测定各孔下的吸光度(OD)值。(2)细胞划痕:将U251细胞以1×106个/孔接种于12孔板中,根据上述分组进行转染,48 h后用直尺比对,用10 μL的枪头在每孔竖直划1条直线,PBS缓冲液漂洗3次后换无血清培养基进行培养,并在显微镜下观察拍照。24、48 h之后分别使用PBS缓冲液漂洗3次后,再次观察拍照,使用Image J软件测量划痕的宽度并进行统计分析。
1.5 RT-PCR及Western blot法检测转染miR-375和对U251细胞中RWDD3表达的影响 RT-PCR:使用总RNA提取试剂盒提取各组细胞的RNA,按1.3中RT-PCR的方法检测各组RWDD3 mRNA的表达量;Western blot按1.3中使用总蛋白抽提试剂盒抽提各组细胞的蛋白,Western blot法检测各组RWDD3蛋白的表达量。
1.6 CCK8及细胞划痕实验检测过表达RWDD3后对 miR-375抑制的脑胶质瘤细胞增殖和迁移能力的影响 实验分为对照组、miR-375联合空载体组以及miR-375和RWDD3共转染组,其中对照组接受空质粒转染,miR-375联合空载体组同时接受miR-375 mimics及空质粒的转染处理,miR-375和RWDD3共转染组同时接受含有miR-375 mimics 及RWDD3基因的质粒。CCK8法及细胞划痕实验操作同1.4。

2 结果
2.1 miR-375、RWDD3在脑胶质瘤中的表达 应用RT-PCR检测49例不同级别的脑胶质瘤组织和10例正常脑组织miR-375和RWDD3 mRNA表达水平。结果显示,miR-375表达情况:正常组织>低级别胶质瘤组织>高级别胶质瘤组织,差异均有统计学意义(P<0.05)。见图1A。RWDD3 mRNA表达情况:正常组织<低级别胶质瘤组织<高级别胶质瘤组织,差异均有统计学意义(P<0.05)。见图1B。
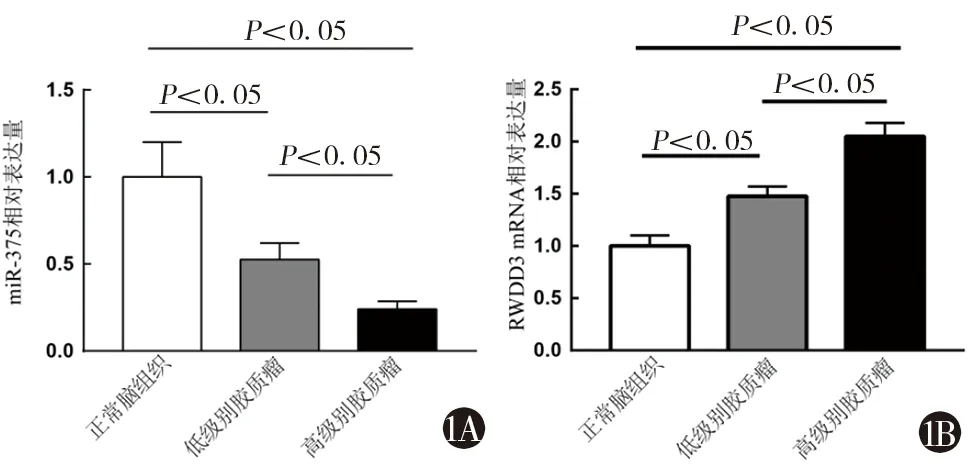
1A miR-375在高级别胶质瘤中表达降低1B RWDD3的mRNA在高级别胶质瘤中表达升高图1 miR-375、RWDD3在低、高级别脑胶质瘤中的表达水平
2.2 miR-375有效抑制脑胶质瘤细胞的增殖和迁移能力 分别采用CCK8和细胞划痕法检测转染miR-375胶质瘤细胞U251的增殖和迁移能力。与对照组比较,miR-375组的miR-375高表达后可以明显抑制U251的增殖能力(图2A)和迁移能力(图2B)。
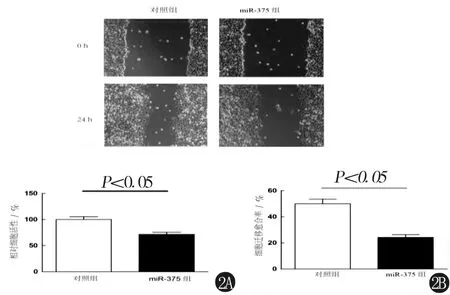
2A 转染miR-375 mimics 后胶质瘤细胞株U251的增殖能力降低2B 转染miR-375 mimics 后胶质瘤细胞株U251的迁移能力下降图2 miR-375高表达对U251的增殖和迁移能力的影响
2.3 RWDD3促进脑胶质瘤细胞U251的增殖和迁移能力 同样选择CCK8和细胞划痕法检测转染RWDD3质粒后脑胶质瘤细胞U251的增殖和迁移能力。结果显示,与空载体组比较,RWDD3高表达可明显促进U251的增殖能力(图3A)和迁移能力(图3B)。
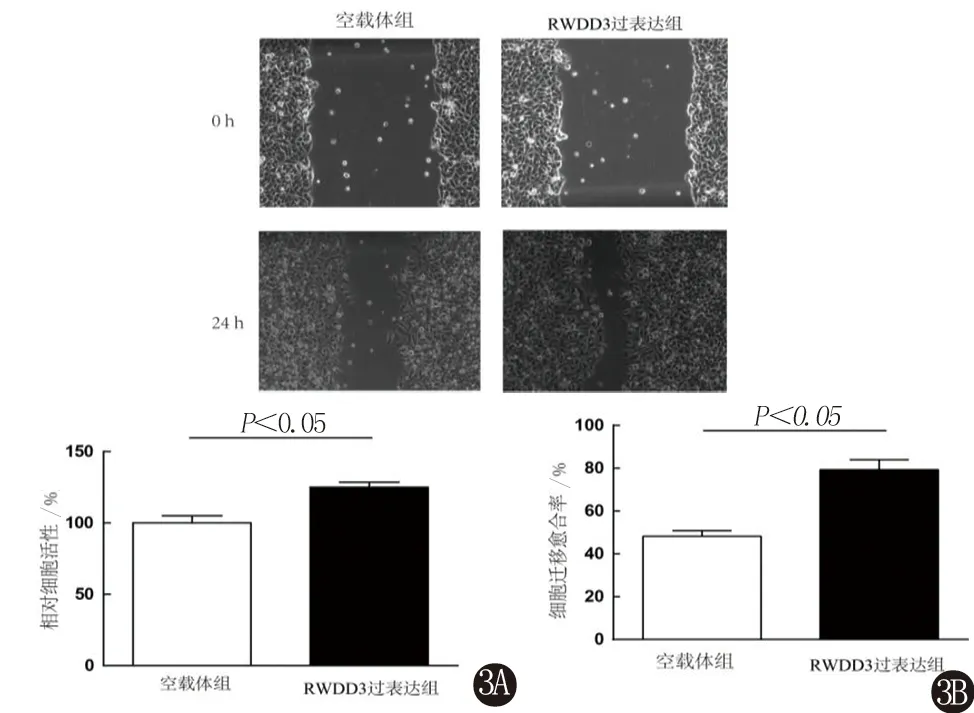
3A 转染pRWDD3质粒后胶质瘤细胞株U251的增殖能力增加3B 转染pRWDD3质粒后胶质瘤细胞株U251的迁移能力增加图3 RWDD3表达升高对胶质瘤细胞株U251的增殖和迁移能力的影响
2.4 RT-PCR检测转染miR-375后RWDD3 mRNA和蛋白的表达水平 在胶质瘤细胞U251中转染miR-375及空载体质粒后,分别采用RT-PCR及Western blot检测 RWDD3 mRNA和蛋白水平的表达,结果显示miR-375 可有效抑制 RWDD3 mRNA和蛋白水平的表达。见图4。
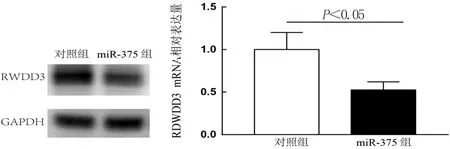
图4 转染miR-375 mimics后脑胶质瘤细胞U251中RWDD3的mRNA及蛋白表达水平降低
2.5 RWDD3恢复miR-375导致的脑胶质瘤细胞增殖及迁移能力 为观察RWDD3是否可以恢复miR-375导致的脑胶质瘤细胞增殖和迁移能力,设置对照组、miR-375联合空载体组及miR-375和RWDD3共转染组。分别向3组细胞中分别转染空载体质粒、miR-375+pNC及miR-375+pRWDD3,利用CCK-8细胞增殖实验及细胞划痕实验观察脑胶质瘤细胞U251的增殖能力,结果显示,与对照组比较,miR-375和RWDD3共转染组的细胞增殖和迁移能力明显下降(P<0.05);与miR-375联合空载体组比较,miR-375和RWDD3共转染组的细胞增殖和迁移能力明显上升(P<0.05)。见图5。
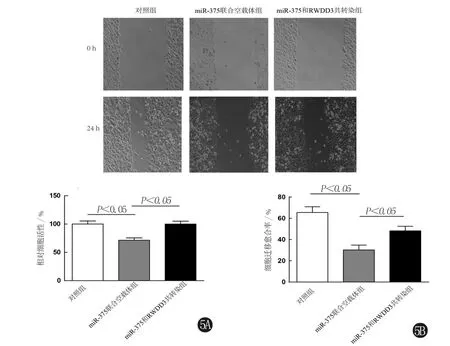
5A RWDD3恢复 miR-375抑制的脑胶质瘤细胞增殖能力 5B RWDD3可恢复 miR-375抑制的脑胶质瘤细胞迁移能力图5 RWDD3恢复 miR-375抑制的脑胶质瘤细胞增殖和迁移能力
3 讨论
脑胶质瘤是中枢神经系统常见的恶性肿瘤,死亡率高,预后差,其中以高级别的胶质母细胞瘤表现最为严重。目前临床上针对胶质瘤的治疗方法主要有放疗、化疗以及手术切除等,然而肿瘤细胞极强的增殖和迁移能力导致此类治疗方法不佳,患者极易复发。miRNA表达失调会导致其调控的下游蛋白表达异常,直接参与肿瘤的发生及进展。本研究选择脑胶质瘤中出现差异的miR-375及RWDD3作为研究对象,探讨它们在脑胶质瘤中的表达特征以及对细胞功能的影响,旨在揭示脑胶质瘤增殖、迁移的分子机制奠定前期研究基础。
RWDD3是RWD 结构小泛素化增强子,最初在垂体瘤细胞中发现,且在小脑、心脏及肾脏等组织中均有所表达[7]。RWDD3可在缺氧、炎症等多种外界刺激下表达升高,由于其具有强烈的促血管生成的能力,因此会参与诸多肿瘤的发生发展过程中。本课题在胶质瘤组织中也发现RWDD3的表达升高,提示其同样参与肿瘤的发生过程。TargetScan生物信息学软件能分析潜在影响RWDD3的miRNA分子,结果显示miR-375可靶向RWDD3的表达[8]。由于miRNAs是一类长度约20~24个核苷酸的内源性非编码小分RNA,其可以与下游靶基因mRNA的3’UTR区相结合,进而导致下游靶基因mRNA降解或抑制其翻译过程,对靶基因的转录后调控起着重要作用[9-10]。因此我们推测是由于正常脑组织、低级别及高级别胶质瘤组织中miR-375的表达水平逐渐降低后,导致了胶质瘤组织中RWDD3的表达升高。
miR-375位于人体细胞染色体长臂3区5带上[11-12]。近年来有研究[13]表明,miR-375与肿瘤的发生发展有着密切关系。为了进一步证实miR-375对RWDD3调控作用,本研究在体外实验中分析过表达miR-375对U251的增殖及迁移能力的影响,结果显示,在脑胶质瘤细胞中转染miR-375后,该细胞的增殖迁移能力降低,提示它是脑胶质瘤发病过程中重要的促进因子。本研究结果与既往研究相符,miR-375 可通过下调JAK2/STAT3及MAP3K8/ERK 信号通路抑制结直肠癌细胞的增殖能力[14],同时Tsukamoto等[15]发现miR-375在胃癌中表达量降低且其可通过PDK1和14-3-3zeta通路影响胃癌细胞的生存及凋亡能力。以上结果不仅提示miR-375可以促进脑胶质瘤的发生发展,也预示着作为一种血液中可以检测到的分子,同样有希望作为一种监控脑胶质瘤病情进展的分子,来早期预测脑胶质瘤的发生及复发。
既往研究[8]发现,RWDD3的表达在垂体瘤中升高,且敲减RWDD3的表达可抑制垂体瘤的侵袭能力。本研究通过实验证实,转染含有RWDD3的质粒可以明显促进胶质瘤细胞的发生发展,这表明RWDD3是一个脑胶质瘤治疗的促进因子。TargetScan生物信息学软件预测发现miR-375可靶向RWDD3的表达,且本研究细胞实验中已经证实过表达miR-375可以抑制细胞的增殖和迁移能力,那么我们推测,在胶质瘤的发生过程中,是由于miR-375表达的降低导致了RWDD3表达升高,最终导致了脑胶质瘤的发生。
为证实该推论,本研究在脑胶质瘤细胞中转染miR-375后检测RWDD3含量的变化。Western blot及RT-PCR结果表明细胞中的RWDD3含量同样降低,该结果说明miR-375可以直接作用于mRNA的3’UTR区,发挥对RWDD3表达的抑制作用。为此,我们设计了回复实验来验证推测的可靠性,在U251细胞中共转染miR-375及pRWDD3质粒后,miR-375诱导的细胞增殖迁移下降的能力明显下降,证实RWDD3可有效恢复因miR-375抑制的脑胶质瘤细胞增殖迁移能力。该结果进一步表明miR-375在脑胶质瘤中表达下降,而miR-375水平下降会导致RWDD3水平升高,最终促进脑胶质瘤的发生和发展。
综上所述,miR-375及RWDD3在胶质瘤中呈现差异性表达,检测血清中miR-375的含量可用于早期预测脑胶质瘤的发生及复发。胶质瘤中miR-375含量降低可以导致细胞中RWDD3的表达上调,并促进脑胶质瘤细胞的增殖和迁移能力。

