褪黑素温敏型原位凝胶肉鸡皮下给药的药动学研究
周亚星, 王月影, 聂芙蓉, 刘太宇
(1.河南农业大学动物医学院,河南 郑州 450046; 2.河南牧业经济学院动物科技学院,河南 郑州 450046)
褪黑素(melatonin,MT)是由松果腺分泌的一种吲哚类神经内分泌激素,其生物学作用广泛,如维持昼夜节律、抗应激、抗衰老、抗氧化、抗肿瘤和增强机体的免疫力等[1-3]。褪黑素在畜牧业生产中具有较大的应用潜力。研究表明,褪黑素可提高蛋鸡的产蛋量;猪注射褪黑素后采食量和能量转化率提高,并且肌肉脂肪含量降低[4]。目前,褪黑素多为皮下注射给药[5],但由于褪黑素在动物体内半衰期仅为0.35~0.50 h,用药成本较高。因此,研究一种更为高效且低成本的褪黑素给药剂型很有必要[6-10]。原位凝胶是一类药物新剂型,以溶液状态给药后,受环境中温度、pH值、离子、光照及压力等影响,在用药部位发生相转变,由液态转化形成非化学交联半固体状态[11]。根据相转变的作用机制,原位凝胶可分为温敏型、离子敏感型及pH敏感型等。温敏型原位凝胶是一种利用高分子材料对外界温度的响应而在用药部位发生相转变的药物新剂型,其在低温时为液体状态,当达到胶凝温度时变为凝胶状态,且这种变化随着温度的改变可逆[12]。温敏型原位凝胶作为新型的给药剂型,具有制作简单、给药方便及药物的生物相容性好等特性,主要辅料为泊洛沙姆、聚乙二醇和羟丙基甲基纤维素等[13],在药剂学和生物技术方面均已有应用[14-16]。王锐等[17]研究表明,相较于注射液,青藤碱在通过温敏型原位凝胶给药时达峰时间延长了3倍,药物的药时曲线下面积约为青藤碱注射液的2倍。简锐等[18]制备的雷公藤甲素,通过温敏型原位凝胶给药时的药物滞留时间有所延长。非房室模型突破了经典房室模型的限制,依据统计矩原理分析血药质量浓度数据,得到各项药动学数据,从而不依赖动力学参数进行计算,是目前最为广泛应用的药动学计算方式,适用于大多数药物[19]。肉鸡是最为常见的家禽之一。肉鸡日粮中添加褪黑素可显著提高肉鸡的平均日增质量和改善饲料转化率[20]。但是,由于药物本身绝对生物利用度低,半衰期持续时间短,上述研究成果尚未得到推广,而增加褪黑素在肉鸡体内的药效时间则成为关键因素。目前,关于褪黑素的温敏型原位凝胶给药方案的研究仍有空缺。本试验以肉鸡为试验对象,通过皮下注射褪黑素温敏型原位凝胶和褪黑素溶液,对比二者半衰期,计算绝对生物利用度,为褪黑素温敏型原位凝胶在动物生产等领域的应用提供依据。
1 材料与方法
1.1 主要试剂
褪黑素粉末购自美国VitaPure公司(纯度≥99.00%);褪黑素标准品购自美国西格玛公司(纯度≥99.70%),泊洛沙姆407粉末(P407,纯度≥98.00%)购于德国巴斯夫有限公司;泊洛沙姆188粉末(P188,纯度≥98.00%)购自北京索莱宝有限公司;聚乙二醇4000粉末(PEG 4000)和羟丙基甲基纤维素粉末(hypromellose,HPMC)15KM均购自上海麦克林生化科技有限公司,分析纯;甲醇、乙腈购自默克化工技术(上海)有限公司(色谱纯);肝素钠、甲基红等其他试剂购自生工生物工程(上海)股份有限公司(分析纯)。
1.2 主要仪器
Agilent1260高效液相色谱仪购自德国安捷伦科技公司;台式高速冷冻离心机购自湖南湘鑫仪表仪器公司;SC-3614型低速离心机购自上海安亭科学仪器公司;恒温水浴摇床购自上海知楚仪器设备有限公司。
1.3 试验对象
20只30日龄健康817肉鸡,购自鹤壁市永达食品有限公司,体质量(1.1±0.2)kg,试验前进行7 d的环境适应和检疫观察,试验期间自由饮水和采食。所有程序均在河南农业大学机构动物护理和使用委员会(institutional animal care and use committee,IACUC)(编号11-0085)批准下进行。
1.4 试验方法
1.4.1 褪黑素温敏型原位凝胶和溶液的制备及体外考察
(1)褪黑素温敏型原位凝胶的制备
参照陈燕瑞等[21]的方法制备温敏型原位凝胶,称取P407 22.00 g,P188 1.50 g, PEG 4000 0.40 g,HPMC 15KM 0.50 g,褪黑素0.15 g,注射用水补足至100 mL配置褪黑素温敏型原位凝胶,置于4 ℃冰箱冷藏24 h,经0.22 μm滤膜过滤除菌。
(2)褪黑素溶液的制备
称取10 mg褪黑素粉末,用10 mL体积分数50%的乙醇配制。参考刘杨等[22]的方法,采用棕色瓶灌装、溶封、灭菌等相关技术制成注射剂,4 ℃冰箱冷藏保存备用。
(3)褪黑素温敏型原位凝胶的体外释放行为考察
取3 g褪黑素温敏型原位凝胶置于试管中,在37 ℃恒温摇床中放置5 min等待胶凝,之后加入2 mL 磷酸盐缓冲盐溶液(PBS缓冲液),分别在1、12、24、36、48、72、96、104、120 h时取出0.50 mL样品于10 mL容量瓶中,用体积分数50%甲醇定容至10 mL。取10 μL注入高效液相色谱仪,参考林如文[23]的方法计算样品溶液质量浓度和计算体外释放度。
(4)褪黑素温敏型原位凝胶胶凝特性
参照汪姗等[24]的方法,取0.10 g甲基红染料加入5 mL的温敏型原位凝胶,另取0.10 g甲基红染料溶于10 mL无水乙醇溶液中,分别取5 mL上述2种液体各自注入50 mL、37 ℃、pH值7.4的PBS溶液中,观察温敏型原位凝胶与溶液状态。用10 mL的注射器取于4 ℃保存的1 mL温敏型原位凝胶,注入肉鸡皮下。6 min后将肉鸡麻醉,将标记区域打开,观察温敏型原位凝胶是否胶凝。
1.4.2 试验动物处理和样品采集 根据年龄体质量相近的原则,选取20只肉鸡,并随机分为A、B 组2个试验组,每组10只。A组为褪黑素溶液,B组为褪黑素温敏型原位凝胶组,均采用皮下注射3 mg的褪黑素。给药前采血加入肝素钠抗凝,4 000 r·min-1离心15 min,取上层血浆,制备空白血浆,给药后0.08、0.16、0.25、0.50、0.75、1、1.50、2、4、6、8、9、24、48、60、72、84、96、108、120 h分别于翅下静脉采血1 mL,制备血浆样品。
1.4.3 褪黑素温敏型原位凝胶方法学设计
(1)HPLC分析方法
分别吸取不同时间采集的血浆样品100 μL置离心管中,加入1 mL乙腈,涡旋120 s混匀,12 000 r·min-1离心10 min,上清液加100 μL 50%甲醇,12 000 r·min-1离心2 min,取上清液经氮气吹干,加500 μL 50%甲醇复溶,经0.22 μm微孔滤膜滤过,精密吸取10 μL进HPLC分析。色谱条件:Agela Odssil C18色谱柱(250 mm×4.6 mm,5 μm),225 mL(甲醇)∶275 mL(水)=45∶55,柱温28 ℃,流速1 mL·min-1,激发波长286 nm,发射波长352 nm,进样量10 μL。
(2)褪黑素溶液标准曲线的建立
取2 mL塑料离心管12个,加入200 μL空白血浆,再加入褪黑素溶液,调整褪黑素质量浓度分别为5、10、15、20、50、75、50、100、150、200、500、1 000 mg·L-1,按血浆样品处理方法,进样作HPLC分析。检测条件按2010版中华人民共和国兽药典[25]规定进行,以褪黑素和内标峰面积之比作为纵坐标,褪黑素的质量浓度为横坐标,做线性回归,得出标准曲线的回归方程和相关系数,并绘制标准曲线。
(3)特异性检测
通过HPLC检测褪黑素标准品、空白血浆和血浆样品,观察HPLC峰图是否存在交叉现象,如果无交叉现象,则样品之间不存在干扰。
(4)日内和日间精密度、检测限、定量限的测定
参照王锐等[17]的方法,取褪黑素标准品溶于空白血浆中配置质量浓度分别为75、150、500 mg·L-1的样品,于同日内3个不同的时间点,计算HPLC日内精密度,连续7 d同样操作,计算HPLC日间精密度。取空白血浆样品,进行不同质量浓度的添加回收试验,按照1.4.2中测条件分析测定,以信噪比S/N≥10为定量限,信噪比S/N≥3为检测限。
(5)回收率试验
取褪黑素标准品溶于500 μL空白血浆中配置质量浓度分别为75、150、500 mg·L-1的样品。参考刘营营[26]的方法,代入标准曲线,与测得肉鸡血浆中褪黑素的实际质量浓度比较,计算回收率。
(6)方法稳定性考察
取褪黑素标准品溶于肉鸡血浆中配置成梯度质量浓度,分别为75、150、500 mg·L-1,制备多份,分别于25 ℃放置10 h测定质量浓度,-20 ℃保存5、10 d后37 ℃水浴锅解冻并测定质量浓度,考察血浆中褪黑素稳定性。
1.5 统计分析
本研究采用非房室模型进行数据拟合,目前非房室模型已经成为体内数据解析的主流处理方法,为各国药品评审当局推荐使用的方法[19]。药动学数据处理利用WinNonlin(v5.2)软件,采用非房室模型方法进行拟合计算相关参数,包括达峰时间(tmax)、药峰质量浓度(Cmax)、末端消除速率(ke)、生物半衰期(T1/2)、零阶矩药时曲线下面积(AUC(0-∞))、一阶矩药时曲线下面积(AUMC(0-∞))、平均滞留时间(MRT(0-∞))、表观分布容积(Vz·F-1)、清除率(CL·F-1)和绝对生物利用度(F),血药质量浓度及药动学参数用平均值±标准差表示。采用SPSS 软件进行t检验,比较溶液组和温敏型原位凝胶组肉鸡的药动学参数的差异,P<0.05表示差异显著;通过Excel软件绘制各时间点血样中褪黑素的质量浓度与时间的关系曲线。绝对生物利用度F计算如下:
式中:F表示绝对生物利用度;AUC(0-∞)po表示温敏型原位凝胶注射后药时曲线下面积;AUC(0-∞)iv表示注射褪黑素溶液后药时曲线下面积;Doseiv表示注射褪黑素溶液给药剂量;Dosepo表示温敏型原位凝胶注射给药剂量。
2 结果与分析
2.1 温敏型原位凝胶褪黑素体外释放变化
体外释放度为药物释放量和药物总量的比值。如图1所示,随着缓释时间的增加,褪黑素温敏型原位凝胶的褪黑素体外释放度呈正相关增长趋势,并且释放速率较为和缓,120 h时药物基本释放完全。

图1 褪黑素温敏型原位凝胶体外释放变化
2.2 褪黑素温敏型原位凝胶成胶情况
如图2所示,褪黑素溶液(含甲基红)在体外37 ℃、pH值7.4的PBS缓冲溶液中呈液体,而褪黑素温敏型原位凝胶在相同条件下凝固呈透明黄色线状,沉淀在瓶底,凝固性较好。同时,褪黑素温敏型原位凝胶在肉鸡皮下凝固良好,呈透明胶体状,表明该制剂可以较好聚集固定在给药部位。

A.褪黑素溶液;B.褪黑素温敏型原位凝胶溶液;C.褪黑素体内温敏型原位凝胶状态。
2.3 方法学研究结果
2.3.1 褪黑素标准曲线绘制 以褪黑素标准品质量浓度为横坐标、峰面积为纵坐标绘制标准曲线,在5~1 000 mg·L-1范围内,褪黑素色谱峰面积与之质量浓度呈线性相关,回归方程为y=56.033x+326.820,相关系数r=0.999 7,呈良好的线性关系,结果见图3。

图3 褪黑素溶液标准曲线
2.3.2 特异性检测 在本试验条件下,褪黑素标准品在3.5~4.5 min时产生色谱峰,而血浆样品色谱峰在2.0~3.5 min范围内,褪黑素在血浆中可以与血浆杂质峰分离,表明血浆中其他物质对褪黑素的测定无干扰,结果见图4。
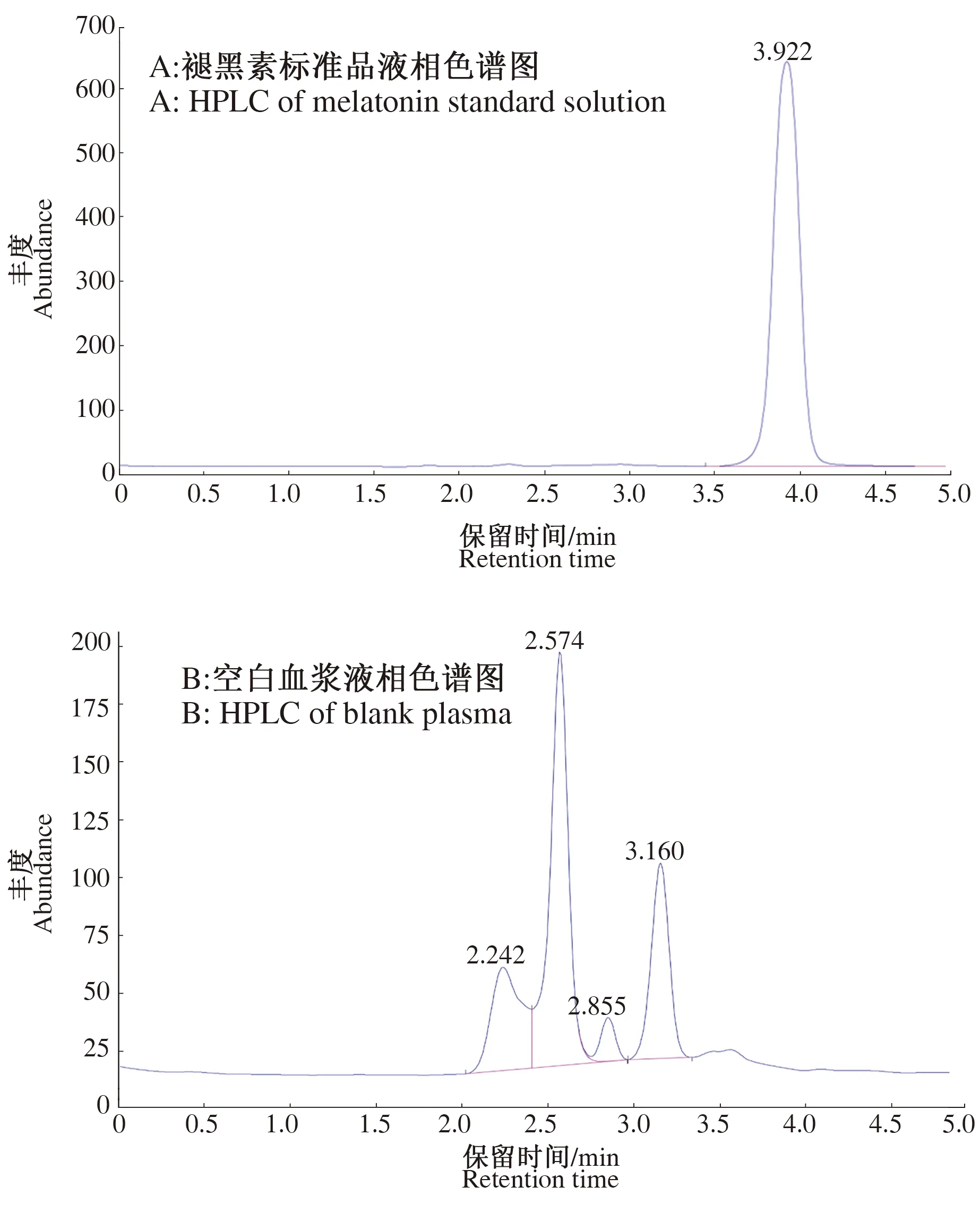
图4 血浆及褪黑素液相色谱图
2.3.3 检测限和定量限检测 血浆中褪黑素日内精密度试验峰面积的RSD为1.16%,日间精密度试验峰面积的RSD为1.3%,日间精密度和日内精密度均小于2.00%。按照信噪比S/N≥3为检测限,S/N≥10为定量限,褪黑素在血浆中的检测限为1 mg·L-1,定量限为2 mg·L-1。
2.3.4 加样回收率结果 肉鸡血浆中褪黑素质量浓度分别为75、150、500 mg·L-1时,样品测定的平均加样回收率分别为1.60%、1.00%和1.50%,均在2.00%以内。当RSD小于2.00%,褪黑素回收率较为稳定[23]。这表明,该方法可用于肉鸡血浆样品中褪黑素的测定,具体见表1。

表1 肉鸡血浆中的加样回收率
2.3.5 稳定性检测 样品在-20 ℃保存10 d,RSD范围在2.00%以内,长期稳定性符合要求;样品在室温(20 ℃)下保存10 h,RSD范围在2.00%以内,稳定性保持良好。褪黑素血浆样品在75、150、500 mg·L-1时,褪黑素质量浓度在不同的储存条件下没有产生显著变化。
2.4 褪黑素温敏型原位凝胶药动学研究
由表2可知,褪黑素温敏型原位凝胶在进入机体后,首先缓慢上升,在达峰质量浓度时开始缓慢下降,褪黑素溶液与之相似,且褪黑素温敏型原位凝胶组下降更为平缓。采用WinNonlin(v5.2)软件非房室模型方法进行拟合计算相关参数,共获得了达峰时间(tmax)、药峰质量浓度(Cmax)、末端消除速率(ke)、生物半衰期(T1/2)、零阶矩药时曲线下面积(AUC(0-∞))、一阶矩药时曲线下面积(AUMC(0-∞))、平均滞留时间(MRT(0-∞))、表观分布容积(Vz·F-1)、清除率(CL·F-1)和绝对生物利用度(F)共10个药动学相关参数,如表3所示。其中,与A组相比,B组的半衰期大于A组,且ke小于A组,说明A组对药物消除快,作用时间短,B组则对体内药物释放具有延缓作用。Cmax是指给药后血药质量浓度的最高值,反映药物吸收速率,B组的Cmax为(561.66±0.82)mg·L-1,与A组的Cmax(890.22±0.2)mg·L-1相比显著降低(P<0.05)。B组和A组的Tmax分别为72.00和0.50 h,T1/2分别为22.49和0.58 h,MRT(0-∞)分别为(77.320±2.590)和(1.108±0.002)h·mg·L-1,AUC(0-∞)分别为(39 068.75±1 514.00)和(890.70±1.02)h·mg·L-1,组间差异均极显著(P<0.01)。同时,褪黑素温敏型原位凝胶绝对生物利用度为(43.89±14.84)%。这表明褪黑素温敏型原位凝胶可以使得褪黑素在肉鸡体内的吸收速率减慢。

表2 褪黑素溶液和褪黑素温敏型原位凝胶皮下给药后肉鸡体内褪黑素药物质量浓度(n=10)

表3 褪黑素溶液和褪黑素温敏型原位凝胶在肉鸡血液中的药动学参数
3 讨论和结论
目前,测定褪黑素的血浆药物质量浓度的方法包括高效液相色谱法[27]、酶放大免疫分析[28]、质谱分析[29]、液质联用[30]和生物测定分析[31]等。本研究以泊洛沙姆为原料制备褪黑素温敏型原位凝胶,选用高效液相色谱法进行测定。褪黑素平均回收率高于90% ,日间和日内RSD小于2%,定量限和检测限分别为2和1 mg·L-1。褪黑素质量浓度在5~10 000 mg·L-1的范围内,药物度与检测器相应值之间相关性良好(r=0.999 7),表明建立的褪黑素血药质量浓度测定方法适用于褪黑素的药物动力学研究要求,且褪黑素温敏型原位凝胶在肉鸡体内温敏型原位凝胶效果良好,其缓释时间为5 d,可有效减少给药次数。
通过WinNonlin(5.2)软件的非房室模型方法分析,对褪黑素溶液和褪黑素温敏型原位凝胶2种剂型给药时褪黑素的药动学参数进行比较发现,褪黑素温敏型原位凝胶给药后,Cmax与褪黑素溶液相比表现为差异显著(P<0.05),tmax、MRT(0-∞)、AUC(0-∞)和T1/2差异均极显著(P<0.01)。原位凝胶对许多药物均有缓释作用。任丹丹等[32]制备的安乃近温敏型原位凝胶半衰期为原液的2倍,平均滞留时间提高2.5倍。王蓉[33]制备的卡络磺钠温敏型原位凝胶的半衰期是原液的8倍,平均滞留时间提高4倍。ZANCHETT[8]制备的褪黑素片剂在猴子体内的消除半衰期为0.56 h。JAN等[34]制备的褪黑素片剂在小鼠体内的平均滞留时间为(0.92±0.06)h·mg·L-1。本研究中,褪黑素温敏型原位凝胶的平均滞留时间为(77.32±2.59)h·mg·L-1,相比传统剂型,温敏型原位凝胶缓释效果更加显著;褪黑素温敏型原位凝胶绝对生物利用度为(43.89±14.84)%,表明褪黑素经温敏型原位凝胶在肉鸡血浆中利用效果较好。
本研究通过对褪黑素温敏型原位凝胶和褪黑素溶液药动学参数进行对比分析发现,褪黑素温敏型原位凝胶在肉鸡体内半衰期和平均滞留时间长,使褪黑素的应用更为经济、简便,促进了褪黑素产业的发展。

