艾草黄酮大孔吸附树脂纯化及抗氧化活性研究
徐超, 张昊宇, 任红涛, 余秋颖, 王凡, 王娜,3, 周道均
(1.河南农业大学食品科学技术学院,河南 郑州 450002; 2.郑州市营养与健康食品重点实验室,河南 郑州 450002; 3.河南农业大学动物医学院,河南 郑州 450046; 4.北京丰森源林业有限公司,北京 102100)
艾草(Artemisiaargyi)又称艾蒿、香艾和冰台等,为菊科多年生草本植物,主要分布于亚洲、欧洲和北美洲的温带及亚热带地区,在中国东北、华北、华南及西南地区广泛分布[1]。在中国,艾草已有2 000多年的药食两用历史,包括食用艾草制作的青团、糍粑和米果等糕点[2]。研究表明,食用艾草有降血脂、降胆固醇和提高机体免疫力等食疗保健功效[3],其活性成分包括挥发油类、鞣质类、黄酮类和微量元素等[4]。其中,黄酮类化合物作为艾草主要功效成分,具有抗菌、抗氧化、抗肿瘤、抗病毒、降胆固醇、降脂、降血糖、抗衰老和增强机体免疫力等功效[5-8]。利用现代技术纯化艾草黄酮,并对其组分进行深入分析,可为治疗、预防疾病及开发相关保健食品等提供理论基础。
黄酮类化合物的分离纯化常见大孔树脂纯化、薄层层析、溶剂萃取和高效液相色谱等方法[9]。其中,大孔树脂纯化具有成本低、操作简便、纯化效果好和黄酮类物质回收率高等优点[10]。李杰等[11]利用神经网络结合遗传算法对AB-8大孔树脂的艾草黄酮动态吸附和解吸进行研究,提高了艾草黄酮的吸附率和解吸率。杨宇华等[12]对6种不同大孔吸附树脂纯化艾草黄酮进行研究,结果表明,选用AB-8型大孔树脂,纯化后的艾草黄酮纯度为75.43%。但是,关于艾草黄酮大孔树脂纯化的研究仍存在大孔树脂选择类型少、纯化效果不理想和纯化物组分不清晰等问题[13]。因此,本研究选用HPD100、HPD300、HPD722和AB-8等18种不同极性的大孔树脂,通过静态和动态的吸附和解吸试验,优化艾草黄酮的纯化方法。在此基础上,利用超高效液相高分辨质谱联用法对其组分进行鉴定,并对纯化后的艾草黄酮的抗氧化性进行评价。本研究通过建立高纯度艾草黄酮的纯化方法,为艾草黄酮在功能健康食品的综合开发方面提供理论依据。
1 材料与方法
1.1 原料与试剂
艾草品种为京艾(1 a储存期),产地北京延庆,水分体积分数25%;芦丁标准品(纯度≥95.0%)、维生素C标准品购自北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)标准品(纯度≥97.0%)购自福州飞净生物科技有限公司;无水乙醇购自天津富宇精细化工有限公司,分析纯;亚硝酸钠、硝酸铝、硫酸亚铁和水杨酸购自天津市大茂化学试剂厂,分析纯;体积分数30%过氧化氢溶液和溴化钾购自烟台市双双化工有限公司,分析纯。
大孔吸附树脂:HPD100型、HPD300型、HPD600型、HPD722型、HPD750型、HPD826型、HPD950型、H60型、H103型、H1020型、LSA-10型、LSA-21型、HP-20型、LS303型、ADS-7型、DM301型和D101型购自郑州和成新材料科技有限公司;AB-8型购自北京索莱宝科技有限公司。
1.2 仪器与设备
高速多功能粉碎机:HC-200T型,武义海纳电器有限公司;台式低速离心机:TD-5A型,湖南赫西离心机仪器有限公司;恒温水浴振荡器:SHA-B型,上海力辰邦西仪器科技有限公司;自动液相色谱分离层析仪,ME99-2A型,上海沪西分析仪器厂有限公司;旋转蒸发仪,RE-52AA型,上海亚荣生化仪器厂;冷冻干燥机,LGJ-10D型,四环福瑞科仪科技发展有限公司;双光束紫外可见分光光度计:TU-1901型,北京普析通用仪器有限责任公司;超高效液相色谱仪,1290型,安捷伦科技有限公司;质谱仪,QTOF6550型,安捷伦科技有限公司;色谱柱,BEH C18 2.1 mm×50 mm,1.7 μm 型,沃特世科技(上海)有限公司。
1.3 试验方法
1.3.1 艾草黄酮粗提物的制备 准确称取干艾草10.0 g,粉碎30 s,按m(干艾草/g)∶V(去离子水/mL)=1∶30混匀,60 ℃水浴40 min,超声340 W处理27 min,微波600 W处理120 s,提取后将料液过滤,5 000 r·min-1离心10 min,取上清液,得到艾草黄酮粗提物(以下简称粗提物),用去离子水溶解配置成不同质量浓度粗提物提取液备用。
1.3.2 大孔树脂的筛选 准确称取18种不同型号的大孔树脂(AB-8型、HPD100型、HPD300型、HPD600型、HPD722型、HPD750型、HPD826型、HPD950型、H60型、H103型、H1020型、LSA-10型、LSA-21型、HP-20型、LS303型、ADS-7型、DM301型和D101型)10.0g,按照孙美玲等[14]的方法对大孔树脂进行预处理,置于烧杯中,加入30 mL的2 g·L-1艾草黄酮提取液,使大孔树脂完全浸没,摇床震荡24 h后抽滤,紫外分光光度法测定吸附液的艾草黄酮质量浓度。大孔树脂对艾草黄酮的吸附量及吸附率见式(1)和(2)。
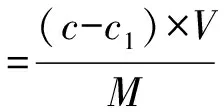
(1)
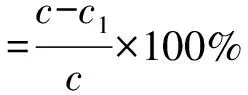
(2)
式中:V为吸附液体积;M为大孔树脂的质量;c、c1分别吸附前和吸附后吸附液中艾草黄酮质量浓度。
将上述吸附完全的大孔树脂沥干表面吸附液后,加入30 mL体积分数60%乙醇作为解吸液,摇床震荡24 h后抽滤,紫外分光光度法测定解吸液的艾草黄酮质量浓度。大孔树脂对艾草黄酮的解吸量及解吸率计算见式(3)和(4)。
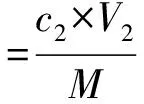
(3)
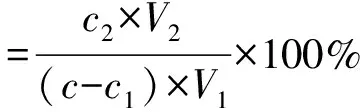
(4)
式中:M为大孔树脂的质量;c、c1、c2分别为吸附前、吸附后和解吸液中艾草黄酮质量浓度;V1、V2分别为吸附液和解吸液体积。
1.3.3 艾草黄酮大孔树脂纯化静态吸附和解吸试验 静态吸附动力学曲线绘制。准确称取10.0 g大孔树脂置于烧杯中,按照1.3.2方法处理,每30 min吸取0.5 mL吸附液,以时间为横坐标,吸附率为纵坐标绘制静态吸附动力学曲线。
以吸附液艾草黄酮质量浓度2.0 g·L-1、吸附液pH值4、吸附温度30 ℃、解吸液乙醇体积分数60%、解吸液pH值5为基础条件,准确称取10.0 g预处理树脂置于烧杯中,按照1.3.2方法处理,分别考察粗提物质量浓度(0.5、1.0、1.5、2.0、2.5 g·L-1)、吸附液pH值(2、3、4、5、6)、吸附温度(20、25、30、35、40 ℃)、解吸液乙醇体积分数(40%、50%、60%、70%、80%)和解吸液pH值(3、4、5、6、7)对静态吸附效果的影响。
1.3.4 艾草黄酮大孔树脂纯动态吸附和解吸试验 以上样液流速2 mL·min-1、上样液与树脂体积质量比V(艾草黄酮上样液/mL)∶m(大孔树脂质量/g)= 8∶1,洗脱液流速2 mL·min-1,洗脱液与树脂体积质量比V(体积分数60%乙醇/mL)∶m(大孔树脂质量/g)= 10∶1为基础条件,考察上样液流速(1.0、1.5、2.0、2.5、3.0 mL·min-1)、上样液与树脂体积质量比(V(艾草黄酮上样液/mL)∶m(大孔树脂质量/g)=1∶1、2∶1、3∶1、4∶1、5∶1、6∶1、7∶1、8∶1、9∶1、10∶1、11∶1、12∶1)、洗脱液流速(1.0、1.5、2.0、2.5、3.0 mL·min-1)和洗脱液与树脂体积质量比(V(体积分数60%乙醇/mL)∶m(大孔树脂质量/g)=1∶1、2∶1、3∶1、4∶1、5∶1、6∶1、7∶1、8∶1、9∶1、10∶1)对动态吸附和解吸效果的影响。
1.3.5 超高效液相色谱-高分辨质谱联用 将艾草黄酮样品溶于体积分数60%乙醇,色谱柱为waters BEH C18,液相色谱条件为流动相A为体积分数0.1%甲酸水溶液,流动相B为甲醇溶液;流速0.3 mL·min-1;进样量5 μL。梯度洗脱程序如下:0~1 min流动相B维持在10%,1~8 min流动相B升至48%,8~14 min流动相B维持48%,14~20 min流动相B上升至100%,20~25 min流动相B维持100%,进样量5 μL,流速0.3 mL·min-1;安捷伦QTOF6550质谱仪进行质谱分析,电喷雾离子源,负离子扫描模式,扫描范围100~900 m·z-1,去簇电压100 V,喷雾电压3 200 V,离子化温度350 ℃,雾化气0.38 MPa,辅助气0.38 MPa,气帘气0.21 MPa。
1.3.6 艾草黄酮纯化物纯度测定及抗氧化活性评价 ①艾草黄酮纯化物纯度的测定,按照大孔树脂纯化艾草黄酮方法制备艾草黄酮纯化液,冷冻干燥后得到艾草黄酮粉末。准确称取艾草黄酮冷冻干燥粉末100 mg,溶于50 mL体积分数60%乙醇中制得供试品溶液,紫外分光光度法测定黄酮浓度并计算纯度,计算公式见式(5)。
(5)
式中:C为艾草黄酮的纯度;n为供试品溶液的黄酮质量浓度;V为供试品溶液的体积;m为称取的艾草黄酮粉末质量。
②艾草黄酮提取物对DPPH自由基清除率(抑制率)[15]的测定,计算公式见式(6)。
(6)
式中:Q为DPPH自由基清除率;Ai为2 mL样品溶液+ 2 mL 0.1 mol·L-1DPPH溶液的吸光度;Aj,为2 mL样品溶液+ 2 mL无水乙醇的吸光度;Ac为2 mL无水乙醇+ 2 mL 0.1 mol·L-1DPPH溶液的吸光度。
③艾草黄酮提取物对羟自由基清除率(抑制率)[15]的测定,计算公式见式(7)。
(7)
式中:Q为羟自由基清除率;A1为2 mL 9 mmol·L-1FeSO4溶液+2 mL 9 mmol·L-1水杨酸-乙醇+2 mL 9 mmol·L-1H2O2的吸光度;A2为2 mL 9 mmol·L-1FeSO4溶液+2 mL 9 mmol·L-1水杨酸-乙醇的吸光度;A0为2 mL 9 mmol·L-1FeSO4溶液+2 mL 9 mmol·L-1水杨酸-乙醇+2 mL 9 mmol·L-1H2O2的吸光度。
1.4 数据处理
试验中数据均为3次平行所得,用平均值±标准差表示,所有数据在Excel中统计整理,采用SPSS 22.0进行显著性分析,GraphPad Prism 8作图处理。
2 结果与分析
2.1 不同型号大孔树脂对艾草黄酮的吸附与解吸效果
不同型号大孔树脂具有极性、粒径和孔径特异性,导致吸附和解吸性能不同[16]。由表1可知,18种大孔树脂中,H1020型大孔树脂的吸附量和吸附率均最高,分别为53.70 mg·g-1和89.51%;HPD722型大孔树脂对艾草黄酮的吸附量仅次于H1020型,分别为48.01 mg·g-1和80.02%。HPD722型树脂对艾草黄酮的解吸量和解析率均最高,分别为33.10 mg·g-1和68.92%,并且与其他树脂相比有显著性差异。作为合适的纯化树脂不仅要求吸附能力强,更需要一定的解吸能力。HPD722型树脂对艾草黄酮具有最佳的吸附与解吸性能。因此,选取HPD722大孔树脂作为艾草黄酮的最佳纯化分离树脂。HPD722型树脂为弱极性树脂,表明艾草黄酮类物质主要为弱极性物质。
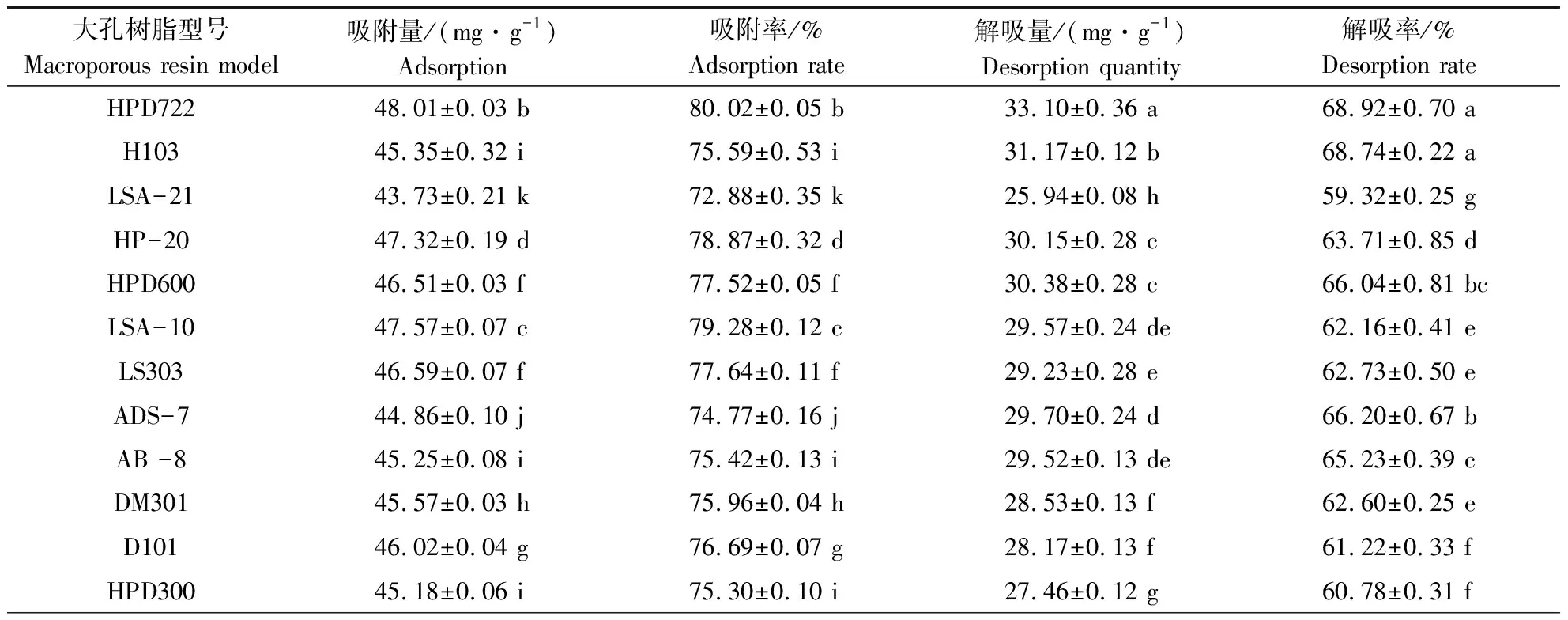
表1 不同型号大孔树脂对艾草黄酮的吸附与解吸性能
2.2 不同因素对艾草黄酮提取液静态吸附和解吸影响
2.2.1 HPD722型大孔树脂的静态吸附动力学曲线 HPD722型大孔树脂的静态吸附动力学曲线如图1所示。随着吸附时间增加,大孔树脂对艾草黄酮的吸附率呈上升趋势。当吸附时间超过150 min时,吸附率之间没有显著性差异,表现为静态吸附动力学曲线逐渐平缓,基本达到吸附平衡,在300 min时最大吸附率为81.63%;考虑吸附效果及时间成本,静态吸附时间确定为150 min。
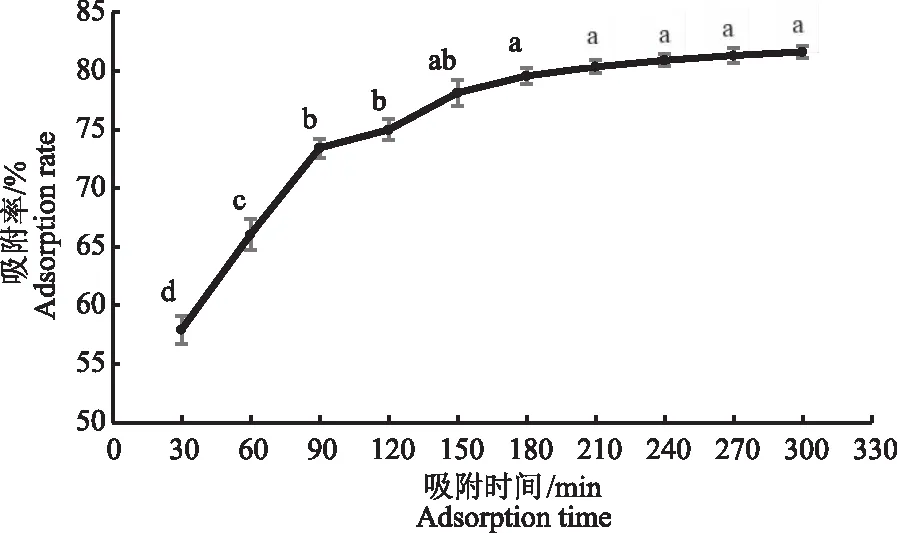
注:不同小写字母表示相同指标内差异显著(P<0.05)。下同。
2.2.2 艾草黄酮粗提液吸附质量浓度的确定 由图2可知,艾草黄酮吸附量与吸附液质量浓度呈正相关,而吸附率呈先上升后下降的趋势。当吸附液质量浓度为1.5 g·L-1时,大孔树脂对艾草黄酮的吸附率最高。综合考虑,选择艾草黄酮粗提液吸附时质量浓度为1.5 g·L-1。
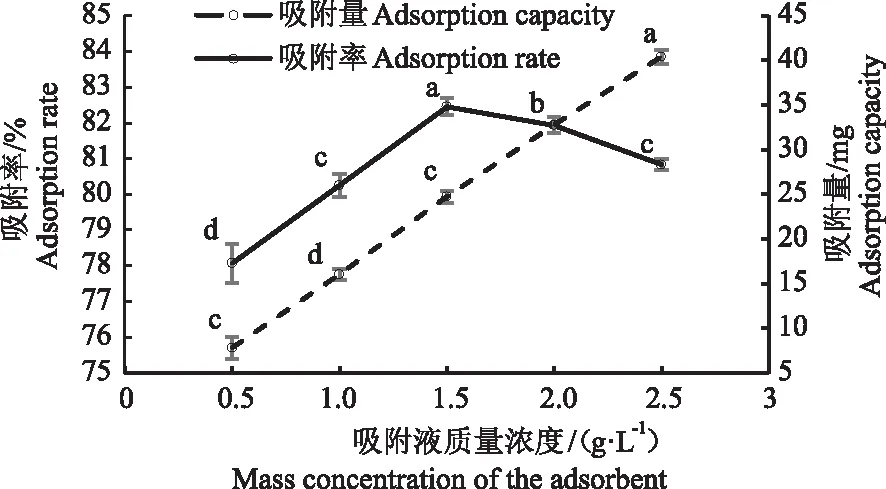
图2 艾草黄酮吸附液的质量浓度对大孔树脂吸附效果的影响
2.2.3 艾草黄酮粗提液吸附pH值的确定 由图3可知,当pH值3时,大孔树脂对艾草黄酮的吸附效果最佳,显著高于其他pH值时的艾草黄酮吸收率。这可能是因为黄酮类化合物其结构中大多含有酚羟基呈现酸性,黄酮类物质在酸性条件下结构稳定。本研究选择吸附液pH值为3。
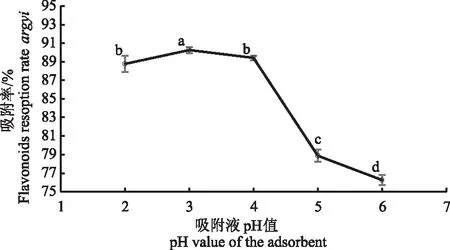
图3 艾草黄酮吸附液pH值对大孔树脂吸附效果的影响
2.2.4 艾草黄酮粗提液吸附温度的确定 黄酮类物质热稳定性较好,常温条件下不易分解。由图4可知,艾草黄酮的吸附率随着吸附温度的升高呈现先上升后下降的趋势。当吸附温度为25 ℃时,大孔树脂对艾草黄酮的吸附率达到90.3%,显著高于其他温度。吸附温度可能是通过影响大孔树脂的活性导致对艾草黄酮吸附效果的变化,本研究选择吸附温度为25 ℃。
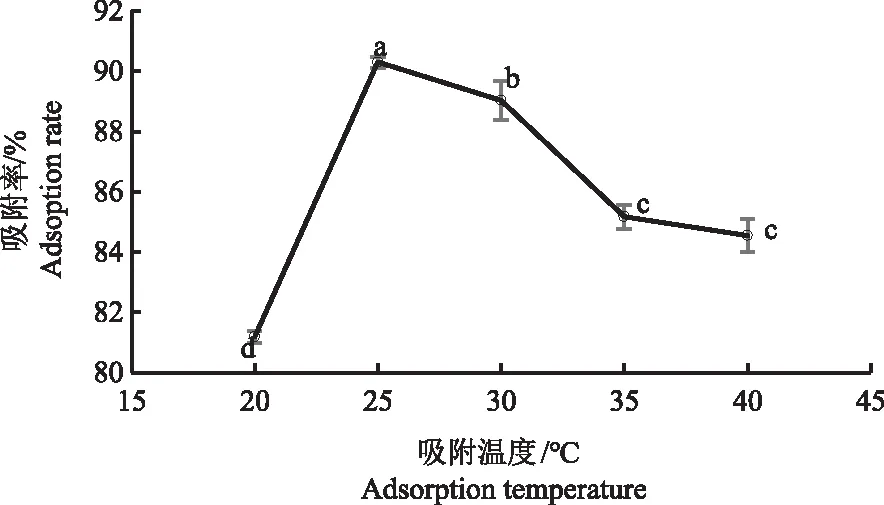
图4 艾草黄酮吸附液温度对大孔树脂吸附效果的影响
2.2.5 艾草黄酮解吸液乙醇体积分数的确定 由图5可知,随着乙醇体积分数的升高,艾草黄酮的解吸率逐渐升高。当解吸液乙醇体积分数为50%和60%时,艾草黄酮的解吸率分别为70.07%和71.24%,显著高于其他乙醇体积分数。当解吸液乙醇体积分数大于60%时,解吸效果呈下降趋势。乙醇体积分数较小时,部分黄酮类化合物不易与大孔树脂解离;乙醇体积分数较大时,附着的醇溶性杂质也容易解吸,影响艾草黄酮解吸效果。故本研究选择解吸液乙醇体积分数为60%。
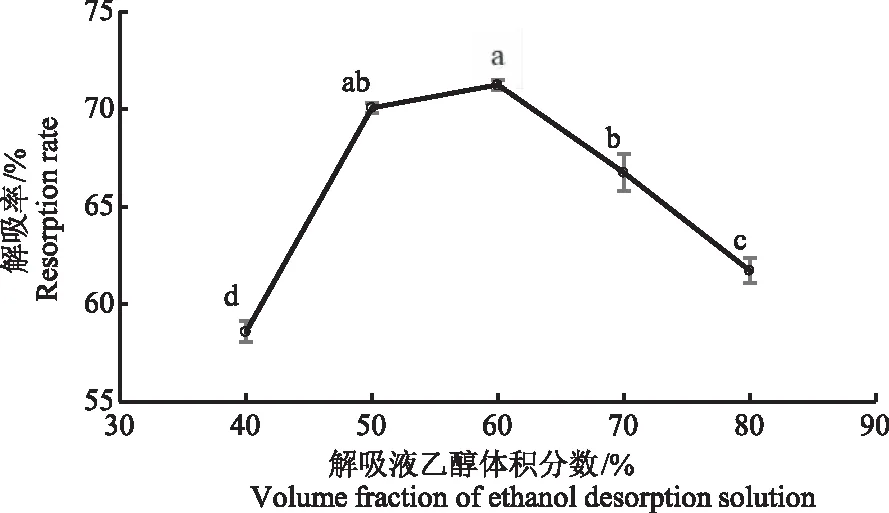
图5 艾草黄酮解吸液的乙醇体积分数对大孔树脂解吸效果的影响
2.2.6 艾草黄酮解吸液pH值的确定 由图6知,随着解吸液pH值升高,艾草黄酮解吸率呈先升高后下降的趋势。当解吸液pH值为6时,解吸率达到最高76.8%,显著高于其他pH值。故本研究选择解吸液pH值为6。
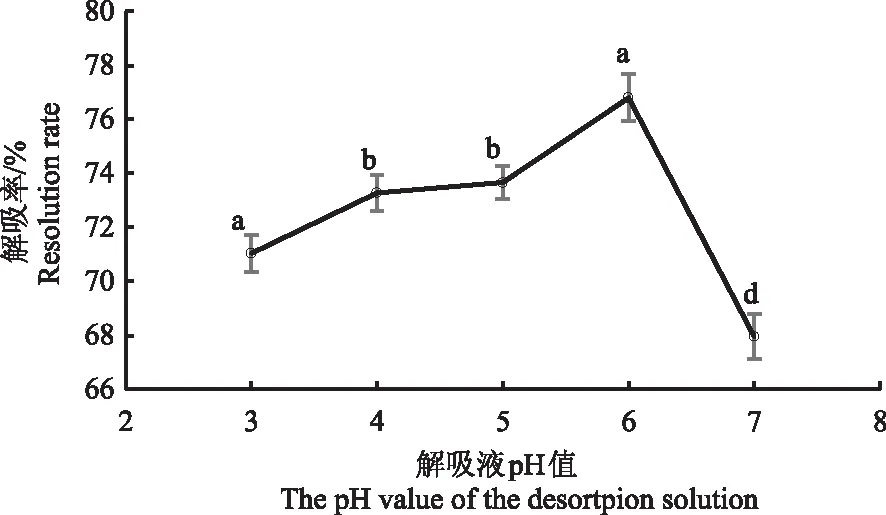
图6 艾草黄酮解吸液pH值对大孔树脂解吸效果的影响
综上,选择静态吸附时间150 min、吸附液质量浓度1.5 mg·mL-1、吸附液pH值3、吸附温度25 ℃、解吸液乙醇体积分数60%、解吸液pH值6为艾草黄酮提取液静态吸附和解吸的优化条件。
2.3 不同因素对艾草黄酮粗提液动态吸附和解吸效果影响
2.3.1 上样液流速对艾草黄酮粗提液动态吸附效果的影响 由图7可知,随着上样液流速的增大,大孔树脂对艾草黄酮的吸附量和吸附率均呈现下降趋势。当上样液流速在1.5~2.0 mL·min-1时,吸附量和吸附率趋向平稳,两者之间无显著性差异。当上样液流速大于2.0 mL·min-1时,大孔树脂对艾草黄酮的吸附量和吸附率呈显著降低趋势。考虑到吸附效果及时间成本,本研究选择最佳上样液流速为2.0 mL·min-1。
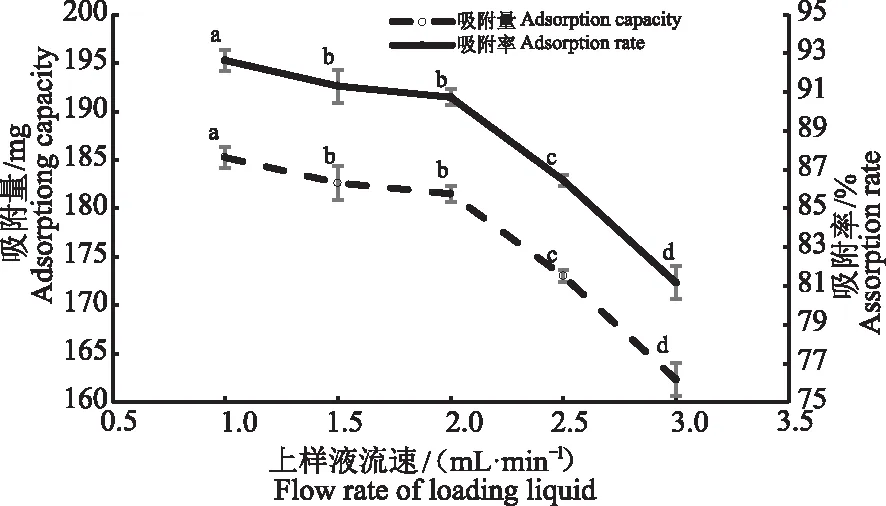
图7 上样液流速对艾草黄酮大孔树脂吸附效果的影响
2.3.2 上样液用量对艾草黄酮粗提液动态吸附效果的影响 上样液与树脂的体积质量比大小对艾草黄酮的动态吸附效果会产生一定的影响。由图8可知,随着上样液与树脂的体积质量比的增大,大孔树脂对艾草黄酮的吸附量以及泄漏液中黄酮浓度均呈现上升趋势。当上样液与树脂体积质量比V(艾草黄酮上样液/mL)∶m(大孔树脂质量/g)为10∶1时,泄漏液中黄酮质量浓度为0.256 g·L-1,已经大于上样液质量浓度2.5 g·L-1的1/10,故选择上样液用量为上样液与树脂体积质量比V(艾草黄酮上样液/mL)∶m(大孔树脂质量/g)=10∶1。
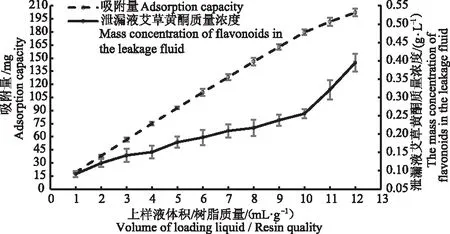
图8 上样液体积/树脂质量对艾草黄酮大孔树脂吸附效果的影响
2.3.3 洗脱液流速对艾草黄酮粗提液动态吸附效果的影响 由图9可知,随着洗脱液流速的增加,艾草总黄酮的回收效果呈现下降趋势,当洗脱液流速在1.0~1.5 mL·min-1时,艾草总黄酮的回收量和回收率均显著高于其他水平。流速越快,艾草总黄酮的回收量和回收率呈现下降趋势。考虑到时间成本的差异,本研究选择最佳洗脱液流速为1.5 mL·min-1。

图9 洗脱液流速对艾草黄酮大孔树脂洗脱效果的影响
2.3.4 洗脱液用量对艾草黄酮粗提液动态吸附效果的影响 洗脱液与树脂的体积质量比大小也是影响艾草总黄酮动态吸附效果的另一个因素。由图10可知,随着洗脱液与树脂的体积质量比的增大,艾草总黄酮的回收量先增加再趋于平缓,在洗脱液与树脂的体积质量比≥4∶1时,艾草总黄酮的回收量之间无显著差异;洗脱液中艾草总黄酮的质量浓度先下降后趋于平缓,在洗脱液与树脂的体积质量比≥6∶1时,洗脱液中艾草总黄酮的质量浓度之间无显著差异。因此,选择洗脱液与树脂体积质量比的最佳值为V(体积分数60%乙醇/mL)∶m(大孔树脂质量/g)=6∶1。

图10 洗脱液体积/树脂质量对艾草黄酮大孔树脂洗脱效果的影响
2.4 艾草黄酮纯化物超高效液相色谱-质谱联用组分鉴定结果
艾草黄酮纯化物的超高效液相色谱-质谱联用(UPLC-QTOF-MS/MS)图谱如图11所示,主要特征组分的二级质谱图解析结果如表2所示。UPLC-QTOF-MS/MS共鉴定出11种主要化合物,其中5种为黄酮类物质,分别为3种黄酮类(异泽兰黄素、高车前素、木犀草素)、2种黄酮醇类(芦丁、槲皮素)。化合物1、化合物2、化合物3、化合物5和化合物6根据搜库结果显示其为α-羟甲基丝氨酸、3,4-二羟基苯甲醛、3-羟基香豆素、8,10,12-三炔-6-烯-十四-3-酮和2-(1-乙氧基-2-羟丙基)-4-甲氧基苯酚。化合物4分子离子为[M-H]-m/z179,m/z135为碎片[M-H-CO2]-,是咖啡酸的裂解特征碎片[17],表明该化合物为咖啡酸。化合物7分子离子为[M-H]-m/z609,与芦丁特征一致,其离子碎片中m/z463为m/z609丢失末端Rha糖分子的碎片[18]。此外,m/z609的糖苷键断裂丢失芸香糖导致m/z301的产生,m/z301丢失C环一分子的CO2形成m/z257,m/z211可能是m/z301的另一种裂解途径的最终产物碎片,根据其裂解规律推测其为芦丁;化合物8分子离子为[M-H]-m/z301,与槲皮素特征一致;槲皮素在负离子扫描模式很容易丢失一个H,得到m/z301;槲皮素为黄酮醇类物质,主要在C环发生裂解,原A环与C环联结部分再次失去CO可得到槲皮素裂解特征碎片m/z151[19],故推测化合物8为槲皮素。化合物9分子离子为[M-H]-m/z285,结构可能为木犀草素,母离子m/z285通过在C环的裂解生成木犀草素裂解特征碎片m/z133,表明化合物9为木犀草素。化合物10分子离子为[M-H]-m/z299,与高车前素结构相近,m/z284为母离子m/z299失去一个CH3的碎片,m/z136和m/z146为m/z284裂解的碎片,推测化合物10为高车前素。化合物11分子离子为[M-H]-m/z343,结构同异泽兰黄素相近,m/z313为母离子m/z343裂解失去2个CH3的碎片,m/z163为m/z313裂解特征碎片[20],表明化合物11为异泽兰黄素。
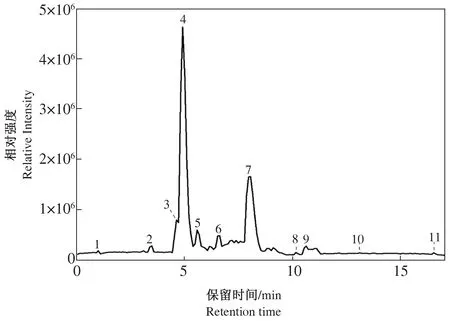
图11 艾草黄酮纯化物的UPLC-MS基峰色谱图
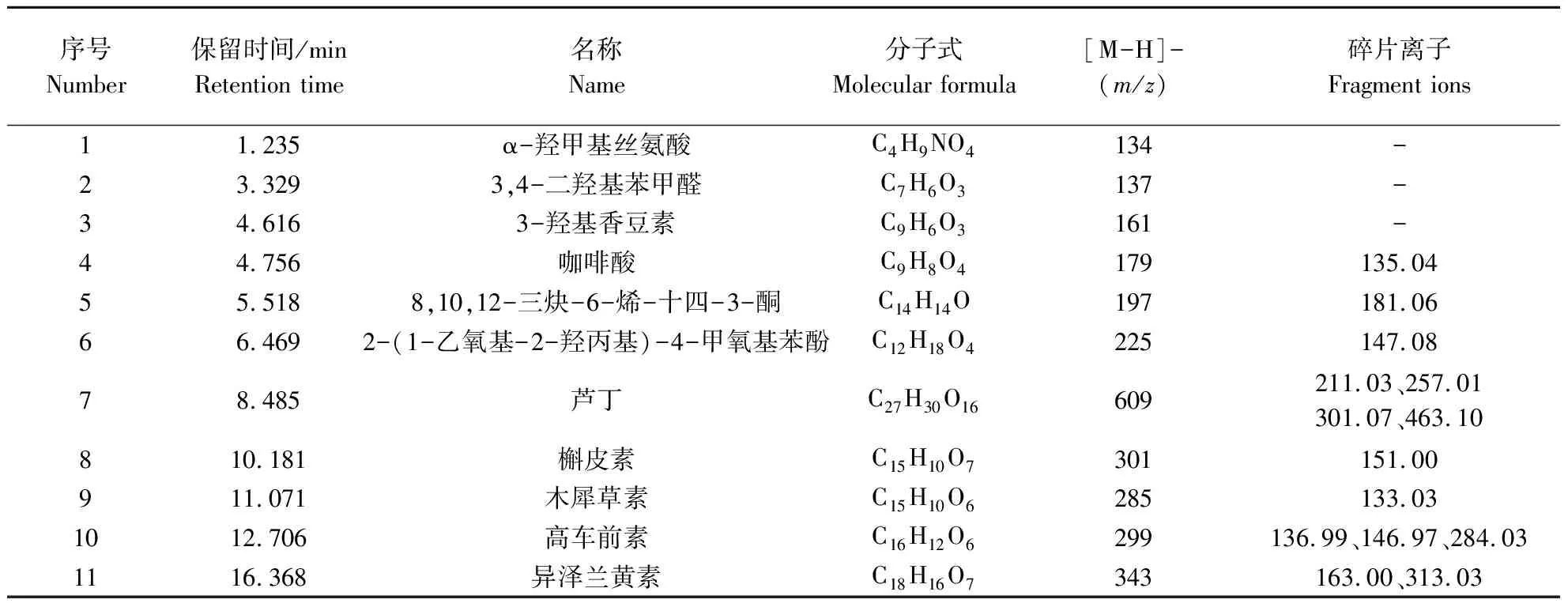
表2 艾草黄酮提取物的UPLC-MS鉴定结果
2.5 艾草黄酮纯化物纯度及抗氧化活性评价
紫外分光光度法测定草黄酮纯化物的纯度为92.13%。为了探索纯化后艾草黄酮的抗氧化活性,以维生素C溶液作为对照,对艾草黄酮纯化物清除DPPH自由基和羟自由基的能力进行了测定,结果如图12和图13所示。随着供试液质量浓度升高,艾草黄酮纯化物溶液对DPPH自由基和羟自由基清除率呈上升趋势。当艾草黄酮纯化物溶液质量浓度为1.5 g·L-1时,可完全清除2种自由基,达到与维生素C一样的清除效果,表明艾草黄酮纯化物具有良好的抗氧化活性,这与SEO等[21]的描述一致。
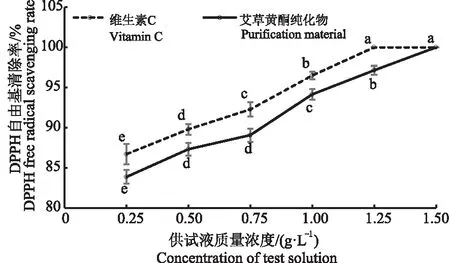
图12 艾草黄酮提取物溶液与维生素C溶液对DPPH自由基的清除率的影响

图13 艾草黄酮提取物溶液与维生素C溶液对羟自由基的清除率的影响
3 结论与讨论
本研究比较了18种大孔树脂对艾草黄酮粗体液的静态吸附与解吸性能,选用HPD722大孔树脂进行了艾草黄酮的静态和动态的吸附和解吸的参数优化,采用液质联用技术对艾草黄酮的纯化物进行了组分分析,并对其抗氧化性进行了初步评价,发现HPD722树脂对艾草黄酮的吸附与解吸效果较好。上样液艾草黄酮粗提液质量浓度1.5 g·L-1、pH值3、吸附温度25 ℃、流速2.0 mL·min-1、上样液与树脂体积质量比V(艾草黄酮上样液/mL)∶m(大孔树脂质量/g)为10∶1,以及洗脱液为体积分数60%乙醇、pH值6、流速 1.5 mL·min-1、洗脱液与树脂体积质量比V(体积分数60%乙醇/mL)∶m(大孔树脂质量/g)为6∶1时,在此纯化条件下的艾草黄酮纯度为92.13%。超高效液相-高分辨质谱联用扫描结果共鉴定艾草黄酮纯化物含有芦丁、槲皮素、木犀草素、高车前素和异泽兰黄素5种黄酮类化合物。同时,还存在 3,4-二羟基苯甲醛、3-羟基香豆素和咖啡酸3种化合物。艾草黄酮纯化物在质量浓度为1.5 g·L-1时可完全清除1,1-二苯基-2-三硝基苯肼(DPPH)和羟基自由基,与维生素C的清除效果相同。本研究结果为艾草黄酮的纯化应用提供了技术支持,为艾草黄酮的活性研究奠定基础,并为其在功能健康产品方面的综合开发利用提供了理论依据。
艾草黄酮种类多并且结构复杂,使得分离纯化十分困难,影响了其活性研究及在食品中的应用开发。大孔树脂是黄酮类物质纯化中的常用选择。孙美玲等[22]研究了大孔树脂对水晶冰菜总黄酮的纯化。谭颂严等[23]研究了大孔树脂对苦丁茶总黄酮的纯化。郑必胜等[24]研究了木棉花黄酮的大孔树脂纯化。纯化树脂的选择需要兼具良好的吸附和解吸性能。本研究筛选出HPD722型大孔树脂作为艾草黄酮粗提液的纯化树脂,是因为在静态吸附与解吸试验中,与其他17种类型的树脂相比,HPD722型大孔树脂对艾草黄酮粗提液的吸附率为80.02%,解吸率为68.92%,显著高于其他树脂的性能,表明该树脂具有很好吸附与解吸能力。黄酮类物质酸性条件下结构稳定[4],当吸附液pH值大于3时,艾草黄酮的吸附率显著下降,这与艾草黄酮类化合物其结构中大多含有酚羟基呈现酸性,在酸性条件下比较稳定有关[5]。黄酮类物质热稳定性较好,常温条件下不易分解,当吸附温度为25 ℃时,大孔树脂对艾草黄酮吸附效果最好。黄酮类物质极性较弱,随着乙醇体积分数的升高,增加了氢键断裂,极性增大,艾草黄酮解吸率逐渐升高,当解吸液乙醇体积分数为60%时,对艾草黄酮的解吸效果最佳,乙醇体积分数继续升高,氢键全部断裂后,极性过大,解吸率反而降低[20]。目前,对艾草黄酮纯化的研究较少,产品的纯度也不高。与李杰等[11]和杨宇华等[12]的研究相比,本研究选用的大孔树脂种类更丰富,得到的艾草黄酮的纯度更高,达到92.13%。
纯化后的艾草黄酮经UPLC-QTOF-MS/MS分析表明,包含3种黄酮类(异泽兰黄素、高车前素、木犀草素),2种黄酮醇类(芦丁、槲皮素),以及其他3,4-二羟基苯甲醛、3-羟基香豆素和咖啡酸共3种化合物。异泽兰黄素、高车前素和木犀草素的存在形式均为黄酮苷元类化合物,黄酮苷元类化合物相对黄酮糖苷类化合物更易被机体吸收利用,表现出较强的抗炎、抗氧化能力[25].芦丁具有较强的清除自由基、抗氧化、抗病毒和抗炎等药理活性,是发现较早、应用较为广泛的一种黄酮类物质[26]。3,4-二羟基苯甲醛属于天然多酚类化合物,具有抗氧化、抑制细胞凋亡和抗炎作用[27]。咖啡酸是一种具有羟基苯烯酸结构的天然酚类化合物,具有升高白细胞、抗氧化、抗炎、抗癌等多种药理活性[28]。艾草黄酮纯化物的抗氧化评价也表明,1.5 g·L-1的艾草黄酮纯化物可以完全DPPH自由基和羟自由基,达到与维生素C相同的抗氧化效果,与何姿等[29]关于艾草黄酮抗氧化活性的研究结果一致。这也揭示了艾草黄酮的抗氧化活性可能与其中包含的黄酮类、黄酮醇类和3,4-二羟基苯甲醛、3-羟基香豆素、咖啡酸物质有关。

