卵泡刺激素、黄体生成素在绝经后女性子宫内膜息肉发病中的作用
方姗 俞昊 周丽仙
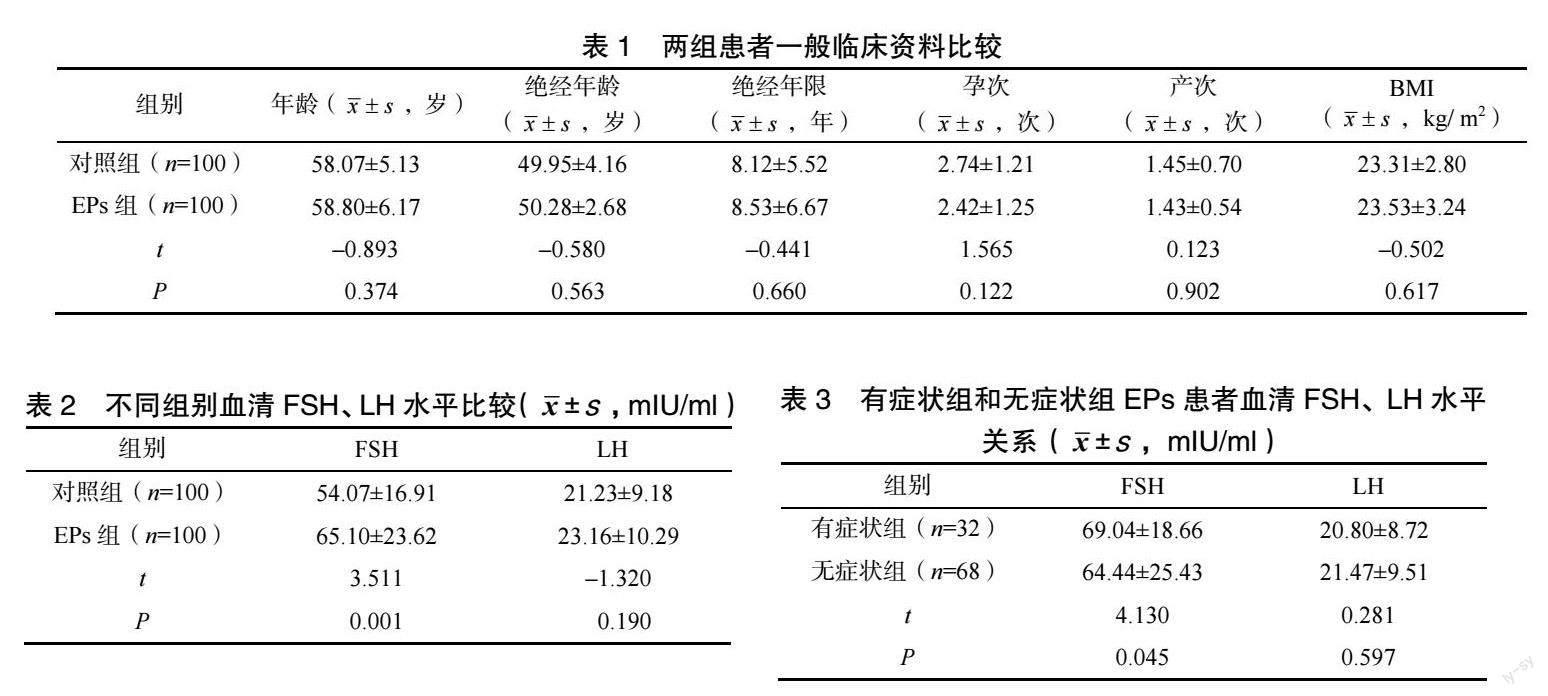
[摘要] 目的 探讨绝经后女性外周血中卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)水平与子宫内膜息肉(endometrial polyps,EPs)发病的相关性。方法 选取2018 年10 月至2021 年10 月嘉兴市妇幼保健院就诊的绝经后女性子宫内膜息肉患者100 例为EPs 组,选择同期同院健康体检且既往无EPs 病史的绝经后女性100 例为对照组,同时根据是否存在异常子宫出血症状分为有症状组和无症状组,收集各组入组患者临床资料,并采用酶联免疫荧光法检测血清FSH 及LH 水平,比较各组患者的FSH、LH 水平。结果 EPs 组与对照组一般临床资料比较,差异无统计学意义(P>0.05)。EPs 组血清FSH 水平明显高于对照组(P<0.05);有症状EPs 组患者血清FSH 水平明显高于无症状组(P<0.05);兩组血清LH 水平比较,差异无统计学意义(P>0.05)。结论 绝经后血清高水平FSH 可能参与EPs 的发病,且血清FSH 水平可能与EPs 患者发生异常子宫出血症状正相关。
[关键词] 绝经;卵泡刺激素;黄体生成素;子宫内膜息肉
[中图分类号] R711.74 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.12.007
子宫内膜息肉(endometrial polyps,EPs)是指由子宫内膜的腺体、内膜间质和血管组成的突出于子宫内膜表面的结节,直径可从数毫米到数厘米不等,是常见的子宫内膜病变之一,可引起异常子宫出血与不孕,少部分可恶变[1-2]。
EPs 的发病机制及原因尚未完全明确,目前多认为其为激素依赖性疾病[2],即此类患者子宫内膜息肉组织腺体中雌激素受体表达升高,而孕激素受体相对低表达,从而导致子宫内膜对雌激素过度反应增生形成息肉。但绝经会伴随有雌激素水平的明显下降,说明绝经后EPs 的高发可能具有多因素性。本研究拟以卵泡刺激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)为切入点,探讨其血清水平变化在绝经后女性子宫内膜息肉发病中的作用。
1 对象与方法
1.1 研究对象
选取2018 年10 月至2021 年10 月嘉兴市妇幼保健院就诊的绝经后女性子宫内膜息肉患者100 例为EPs 组(其中存在异常子宫出血症状的患者32 例,无症状患者68 例)。纳入标准:①绝经期标准:40岁女性月经完全停止1 年以上[3];②除外卵巢早衰、手术去势或药物化疗等引起的卵巢衰老;③下丘脑-垂体-卵巢/甲状腺疾病(如下丘脑性闭经等);④EPs诊断根据宫腔镜检查结果及术后病理确诊。排除标准:①近6 个月内行激素替代治疗;②有生殖系统炎症或感染;③有放置宫内节育器或接受宫腔手术操作;④生殖道恶性肿瘤病史;⑤激素相关疾病(如功能性卵巢肿瘤)。选择同期嘉兴市妇幼保健院健康体检且既往无EPs 病史的绝经后女性100 例为对照组,本研究经嘉兴市妇幼保健院医学伦理委员会审批同意[伦理审批号:2019(伦)-28)]。
1.2 方法
收集两组患者一般临床资料包括:年龄、绝经年龄、绝经年限、孕次、产次及体质量指数(body massindex,BMI)。所有患者均于就诊次日9 时通过肘静脉取外周血5ml,采用酶联免疫吸附法检测血清FSH、LH 水平。
1.3 统计学方法
采用SPSS 22.0 统计学软件对数据进行处理分析,计数资料以例数(百分率)[n(%)]表示,组间比较采用2 检验;计量资料以均数±标准差(x s )表示,组间比较采用t 检验,两两比较采用LSD-t 检验,多因素进行Logistic 回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般临床资料比较
EPs 组与对照组比较,年龄、绝经年龄、绝经年限、孕次、产次及BMI 比较,差异均无统计学意义(P>0.05),见表1。
2.2 不同组别血清FSH、LH 水平比较
与对照组比较,EPs 组血清FSH 水平显著升高(P<0.05),两组血清LH 水平比较,差异无统计学意义(P>0.05),见表2。
2.3 EPs 患者有症状组和无症状组血清FSH、LH水平比较
EPs 患者有症状组血清FSH 水平明显高于无症状组(P<0.05),但两组LH 水平比较,差异无统计学意义(P>0.05),见表3。
3 讨论
子宫内膜息肉是子宫内膜腺体过度增生形成的有蒂或无蒂的赘生物,是妇科常见疾病之一,好发于35 岁以上女性,随年龄增长发病率呈升高趋势。绝经是其公认的高危因素,但其具体机制不明。EPs在生育期患者主要表现为月经周期不规律、月经量过多、非经期出血及不孕等,在绝经期表现为异常子宫出血,且年龄>60 岁的患者发生恶变的概率显著增加[4]。随着经阴道超声和宫腔镜的广泛应用,子宫内膜息肉的检出率不断升高,既往研究认为高水平的雌激素是EPs 发生的重要原因,但绝经后EPs 发病率升高的同时且存在雌激素水平的显著下降,使学者对EPs 的发病机制提出了新的疑问。相关研究认为EPs 的发生、发展可能是多阶段、多因素的过程。近年来,关于绝经后女性生理性激素水平改变导致的高FSH、高LH 在绝经高发病中的作用日益被重视,为绝经后子宫内膜息肉发病机制的研究带来了新的思路。
FSH 和LH 是下丘脑-垂体-性腺轴中重要的信号分子,两者均是由脑垂体前叶嗜碱性细胞合成分泌的糖蛋白类激素。FSH 因可以刺激女性卵泡成熟而得名。绝经后女性血清FSH 水平明显升高,可达绝经前水平的10~20 倍(>40IU/L),且绝经后1~3年达到高峰,此后虽略有下降,但仍维持在较高水平。而根据EPs 流行病学调查显示,围绝经期或绝经后女性发病率达最高[5],70 岁以后少见,其发病的高峰年龄段与女性体内血清FSH 水平的变化趋势高度重合。本研究结果也发现,绝经后EPs 组血清FSH 水平较对照组升高,因此推测绝经后高水平的血清FSH 可能参与绝经后EPs 的发病,该结果有望为绝经后EPs 发病机制的研究提供新思路。
绝经也会伴随女性血清LH 水平的升高,绝经1 年左右血清LH 水平可升高3 倍以上(>30IU/L)。LH 主要与FSH 共同作用,参与女性排卵及黄体生成,促进雌、孕激素的分泌,及维持黄体功能等过程。研究发现,LH 存在于子宫内膜组织中[6]。但本研究结果显示,EPs 组与对照组间血清LH 水平差异无统计学意义,未提示血清LH 水平变化参与绝经后EPs 的发生。
异常子宫出血是绝经后EPs 患者的主要临床症状,既往研究显示[7],有出血症状的绝经后患者比无症状者更容易发生息肉恶变。本研究结果显示,有症状的EPs 组患者血清FSH 水平高于无症状组,提示高水平FSH 可能与EPs 导致的绝经后异常子宫出血具有相关性。FSH 通过与其特异性受体(folliclestimulating hormone receptor,FSHR)结合发挥生物学作用[8]。既往认为FSHR 仅存在于性腺细胞的细胞膜中,但最新研究发现在多种肿瘤细胞及非性腺细胞中均存在FSHR 表达并发挥重要的生理作用[9]。Guo 等[10]发现在肝细胞中表达的FSHR 介导了绝经后脂质代谢异常的发生。Lizneva 等[11]发现FSHR 表达于破骨细胞,并与绝经后骨质疏松发病有关;Li等[12]发现在血管内皮细胞存在FSHR 的表达并进一步参与绝经后动脉粥样硬化的过程。Radu 等报道[13],在多种肿瘤组织中FSHR 存在高表达,其表达量高于远离肿瘤中心部位的组织。Chung 等[14]研究发现FSHR 在卵巢恶性肿瘤细胞中表达明显高于正常细胞,且表达水平与肿瘤恶性程度呈正相关。亦有学者发现子宫内膜息肉组织及其旁正常子宫内膜组织中存在FSHR 的表达,且在子宫内膜息肉组织中表达更为明显[15]。而在一项动物实验中,研究者将FSH持续作用于体外培养的卵巢组织,其组织中的FSH受体也呈持续表达,表明FSH 可提高其受体表达水平[16],因此推测绝经后血清高水平的FSH 可能通过与子宫内膜息肉组织中的FSHR 作用,在局部炎症、激素受体紊乱、诱导血管增生等方面参与EPS 恶变的发生、发展。
综上所述,绝经后机体内生殖内分泌激素水平的显著变化导致一系列绝经相关性疾病的发生。本研究以绝经后EPs 的发病与外周血FSH、LH 水平为切入点,为研究绝经后EPs 的发病机制提供了新的思路和有效的依据。
[参考文献]
[1] SHENG K K,LYONS S D. To treat or not to treat? Anevidence-based practice guide for the management ofendometrial polyps[J]. Climacteric, 2020, 23(4): 336–342.
[2] MUNRO M G, CRITCHLEY H, FRASER I S. TheFIGO systems for nomenclature and classification ofcauses of abnormal uterine bleeding in the reproductiveyears: Who needs them?[J]. Am J Obstet Gynecol, 2012,207(4): 259–265.
[3] 谢幸, 孔北华, 段涛. 妇产科学[M]. 9 版. 北京: 人民卫生出版社, 2018: 13–14.
[4] 张颖, 陈梅, 郭银树, 等. 绝经后妇女子宫内膜息肉样癌及其癌前病变的临床特点及宫腔镜诊断价值[J].中华妇产科杂志, 2016, 51(5): 366–370.
[5] 朱兰, 李雷. 子宫内膜息肉诊疗现状[J]. 中国实用妇科与产科杂志, 2022, 38(3): 257–258.
[6] SANDRO S, PAOLA S, CHIARA D E, et al. Evidencefor expression and functionality of FSH and LH/hCGreceptors in human endometrium[J]. J Assist ReprodGenet, 2018, 35(9): 1703–1712.
[7] 王翔, 颜琪, 田文艳, 等. 绝经后子宫内膜息肉的临床病理分析[J]. 中华妇产科杂志, 2021, 56(2): 131–136.
[8] SELVARAJ N, SRIRAMAN V, STEPHEN P, et al.Allosteric regulation of the follicle- stimulating hormonereceptor[J]. Endocrinology, 2018, 159(7): 2704–2716.
[9] 方姗, 朱巍立. 卵泡刺激素及其受体在女性绝经相关性疾病中的研究进展[J]. 中华老年医学杂志, 2022,41(1): 111–114.
[10] GUO Y, ZHAO M, BO T, et al. Blocking FSH inhibitshepatic cholesterol biosynthesis and reduces serumcholesterol[J]. Cell Research, 2019, 29(2): 151–166.
[11] LIZNEVA D, RAHIMOVA A, KIM S M, et al. FSHbeyond fertility[J]. Front Endocrinol, 2019, 10: 136.
[12] LI X, CHEN W, LI P, et al. Follicular stimulating hormoneaccelerates atherogenesis by increasing endothelialvcam-1 expression[J]. Theranostics, 2017, 7(19): 4671–4688.
[13] RADU A, PICHON C, CAMPARO P, et al. Expressionof follicle-stimulating hormone receptor in tumor bloodvessels[J]. N Engl J Med, 2010, 363(17): 1621–1630.
[14] CHUNG H, LEE J C, MINN I. Follicle-stimulatinghormone receptor in gynecological cancers[J]. Mol CellToxicol, 2018, 14(1): 1–7.
[15] 徐超逸, 王丹菡, 余丹揚, 等. 子宫内膜息肉组织中FSHR 和LHR 的表达及意义[J]. 中国现代医生, 2019,57(27): 17–21.
[16] 沈亚, 陈丽, 谭小方, 等. 卵泡刺激素受体基因多态性与卵巢过度刺激综合征的相关性[J].实用医学杂志,2016, 32(12): 1994–1996.
(收稿日期:2022–09–15)
(修回日期:2023–01–12)

