抗中性粒细胞胞浆抗体的临床疾病分布及特征分析*
王春莹,张 婷,许 颖
成都医学院第一附属医院 检验科(成都 610500)
抗中性粒细胞胞浆抗体(anti-neutrophil cytoplasmic antibody,ANCA)是针对中性粒细胞和单核细胞胞浆成分的自身抗体。1982 年,在节段性坏死性肾小球肾炎患者血清中发现一种IgG类性质的抗体,而这类抗体的靶抗原就是中性粒细胞胞浆抗原,又称为ANCA[1]。1985年,在Wegner肉芽肿(Wegner granuloma,WG)患者血清中又发现了ANCA的存在[2]。有学者[3]发现,ANCA与其他血管炎都有相关性,其诱导中性粒细胞和单核细胞活化,释放毒性蛋白,可造成坏死性小血管炎。研究[4]表明,ANCA参与原发性小血管炎的发生发展,其已成为原发性小血管炎的主要血清学诊断工具。
目前,ANCA检测方法主要有两种,间接荧光法(indirect immunofluorescence,IIF)和酶联免疫法(enzyme linked immunosorbent assay,ELISA)。IIF是国际公认的检测ANCA的金标准,根据IIF检测的荧光模型形态不同,ANCA分为核周型抗中性粒细胞胞浆抗体(perinuclear anti-neutrophil cytoplasmic antibody,pANCA)和胞浆型抗中性粒细胞胞浆抗体(cytoplasmic anti-neutrophil cytoplasmic antibody,cANCA)[5]。ANCA相关血管炎是以免疫小血管炎和致病性ANCA存在为特点,包括显微镜下多血管炎、肉芽肿性多血管炎和嗜酸性肉芽肿性多血管炎[6]。对ANCA内部多种靶抗原进行检测发现,其靶抗原以髓过氧化物酶(myeloperoxidase,MPO)和蛋白酶3(protease 3,PR3)为主,且这两种类型在荧光显微镜下呈现的结果不同[7]。PR3 主要是cANCA的抗原,属于中性丝氨酸蛋白酶家族中的一员,由228 个氨基酸组成,相对分子质量为29~33 kDa,PR3 作用于血管壁成分,如弹力蛋白及其他细胞外基质,作用的结局可将弹力蛋白进行降解及消化。cANCA是WG的特异性抗体[8]。MPO是pANCA主要抗原物质,其相对分子质量为146 kDa,由两条重链和两条轻链组成,是中性粒细胞内浓度最高的蛋白质,MPO具有催化作用,体现在中性粒细胞的氧爆炸或产生超氧阴离子过程。pANCA与显微镜下多动脉炎相关,但其相关性不及cANCA与WG的相关性[9]。
ANCA在系统性红斑狼疮(systemiic lupus erythematosus,SLE)、类风湿性关节炎(rheumatoidarthritis,RA)、系统性硬化症(systemic sclerosis,SSc)、干燥综合征(Sjögren's syndrome,SS)、间质性肺疾病(interstitial lung disease,ILD)、慢性阻塞性肺疾病(chronic obstructive pulmoriary disease,COPD)、结缔组织病(connective tissue diseases,CTD)中也出现[10-11]。本研究回顾性分析ANCA阳性患者的临床资料及信息,以探索ANCA与自身免疫性疾病的相关性及分布情况。
1 材料与方法
1.1 临床资料
选取2015年1月至2021年9月在成都医学院第一附属医院收治的自身免疫性疾病患者ANCA阳性者247例,其中pANCA阳性106例,男31例,女75例,男∶女=1∶2.42,年龄16~85(61.63±13.53)岁。cANCA阳性141例,男87例,女54例,男∶女=1.61∶1,年龄17~89(60.26±16.94)岁。纳入标准:1)首诊为自身免疫性疾病的住院患者;2)所有患者均进行ANCA检测,包括间接免疫荧光法:cANCA、pANCA,蛋白质印记技术:MPO-ANCA、PR3-ANCA,所有患者均进行了抗核抗体谱(antinuclear antibody,ANA)检测;3)临床资料完整。排除标准:1)临床诊断不明确或不符合疾病诊断标准者;2)临床资料不完整者。本研究通过成都医学院第一附属医院伦理委员会批准(伦理审批号:2022CVFYIREBA-Dec06)。
1.2 试剂与仪器
ANCA荧光核型分析采用杭州医学实验诊断有限公司提供的抗中性粒细胞/抗肾小球基底膜抗体IgG检测试剂盒,ANA的荧光核型分析采用杭州医学实验诊断有限公司提供的抗核抗体IgG检测试剂盒,显微镜使用德国蔡斯公司生产的Axio Imager荧光显微镜。靶抗原检测采用深圳市亚辉龙生物科技有限公司生产的Tenfly Auto免疫印迹仪。
1.3 方法
查阅病历,收集并登记pANCA阳性患者性别、年龄、收治科室、诊断信息及ANA检测结果等资料。采用2012 年教堂山会议共识[12]作为ANCA相关性血管 炎(anti-neutrophil cytoplasmic antibody-associated vasculitis,AAV)诊断标准,2019年美国风湿学会(American rheumatism association,ACR)[13]制 定 的SLE诊断标准诊断SLE,采用2010 年欧洲抗风湿病联盟(European league against,EULAR)/ACR[14]制定的RA分类诊断标准诊断RA,SSc、SS、ILD、COPD、CTD等均采用相应的诊断标准进行诊断。
1.4 统计学方法
采用SPSS 25.0统计软件进行数据分析,符合正态分布的定量资料以()描述,定性资料以例数(%)描述,两组数据间精密度差异分析采用F检验,组间比较采用连续校正χ2检验,检验水准α除特别说明外均设定为0.05。
2 结果
2.1 ANCA 阳性患者不同性别及年龄比较
ANCA阳性患者随着年龄增长阳性率逐渐增高,与其他年龄组相比,60 岁以上年龄组患者无论男性或女性阳性数量均增加,差异有统计学意义(P<0.05)(表1)。20 岁以下及60 岁以上年龄组患者男性与女性阳性数量差异无统计学意义(P>0.05),其他年龄组女性阳性数量均高于男性(P<0.05)(表1)。pANCA阳性患者各年龄段女性均多于男性,阳性率均随年龄增长而增加(图1);cANCA患者50 岁以下女性居多,50 岁及以上男性比例逐渐超过女性,男性患者以cANCA阳性为主(图2)。
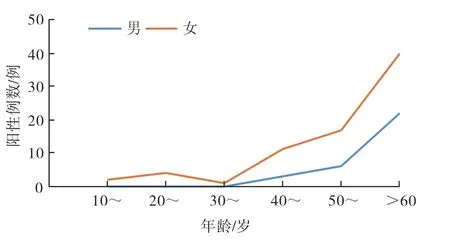
图1 pANCA阳性患者不同性别增长趋势

图2 cANCA阳性患者不同性别增长趋势

表1 ANCA阳性患者不同性别及年龄比较[n(%)]
2.2 ANCA 阳性患者临床表现及特征
247 例ANCA阳性患者临床表现包括非特异性临床症状,如发热、乏力、盗汗、关节肿痛、肌痛等;呼吸系统表现为:咳嗽、咯血、呼吸困难;肾脏受累表现为:血尿、蛋白尿、双下肢水肿等;其他还表现有皮肤症状皮疹、斑丘疹、溃疡、结节红斑等;消化系统表现为消化道出血、腹泻;中枢神经系统受累表现为肌张力下降、四肢麻木、运动障碍;心血管系统表现为胸闷、胸痛、心悸等。其中,表现为非特异性临床症状患者有105例(42.51%),大多就诊于风湿免疫科,cANCA阳性患者75 例(30.36%),pANCA阳性患者30 例(12.15%)。呼吸系统受累患者43 例(17.41%),cANCA阳性患者27 例(10.93%),pANCA阳性患者16 例(6.48%)。肾脏受累患者54 例(21.86%),cANCA阳性患者20 例(8.10%),pANCA阳性患者34 例(13.77%)。中枢神经系统受累患者15 例(6.07%),cANCA阳性患者9 例(3.64 %),pANCA阳性患者6 例(2.43 %)。其他包括心血管系统、皮肤、消化系统受累表现患者30 例(12.15%)(表2)。

表2 ANCA阳性患者临床表现及特征[n(%)]
2.3 ANCA 阳性患者的疾病分布
247 例ANCA阳性患者中,cANCA阳性141 例,pANCA阳性106 例,诊断为AAV的183 例(74.09%),其中cANCA阳性117例,pANCA阳性66例。141例cANCA阳性患者中,cANCA联合PR3-ANCA阳性者117 例(82.98%)。除AAV以外,cANCA阳性的自身免疫性疾病包括溃疡性肠炎(ulcerstive colitis,UC)5 例(3.54 %)、SLE 4 例(2.83 %)、COPD 3 例(2.13 %)、肺间质纤维化(interstitial pneumonia fibrosis,IPF)4例(2.83%)、冠状动脉粥样硬化(coronary atherosclerotic heart disease,CHD)3例(2.13%)、其他种类疾病占3.55%(表3)。106 例pANCA阳性患者中,pANCA联合MPO-ANCA阳性者66 例(62.26%)。除AAV以外,自身免疫性疾病中以pANCA阳性居多,其中SLE 11 例(11.32%),RA 7 例(6.60%),SS 4 例(3.77%),SSc 3 例(2.83%)。靶抗原特异性抗体MPO-ANCA阴性者均存在于AAV以外自身免疫性疾病中(表4)。

表3 cANCA阳性患者疾病分布[n(%)]
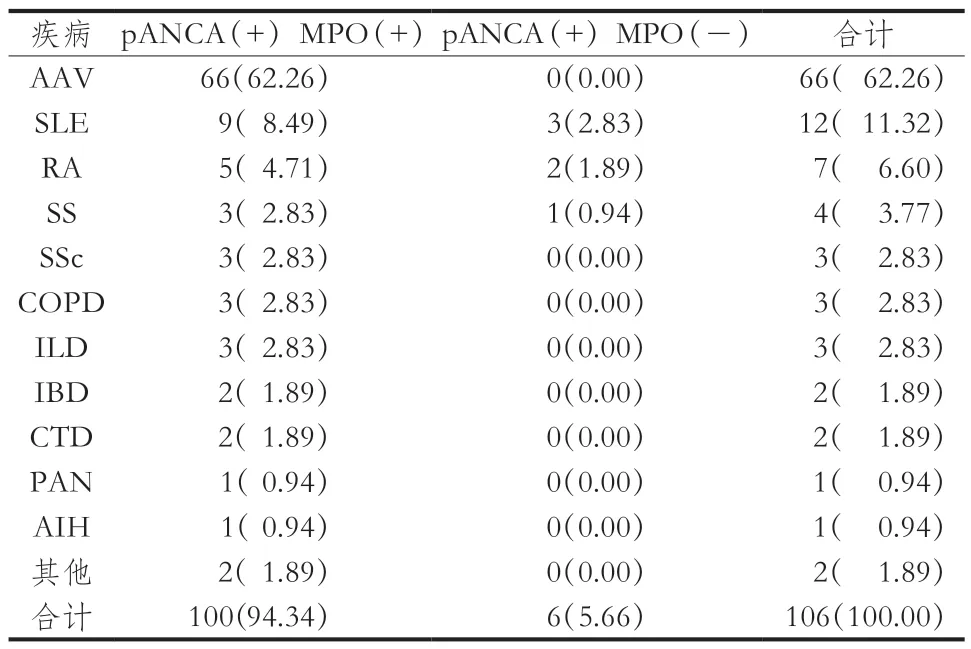
表4 pANCA阳性患者疾病分布[n(%)]
2.4 ANCA 阳性与ANA 相关性
pANCA阳性患者中ANA阳性率高于cANCA阳性患者,差异有统计学意义(P<0.05)(表5)。 pANCA阳性患者中ANA阳性者33例,滴度范围为1∶100~1∶10000,其中1∶10000 ( 9.09 %,n=3/33),1∶3200 (9.09 %,n=3/33),1∶1000(30.30 %,n=10/33),1∶320(33.33 %,n=11/33),1∶100(18.18%,n=6/33)。SLE患者均为ANA阳性,且多为高滴度,多数伴有双链DNA和ssa-A/Ro52自身抗体阳性,部分pANCA阳性SS患者ANA阳性,伴ssa-A/Ro60阳性(表6)。cANCA阳性患者中,ANA阳性者8例,滴度范围为1∶100~1∶320,其中1∶100(75.00%,n=6/8),1∶320(25.00%,n=2/8),无高滴度阳性结果(表7)。

表5 pANCA、cANCA阳性患者ANA阳性率比较[n(%)]

表6 pANCA阳性患者抗核抗体谱分布情况[n(%)]

表7 cANCA阳性患者抗核抗体谱分布情况[n(%)]
3 讨论
ANCA被发现以来,其临床检测意义一直在不断完善。现有研究已明确了ANCA对AAV的高敏感性和特异性,发现了许多ANCA的靶抗原,但只有PR3-ANCA和MPO-ANCA的临床意义得到一些证实。研究[15]表明,ANCA 不仅是AAV诊断和分类的有用疾病标志物,而且可能作为致病因素直接参与 AAV 的发病和进展。目前,ANCA作为AAV的重要血清学诊断指标而被临床应用[16]。随着医疗水平的发展与进步,ANCA在AAV以外自身免疫性疾病中的作用也逐渐被提出[17]。早期,在SLE患者中发现pANCA阳性[18];后续研究[19]报道,pANCA在SLE患者中的阳性率为14.0%~31.4%。最近研究[20]发现,与ANCA阴性患者相比,抗原特异性ANCA 阳性狼疮性肾炎患者肾活检时,肾小球炎症的节段性和坏死性更强,且血清学活性更高,基线肾功能较差。IIF法检测pANCA阳性在RA患者中报告的阳性率为16%~50%[21-22],其与RA患者疾病活动及严重程度的相关性尚存在争议[23]。此外,pANCA在SSc、自身免疫性肝病、炎症性肠病、ILD等疾病中均有被提及。
虽然本研究结果无法证实ANCA阳性在自身免疫性疾病中的致病机制,但发现了ANCA阳性的自身免疫性疾病具有以下特征:1)ANCA阳性多见于中老年患者,与之前研究[24]相符,并且也符合自身免疫性疾病的发展规律。本研究中,pANCA阳性患者女性多于男性,但cANCA阳性患者中男性随着年龄增长其阳性率不断增加,60 以上男性患者的cANCA阳性率甚至超过女性,提示男性自身免疫性疾病患病率的增加还需要大量病例研究加以证实。2)ANCA阳性患者被诊断为AAV占74.09%,其中cANCA联合其特异性靶抗原PR3-ANCA阳性者63.90 %,pANCA联合MPO-ANCA阳性者36.07%,AAV患者最常累及肺部和肾脏。本研究发现,15 例有中枢神经系统症状表现的AAV患者,其中12 例诊断为中枢神经系统性血管炎,提示当AAV患者有中枢神经系统受累的表现时,应怀疑中枢神经系统性血管炎,需行MR等相关检查,并及时诊断及治疗;此外,除AAV以外的自身免疫性疾病中,主要表现为pANCA阳性。3)pANCA在SLE(11.32%)、RA(6.60%)、SS(3.77%)、SSC(2.83%)等自身免疫性疾病中均有分布,SLE患者中阳性率最高。但与之前一些研究相比,RA的pANCA阳性率较低,可能是由于本研究中检测ANCA的RA患者比例较少,主要是活动期患者以排除RA合并AAV等相关疾病。4)pANCA阳性SLE患者均表现出高滴度的ANA荧光检测结果,伴有dsDNA、抗SmD1抗体阳性,91.71%有血尿、蛋白尿、下肢水肿等肾脏受累表现,提示ANCA与SLE活动度以及狼疮肾炎发生发展有相关性,SLE患者出现ANCA阳性,应警惕疾病活动性及狼疮肾炎的发生。5)本研究发现pANCA阳性患者中,ANA检测阳性率高于cANCA。既往研究[25]提出,IIF检测MPO-ANCA阴性的pANCA阳性者,不能完全排除粒细胞特异性抗核抗体(GS-ANA)或抗中性粒细胞核抗体(ANNA)的干扰。本研究中,有2例MPO-ANCA阴性pANCA阳性者显示ANA检测结果为阳性,可能存在GS-ANA或ANNA干扰。其余31例ANA阳性的pANCA阳性者,可能提示疾病的严重程度。pANCA通过与MPO结合产生相应的抗原抗体复合物,造成机体小血管及毛细血管病变,可累及多种脏器[26-27],当出现pANCA阳性时,可提示自身免疫性疾病存在器官损伤的可能。
综上所述,ANCA阳性在中老年患者中多见,ANCA是AAV诊断的重要指标,对有中枢神经系统表现的AAV患者,应及时确认是否为中枢神经系统性血管炎。SLE患者pANCA阳性时,提示疾病处于活动期或进展为狼疮肾炎。ANCA在多种自身免疫性疾病中可被检出,但其在自身免疫性疾病中的致病机制尚待进一步研究。

