苦味素激活苦味受体引起支气管扩张的相关机制研究进展
陈宋程 卓怀蜜 周向东,2,3 李琪,2,3
哮喘和慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是常见的呼吸系统慢性疾病,全球约3亿人受其影响,气流受限是慢阻肺、支气管哮喘等阻塞性疾病的共同特征,急性发作时,常表现为持续气道痉挛,可能导致呼吸衰竭、甚至窒息猝死,支气管平滑肌主动收缩所致气道阻塞是患者死亡的重要因素[1]。
G蛋白偶联受体(G-protein-coupled receptors,GPCRs)是人类基因组中最大的受体超家族,是真核生物中最大和最多样化的膜受体组,能被光能、脂质、糖、肽和蛋白质形式的多种配体激活,将来自外部环境的信息传递到细胞中,以调节其相应的功能[2]。苦味受体是众多G蛋白偶联受体中的一员,其大约有25个功能性的编码苦味受体蛋白的基因,这些编码基因除了存在于口腔和咽喉,还存在于内分泌、循环、消化、呼吸等众多系统[3]。苦味素是中草药成分中除了生物碱和苷类以外具有苦味性质的一类化合物的通称,是苦味受体的有效激动剂。研究证实了TAS2R受体在人类气道平滑肌(airway smooth muscle,ASM)上的表达,并将苦味受体的表达与Ca2+信号传导相联系,发现苦味素可逆转Ca2+变化引起的支气管收缩从而扩张支气管[4]。苦味素激动TAS2R受体可逆性的扩张慢性气道炎症引起的气道收缩,这预示着TAS2R受体有着不可低估的支气管扩张潜力,苦味素或许能成为一类用于治疗哮喘和慢阻肺的具有强效扩张支气管的新型药物[5]。
一、TAS2R受体结构及其扩张支气管的研究背景
TAS2Rs受体属于G蛋白偶联受体超家族中的一员:由一条多肽链形成的7个跨膜螺旋结构组成,包含相应的3个细胞外环和3个内环。外环较短,具有明显的多态性[6],可结合多种苦味物质(即配体);内环高度保守,是细胞内G蛋白偶联区域。与TAS2R受体偶联的是一种特异性的苦味信号偶联蛋白:味导素(gustducin),味导素由α、β、γ三条不同的多肽链组成,具有GTP酶活性和GTP结合位点[7](见图1)。人们发现大多数TAS2R受体包含一个单一的结合位点,该结合位点以非选择性方式广泛调整多种苦味配体,因此不同的苦味食物结合TAS2Rs后可以引起相似的苦味觉。
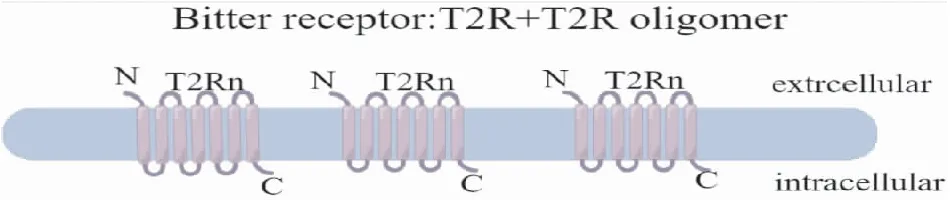
图1 苦味受体示意图
起初,Einstein等人通过使用表达微阵列对来自五个不同个体的ASM细胞进行RNA分离和分析,发现在这五个不同个体的ASM细胞内都存在显著的GPCR基因表达[8]。随后,Deepak A. Deshpande及其团队对人类气道平滑肌细胞进行了广泛的GPCR筛选工作,通过定量RT-PCR检测,发现有多种TAS2R受体亚型在气道平滑肌上存在表达,其中,TAS2R10、TAS2R14和TAS2R31是ASM细胞中表达量最高的亚型[9],与编码β2肾上腺素能受体的ADRB2基因相比,表达量要高3~4倍。此外,研究者们也从豚鼠和小鼠ASM细胞中检测到了TAS2Rs受体,这为研究TAS2Rs受体在ASM细胞中的作用提供了较好的体内和离体模型。研究发现,在ASM细胞中,利用苦味素激活TAS2R受体,可观察到ASM细胞内Ca2+有明显增加,且Ca2+瞬变的幅度与味导素α偶联的支气管收缩剂、组胺和缓激肽引起的幅度相当。证实了ASM细胞上苦味受体的表达[4],并将表达与苦味剂介导的细胞内Ca2+信号传导联系起来。
二、苦味素激活苦味受体舒张支气管的研究进展
环境污染物中可能含有苦味化合物,其可能与气道中的TAS2R结合,通过引发跨物种的先天厌恶反应来防止摄入有毒物质[10],起初人们认为,ASM细胞内Ca2+在TAS2R被苦味化合物激活后内流增加会导致ASM收缩,从而对吸入的有毒物质产生生理排斥,但Di Pizio等人却发现了不一样的结果。他们运用卵清蛋白致敏,建立慢性气道炎症和气道高反应性的小鼠模型,通过吸入氯喹、糖精和地那铵等几种已知的苦味受体激动剂后,发现小鼠ASM细胞内Ca2+增加,在运用免疫荧光共聚焦成像、膜电位测定、Q-PCR、小鼠肺功能检测、WestBlot等方法检测后,结果显示吸入苦味受体激动剂后小鼠出现了显著的气道扩张,其气道扩张效果比传统的β-激动剂在同种模型气道中的扩张作用高约3倍[11]。苦味受体激动剂激活 ASM 细胞上的TAS2R会导致强烈的支气管扩张这一现象,引起了学术界和制药业研究人员的注意以及对其内在机制的探索。
1 ASM上TAS2R受体的信号传导蛋白
先前的研究已经明确苦味素可通过激活ASM细胞上的苦味受体引起气道扩张,但其信号转导级联中是依靠何种G蛋白来介导激动剂与苦味受体结合仍需探讨。典型的TAS2R信号转导级联分子在苦甜和鲜味受体之间共享,包括异源三聚体G蛋白亚基(Gα,Gβ3,和Gγ13)、磷脂酶C(Phospholipaseβ2,PLCβ2)、肌醇1,4,5-三磷酸受体(Inositol 1,4,5-trisphosphate receptor 3,IP3R3)和TRPM5离子通道[12]。许多苦味激活物被认为与味觉细胞上特定的G蛋白偶联膜受体结合,如苦味受体的同源G蛋白α-味觉诱导素。α-味觉诱导素是一种独特的G蛋白,在约30%的II型味觉受体细胞(Taste receptor cell,TRC)中选择性表达[13],与视网膜蛋白α-味觉诱导素有80%的同一性,研究认为其在甜味和苦味受体信号转导中扮演重要角色。通过结合Ca2+成像和免疫组织化学,发现小鼠味蕾中大约一半的苦味敏感味觉细胞表达α-味觉诱导素,而G蛋白α-味觉诱导素敲除的小鼠的苦味敏感味觉细胞减少40到100倍,其苦味反应细胞对苦味激动剂的敏感性也降低8到10倍[14]。在人类ASM细胞中,通过G蛋白α-味觉诱导素的耦合来实现气道平滑肌苦味受体在细胞内的信号传导和松弛[15]。
2 ASM上TAS2R的信号传导机制
ASM上TAS2R被激活后的信号传导机制尚未完全明确,Deshpande等人提出苦味物质激活典型途径:TAS2Rs激活G蛋白-味觉诱导素的β、γ亚基,形成Gβγ-复合物,Gβγ-复合物激活磷脂酶C异构体β2,然后诱导肌醇 1,4,5-三磷酸和二酰基甘油(DAG)的产生。IP3通过反向结合细胞内离子通道IP3受体[16],从而释放内质网(endoplasmic reticulum,ER)中的Ca2+[17]。另有研究者认为,苦味素逆转了支气管收缩剂引起的细胞内Ca2+的增加,这种逆转效应是通过抑制l型电压依赖性钙通道(voltage dependent calcium channels,VDCCs)介导的。TAS2R被苦味素刺激后,激活G蛋白α-味觉诱导素及效应磷酸二酯酶(phosphodiesterases,PDEs),引起钙调蛋白(calmodulin,Cam)水平下降和蛋白激酶A(protein kinases A,PKA)活性降低[18],使三磷酸肌醇受体3对Ca2+通道的抑制作用削减,致内质网中Ca2+释放。以上两种机制均可引起内质网上Ca2+的释放,增加的细胞内Ca2+激活基底外侧质膜中的瞬时受体电位阳离子通道亚家族M成员4和5(Transient receptor potential M4/5,TRPM4/5),导致膜去极化,触发Na+动作电位放电,以及诱导ATP释放。反过来,ATP作为主要的神经递质刺激传入颅神经上的嘌呤能受体2和3(P2X2和P2X3 Purinergic P2 Receptor)[18-19],激活触发动作电位,随后激活大脑中的味觉皮层。
通过探索苦味素刺激TAS2R引起气道扩张的机制,有研究者在上述两种经典途径的基础上发现,由苦味剂引起的人ASM细胞内Ca2+的增加不依赖于细胞外 Ca2+的存在,并观察到苦味素预处理几乎消除了MCh诱导的ASM细胞内钙浓度的升高,从而抑制了钙诱导的收缩效应[20],但该反应可被Gβγ抑制剂、PLCβ抑制剂消除,并被3-磷酸肌醇受体拮抗剂部分抑制(见图2)。
三、苦味受体激动剂的筛选及扩张潜能
与其他GPCR相比,苦味受体与多种结构不同的物质相互作用的能力非常显著,包括多种药物/抗生素、多酚、细菌代谢物、盐和金属离子[21],因此,探索寻找具有显著选择性的高度异质苦味化合物是目前研究的重点方向和主要挑战。2019年有研究者首次使用电子细胞基质阻抗传感器(Electric Cell-substrate Impedance Sensing,ECIS)建立了检测ASM收缩/松弛效应的方法,筛选出的奎宁、诺比列素和苦味菌素IA均能有效抑制平滑肌收缩,且呈浓度依赖性[22]。尽管已鉴定出上千种苦味物质,但迄今为止研究的其他苦味物质中,多数的支气管舒张效果及安全性并不理想。典型的氯喹和其类似化合物被认为对TAS2R无特异选择性。denatonium(地托丹宁)会诱导气道上皮细胞(airway epithelial cell,AEC)的凋亡,这可能损害上皮完整性,甚至增加了冠状病毒及其他有害颗粒物入侵机体的风险[23],故需仔细评估其对气道上皮的潜在毒性。另有研究表明柚皮苷对16HBE细胞的增殖作用可能与细胞周期的增强、细胞周期素E mRNA的表达和钙信号的激发有关,使用特异性阻断剂抑制TAS2R表达和TAS2R信号通路均可减弱柚皮苷的促增殖作用[24]。柚皮苷对气道上皮有足够的安全性,但至少需在几百微摩尔浓度下发挥作用,这限制了其在临床上的应用。
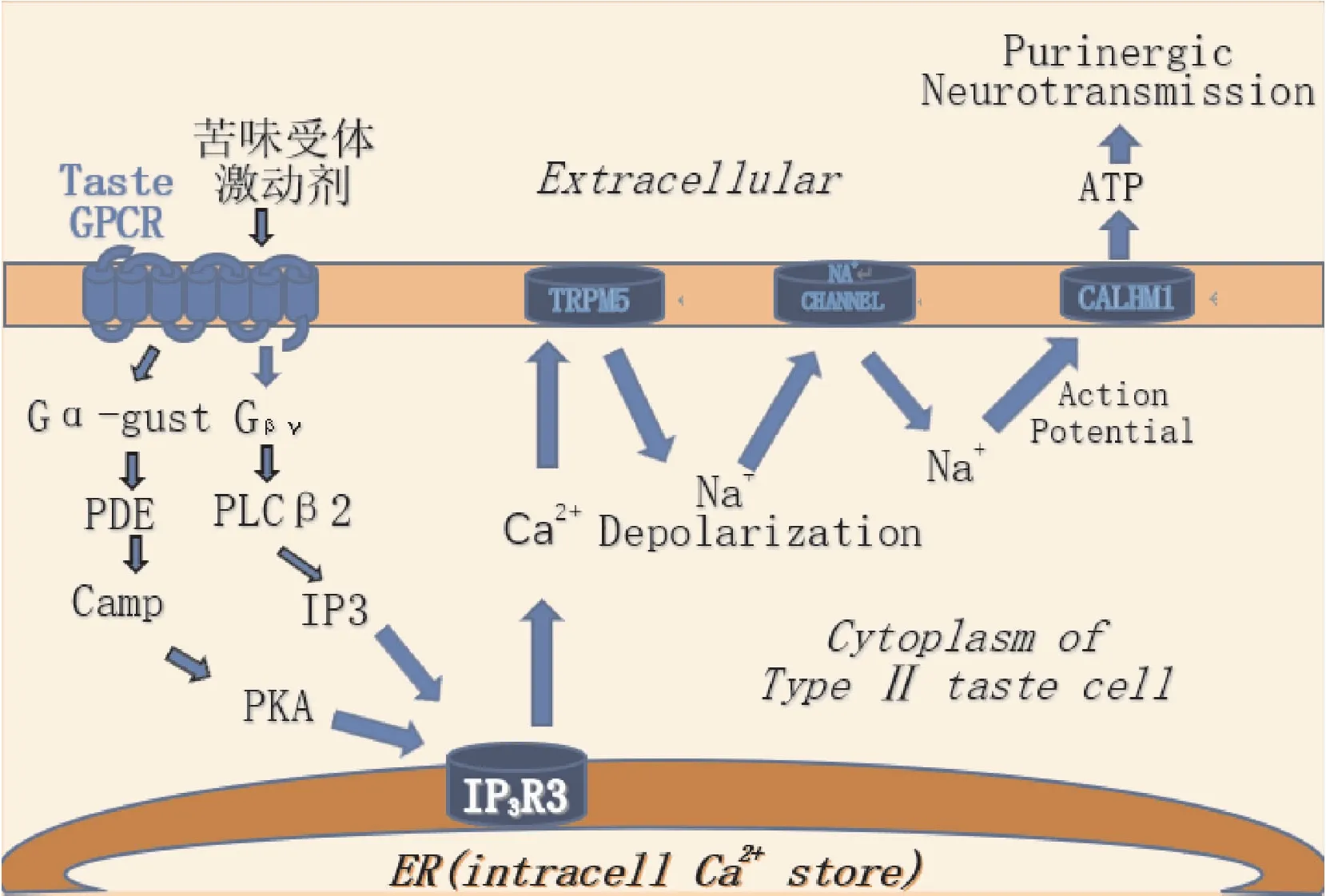
图2 苦味素激动苦味受体的信号传导通路
2020年有研究者发现体外低浓度的血根碱SA(低于1μM)能够以剂量依赖的方式舒张大鼠ASM,通过抑制Gβγ、PLCβ、3-磷酸肌醇受体可减弱ASM的舒张反应,表明SA可能依赖于TAS2R/Gβγ/PLCβ信号途径诱导ASM松弛[25]。但目前已知SA对心肌中的Na+,K-ATP酶具有抑制作用,在大鼠心房中引起正性肌力作用,表明SA可能对心肌细胞存在毒性作用[26],这可能也是引起ASMC损害的危险因素,故在将来的研究中需要仔细评估SA在临床应用中的安全性。
苦丁苷(KE-A)是从苦丁茶中提取的一类具有典型五环三萜和内酯结构的苦味化合物[27],是一种有效的TAS2R激动剂。有研究者建立了大鼠ASM原代细胞TAS2R10和TAS2R14细胞模型,用30μM氯喹和30μM KE-A培养,可观察大鼠ASM原代细胞内钙离子增加,KE-A组的钙离子增加程度与氯喹组相类似[7,28],再用Mch刺激,发现细胞内Ca2+的升高被明显抑制,结果表明,TAS2R激活诱导细胞内钙水平轻微升高,但不足以诱导味觉受体细胞磷酸化,而显著抑制了MCh介导的钙释放[29]。但目前研究仅限于KE-A对体外大鼠ASMC的影响,需要进一步在体外测定KE-A对人ASMC的影响以及在体内的作用,以确定KE-A在扩张支气管作用上的潜在价值。
四、结语
本文对代表性苦味中药组分介导支气管舒张的相关分子机制做了诠释,同时浅析目前具有代表性的中药组分在舒张支气管方面的潜能,有助于从传统中药中寻找有效的单体成分,为拓展其科学应用提供新的思路,也为慢性气道炎症性疾病的防治提供了新思路。
随着研究的深入,苦味受体激动剂舒张支气管的机制将会逐渐明晰,TAS2R激动剂作为治疗阻塞性气道疾病的新型高效支气管扩张剂显示出良好的前景,但也存在巨大的挑战。TAS2R亚型之间存在高度同源的序列,筛选出具有高度特异性的化合物是目前急需解决的难题,有日本学者运用实时定量PCR(qPCR)方法来确定每种TAS2R亚型的基因表达,但其量化的基因亚型有限,且会受到来自其他亚型的干扰[30];此外,寻求更加高效的苦味化合物、如何避免药物脱靶以及更合适的给药形式仍需要进一步探索。

