ARHGAP23与非小细胞肺癌免疫浸润和预后的相关性分析
王作培 曹磊 陆熠 丁一
肺癌的发病率和死亡率高,60%患者初次诊断时已有远处转移,5年生存率仅15%,总体预后差[1]。肿瘤组织中细胞突变的位点很少,与基因表达调控密不可分[2],故筛选出普适性高的标志物和治疗靶点是肺癌早期预防、诊断、治疗和预防复发的根本。ROCK(Rho-associated protein kinase,Rho相关蛋白激酶)是治疗心血管疾病、代谢紊乱和肿瘤的潜在治疗靶标[3-4],其Rho GTPase(Rho GTP酶)的活化受到Rho GAPs(Rho GTPase activating proteins,Rho GTPase活化蛋白)的调节[5]。本研究涉及的ARHGAP基因负责Rho GAPs的翻译[6]。现对我院2017年1月到2020年1月非小细胞肺癌手术患者的肿瘤标本进行免疫组化分析,使用TCGA(The Cancer Genome Atlas,癌症基因组图谱)数据库等检测ARHGAP23表达,分析患者生存曲线,并探讨ARHGAP23与免疫细胞浸润的关系。
资料与方法
一、研究对象
选取上海市浦东新区人民医院2017年1月到2020年1月接受手术治疗且术后石蜡病理诊断为非小细胞肺癌的86例患者病理组织标本。其中男性41例(47.7%),女性45例(52.3%);年龄≤60岁49例(57.0%),>60岁37例(43.0%);收集的标本与数据经上海市浦东新区人民医院伦理委员会批准(医学伦理审查申请表编号2019-09)。纳入标准:a) 年龄大于18岁,非妊娠期及哺乳期女性;b) 经病理诊断确诊为非小细胞肺癌;c) 未经任何放射或化学治疗。排除标准:临床信息(总生存时间及生存状态)不完整的患者。
二、研究方法
1 临床资料随访
病例纳入时间起点为2017年1月1日,纳入终点是2020年1月1日,总生存期(overall survival,OS)定义为从手术日期到死亡或最后一次随访的时间。病例经门诊途径复诊或经电话/微信随访。随访间隔为:术后前2年期间,每3个月复查一次;术后第3年,每半年复查一次;术后3年以后,每年复查1次。2022年1月1日对病例进行最终研究结局的随访。本研究随访主要目的是ARHGAP23表达量高低对非小细胞肺癌预后的影响,其次为临床病例资料与患者的OS之间的关系。
2 免疫组化分析
借助免疫组化链霉菌抗生物素蛋白-过氧化物酶连结(streptavidin-perosidase,SP)两步法实施染色操作,组织切片放置在60℃的环境中进行烤片,时间为2小时,把组织切片浸润到提前加热处理过的修复液中,时间为15分钟。使用磷酸缓冲盐溶液(phosphate buffered saline,PBS)进行冲洗,然后添加内源性过氧化物酶阻断剂进行孵育,时间为10分钟。使用PBS进行冲洗处理,用浓度为1%牛血清白蛋白(bovine serum albumin, BSA)进行封存处理,添加兔抗人ARHGAP23多克隆抗体,该抗体是由Abcam公司提供的,放在37℃的环境中进行孵育,时间为60分钟。添加辣根过氧化酶标记的山羊抗兔IgG,放在室温下进行孵育,时间为20分钟,使用PBS进行冲洗,前后冲洗三次,二氨基联苯胺法(dab color rendering,DAB)显色。用PBS溶液对切片进行冲洗,使用苏木精对细胞核进行复染,分化、冲洗返蓝。用酒精进行脱水处理,用中性树胶进行封存,放在显微镜下观察,并用照片形式保存下来。
3 免疫组化结果判断
(1)参考阳性细胞百分比开展计分工作:≤5%记作0分,6%~25%记作1分,26%~50%记作2分,51%~100%记作3分。(2)参考阳性细胞的染色强度开展计分工作:未着色记作0分,淡黄色记作1分,棕黄色记作2分,棕褐色记作3分。把上述数据相乘:≥3分记作高表达,<3分记作低表达。
4 基因表达分析
检索TIMER数据库得到不同癌症或特异性癌症亚型的肿瘤组织与邻近正常组织之间ARHGAP23的表达差异。在数据库中没有正常对照组织或没有肿瘤组织的情况下,借助GEPIA2网站和GTEx数据库得到相关肿瘤组织和正常组织表达能力不同之处的箱线图。参数设置为:P-value cutoff=0.05,log2FC cutoff=1。 综合考虑UALCAN数据库以及临床数据,对每百万转录本的值进行科学的预测和计算,借助 Log2(TPM+1) 表现出来,绘制了在 TCGA 数据库中不同肿瘤患者中ARHGAP23表达水平的箱线图。
5 生存预后分析
用Kaplan- Meier Ploter数据库分析上述TCGA 数据库的所有肿瘤中ARHGAP23的OS和无病生存期(disease free survival,DFS)数据。选择合适的表达阈值以区分高表达人群和低表达人群 (Cutoff-High=50;Cutoff-Low=50) ,假设检验采用log-rank检验,并通过GEPIA2的“生存分析”模块获得单基因生存分析图 (Kaplan- Meier曲线)。
6 基因变异分析
使用cBioportal(http://cbioportal.org)工具收集所有TCGA肿瘤ARHGAP23基因结构的突变频率、突变类型、突变位点信息和拷贝数变化。
7 ARHGAP23相关基因富集分析
借助String数据库了解、筛选蛋白质名称和种类,这里选择的是ARHGAP23和人,然后最低关系分数设置为高可信度0.700,交互对象的最高值不得高于50,这些信息是在试验探究中获得的。最后筛选得到了10个实验确定的与ARHGAP23相互作用蛋白。
8 免疫浸润分析
选取TCGA (https://portal.gdc.cancer.gov/) LUADLUSC(肺癌)项目中 level 3 HTSeq-FPKM格式的RNAseq数据,通过数据转化和过滤,分析了ARHGAP23的表达与免疫浸润的关系,免疫浸润算法:ssGSEA (GSVA包内置算法),数据以气泡图、分组比较图和散点图的形式展现。
9 临床相关性分析
下载(TCGA) LUADLUSC(肺癌)项目中 level 3 HTSeq-FPKM格式的RNAseq数据和临床数据,通过转化和过滤,分析了ARHGAP23的表达与临床的相关性,R包主要为 ggplot2,数据以箱式图和基线资料表形式展现。
三、统计学方法
借助SPSS 23.0、GraphPrism 6.0软件实施统计分析,借助χ2检验比较分类变量之间的差异,连续变量采用t检验和趋势检验,生存分析采用Kaplan-Meier法,采用Cox比例风险模型对预后因素进行多因素分析,以P<0.05为差异有统计学意义。
结 果
一、ARHGAP23在肺癌组织中的表达与生存率的关系
使用免疫酶标SP法进行免疫组化测定,结果显示46例患者(53.5%)的肿瘤组织表现出高水平ARHGAP23表达,40例患者(46.5%)肿瘤组织表现出低水平ARHGAP23表达(图1A)。利用临床数据分析ARHGAP23的表达与非小细胞肺癌受试者存活率的相关性并做出Kaplan-Meier曲线。从K-M曲线可以看到,与低表达组相比,ARHGAP23高表达组的非小细胞肺癌患者存活率显著升高(P<0.001)(图1B)。

图1 ARHGAP23肺癌组织中的表达和生存预后
二、ARHGAP23在肺癌组织中的表达与患者的临床数据的相关性
以年龄大小、性别、肿瘤大小、是否吸烟、肿瘤分化情况为依据,把86例非小细胞肺癌病人的临床特征进行分组,比较高表达组与低表达组间的差异,发现在肿瘤大小、淋巴结转移和肿瘤分期上,组间差异有明显统计学意义,而在年龄、性别、吸烟史、肿瘤分化程度上,两组间无明显统计学差异(见表1)。
三、影响患者预后的Cox多因素分析
单因素分析结果显示,肿瘤大小、淋巴结转移和肿瘤分期是非小细胞肺癌患者预后的影响因素(P<0.05)。以是否存活为因变量,上述因素为自变量,进行Cox多因素分析,结果显示肿瘤大小、淋巴结转移和肿瘤分期是影响患者预后的独立因素(P<0.05)(见表2)。
四、基因表达分析结果
首先分析ARHGAP23在各种恶性肿瘤和正常组织中的表达情况,检索TIMER数据库发现,ARHGAP23在乳腺癌(BRCA),脑癌(GBMLGG),嫌色细胞癌(KICH),肺腺癌(LUAD),子宫内膜癌(UCEC)组织中的表达水平明显低于正常水平(P<0.05),在胆囊癌(CHOL),食管癌(ESCA),肝癌(LIHC),甲状腺癌(THCA)组织中的表达显著高于正常组织(P<0.05)(图2A) 。将TCGA数据库中缺少正常组织对照的肿瘤联合GTEx数据库进一步评估分析发现,ARHGAP23在皮肤癌(SKCM)、睾丸癌(TGCT)中的表达水平明显低于正常组织(P<0.05),而在淋巴癌(DLBC)和胸腺瘤(THYM)的表达水平显著高于正常组织(P<0.05)(图2B)。CPTAC数据集的结果显示,ARHGAP23总蛋白在乳腺癌(BRCA)、卵巢癌(OV)、透明细胞癌(RCC)、子宫内膜癌(UCEC)和肺腺癌(LUAD)的原发组织中的表达高于正常组织(图2C)。通过HEPIA2的“病理分期图”模块观察ARHGAP23表达与肿瘤病理分期的相关性,包括COAD,食管癌(ESCA),肾透明细胞癌(KIRC) 和子宫内膜癌(UCEC)(P<0.05,图2D),其他肿瘤的ARHGAP23表达与病理分期无明显相关性。
五、生存预后分析结果
为了评估 ARHGAP23与肿瘤预后的关系,参考ARHGAP23的表达情况,把肿瘤病例分成两部分:一部分是高表达组;一部分是低表达组,借助TCGA和GEO计算分析不同肿瘤病人预后的相关性,相关结果(见图3A),高表达的ARHGAP23与LGG(P=0.001)、OV(P=0.019)、PAAD(P=0.015)和SKCM(P=0.022)患者的总OS(生存率)的不良预后相关。DFS(无病生存期)分析数据(图3B)显示,在LGG(P<0.001)和PAAD(P<0.001)之间存在相关性。

表1 非小细胞肺癌患者临床特征与ARHGAP23的表达[n(%)]

图2 ARHGAP23基因在不同肿瘤和病理阶段的表达水平
六、基因改变分析结果
癌症的发展是由于基因突变的积累,在TCGA数据库的不同肿瘤样本中分析ARHGAP23的基因变异情况。(如图4A)所示,大部分肿瘤没有基因突变,只有在UCEC和ESCA中,ARHGAP23的改变频率比较高,其改变的类型、位点和病例数进一步(见图4B),我们发现在该结构域Tudor的R918H/X918存在突变。

表2 影响患者预后的Cox多因素分析

图3 ARHGAP23基因表达与肿瘤生存预后的相关性 在TCGA中,借助GEPIA2工具和ARHGAP23基因表达对TCGA中多种肿瘤实施A:总生存率;B:无病生存期研究探讨,进而得到阳性结果的生存图和Kaplan-Meier曲线
七、富集分析结果
为了研究ARHGAP23在肿瘤发生发展中的分子机制,筛选出已知的与 ARHGAP23相互作用蛋白和ARHGAP23表达相关基因。使用 String数据库,总共获得了10个与ARHGAP23相互作用的蛋白质,(图5A)展现10种蛋白质的影响关系网络。
八、免疫浸润结果
选取TCGA (https://portal.gdc.cancer.gov/) LUADLUSC(肺癌)项目中 level 3 HTSeq-FPKM格式的RNAseq数据,通过数据转化和过滤,分析ARHGAP23的表达与免疫浸润的关系,结果显示:在肺癌中ARHGAP23与Tcm,NK CD56 dim 细胞和NK 细胞存在正相关关系,ARHGAP23与Th17 细胞和CD8+T细胞等免疫细胞存在负相关关系(图5B),ARHGAP23的高表达跟T细胞浸润呈负相关(图5C,D)。
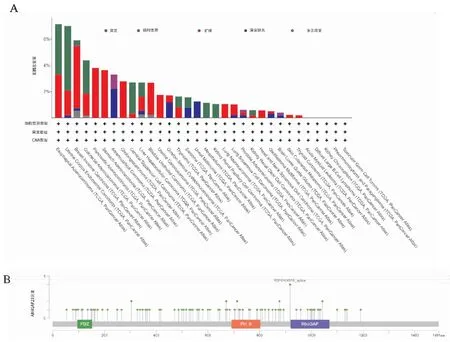
图4 ARHGAP23在TCGA不同肿瘤中的变异分析我们使用cBioPortal tool分析了ARHGAP23的变异特征。A图显示突变类型;B图显示突变位点
九、临床相关分析结果
对TCGA (https://portal.gdc.cancer.gov/) LUADLUSC(肺癌)项目中 level 3 HTSeq-FPKM格式的RNAseq数据和临床数据进行转化和过滤,分析了ARHGAP23的表达与临床的相关性,结果显示:肺癌中T3高于T1的平均水平,两组的差值为0.363(0.028~0.697),差异具有统计学意义(P=0.028)(图6A),高表达ARHGAP23的III期肺癌患者预后更好(图6B)。
讨 论
人类ARHGAP23基因位于17号染色体[7],负责编码RhoGAPs家族蛋白。在肺癌的发生发展中,Rho GAPs通过磷酸化激活Rho GTPase,影响多种下游靶蛋白,促进蛋白质合成、细胞增生、细胞质分裂、肌动蛋白网络形成以及肌动球蛋白的收缩等进而实现多种细胞功能[8-10]。研究发现,ARHGAP在多种肿瘤中显著下调。肠癌中发现ARHGAP30是p53乙酰化和功能性激活的一个至关重要的调控因子,在DNA损伤应激情况下,ARHGAP30表达是p53激活的必要条件[11];ARHGAP7(DLC-1)的泛素化降解机制导致了Rho A信号通路的激活促进了肺癌的增殖[12];GWAS分析发现ARHGAP23的SNP位点可能与卵巢癌的发生相关[13]。
本研究分析了86例非小细胞肺癌患者肿瘤组织的ARHGAP23表达,并利用临床数据分析ARHGAP23的表达与患者存活率的Kaplan-Meier曲线。结果表明ARHGAP23高表达组的非小细胞肺癌患者存活率显著升高。通过生物信息学数据库对ARHGAP23进行泛癌分析,结果表明ARHGAP23在不同肿瘤中表达量有较大差异,与临床预后、免疫浸润之间存在统计学相关性。
免疫细胞主要包括NK细胞、T细胞、B细胞、树突状细胞、巨噬细胞等[14-15],在肿瘤组织中浸润后形成肿瘤微环境。在肿瘤微环境中,不同的细胞类型对肿瘤的作用不同。通常情况下,CD4+辅助T细胞、NK细胞、M1型巨噬细胞能够杀死肿瘤细胞,但是 M2型巨噬细胞、CD4+FoxP3+Th2辅助T细胞、髓源性抑制细胞能够对肿瘤细胞免疫逃逸起到积极影响[16],所以肿瘤微环境的免疫逃逸机理及免疫治疗手段在临床医学上有着不可忽视的价值[17]。经过浸润处理的免疫细胞对免疫治疗反应和肿瘤预后有着极为关键的影响,而且有可能成为免疫治疗药物重要靶点[18]。

图5 ARHGAP23相关基因富集分析

图6 ARHGAP23在TCGA数据库中肺癌数据集的临床相关性分析
肿瘤细胞的免疫应答主要有两种:一种是天然性,另一种是获得性。在获得性免疫应答中,CD8+T细胞发挥着极其关键的作用,能够过继抗原特异性细胞毒性T淋巴细胞(CTL),起到杀灭肿瘤细胞的作用[19];但是NK细胞是人体天然免疫体系中不可或缺的一部分,不用提前致敏就可以消除肿瘤细胞,而且没有无肿瘤特异性和MHC限制性,是人体防范肿瘤疾病的第一个屏障[20]。机体在与肿瘤对抗的过程中,自身免疫系统通过免疫浸润,在患者体内起到了至关重要的作用。研究表明,肿瘤浸润的各种免疫细胞与患者预后相关,并在肿瘤免疫逃逸、抗肿瘤等方面发挥不同的作用[21]。淋巴细胞(CD8+、CD4+、调节性T细胞等)在抗肿瘤免疫监视中具有重要的作用。Ruffini等[22]研究表明,有25%肺癌组织中可观察到淋巴细胞浸润,并在微血管浸润和低分化的肿瘤中比例较高。Mori等[23]研究发现,肿瘤的组织类型和分化程度与CD8+T细胞的浸润程度和数量有关。这表明免疫细胞的反应与肿瘤分化程度呈正相关。在非小细胞肺癌中,低分化肿瘤可能表达更多的肿瘤相关抗原,导致强烈的免疫反应如淋巴细胞浸润等。而NK细胞在抗肿瘤过程中所起的作用有不同的结论。Takanami等[24]认为,NK细胞主要分布在肿瘤基质中,特别是存在于肿瘤-基质交界,其浸润可能和肿瘤演进的调节有关。
因为CD8+T细胞和NK细胞在肿瘤免疫中的职能不一样,本文把这作为入手点,分析探讨ARHGAP23在非小细胞肺癌中的表达与免疫细胞浸润之间的内在机理。通过分析TCGA数据库中的RNAseq数据发现,ARHGAP23在肺癌细胞中的表达与Tcm细胞,NK CD56 dim细胞和NK细胞存在正相关关系,而与Th17 细胞和CD8+T细胞等存在负相关关系。该结论符合前述研究结果,并提示ARHGAP23可能通过正向调节NK细胞分泌大量细胞因子,从而起到抗肿瘤作用。
本研究通过生物信息学分析发现NK细胞浸润与ARHGAP23的表达呈正相关,但对肺癌患者按照年龄、性比、肿瘤大小、吸烟史、肿瘤分化程度、淋巴结转移和肿瘤分期等进行分组,比较高表达组与低表达组间的差异,发现在肿瘤大小、淋巴结转移和肿瘤分期上两组间差异有明显统计学意义,而肿瘤分化程度在两组间却没有看到明显的统计学差异。为了明确ARHGAP23与免疫浸润的关系,后续还需要更多的细胞功能学实验和动物实验,加大样本量及数据分层,以更深入探究ARHGAP23与非小细胞肺癌免疫浸润之间的关系。

