网络药理学及分子对接视角下探讨国医大师张震疏调解郁汤核心药对治疗抑郁症的作用机制
卿越雷 王秋 余娇 代琼花 秦竹


摘要:目的 探讨疏调解郁汤核心药对治疗MMD可能的机制。方法 利用TCMSP平台对药物的活性成分及作用靶点进行筛选,利用GeneCard、OMIM、PharmGkb、TTD、DurgBank数据库对MMD疾病靶点进行筛选。将药物成分与疾病靶点取交集,采用string数据库、及Cytoscape3.8.2软件绘制蛋白质交互网络,筛选核心靶点。利用R(V4.1.2)软件引用Bioconducter数据库对交集基因进行GO分析和KEGG分析,并对筛选出的核心靶点和排名靠前的药物关键成分进行分子对接验证。结果 共筛选获得药物有效化合物成分 88个,作用靶点233个。MMD相关基因靶点1744个。将药物作用靶点与疾病基因靶点取交集后,得到105个靶点。构建PPI网络,经拓扑分析后得到MAPK1、FOS、JUN、AKT1、ESR1、STAT3共6个核心靶点。GO分析显示疏调解郁汤核心药对作用于MMD涉及了多个生物过程及分子功能,其中生物过程主要涉及对异物刺激的反应、对金属离子的反应、对脂多糖的反应等。细胞成分主要涉及膜筏、膜微域、突触膜、转录调节因子等。分子功能主要涉及DNA的结合转录、RNA结合转录等。KEGG分析显示MMD的发病与多个通路,多种疾病均有关系。除与MMD相关通路外还与糖尿病并发症相关的AGE-RAGE信号通路、脂质和动脉粥样硬化通路、卡波西肉瘤相关疱疹病毒感染通路、化学致癌受体激活通路、人巨细胞病毒感染、内分泌抵抗相关通路等有关。分子验证显示其中MAPK1、FOS、JUN、AKT1、ESR1、STAT3共6个关键靶点与药物关键成分槲皮素、木樨草素进行分子对接验证,结合能均≤-5.0 kJ/mol,表明关节化合物与核心靶点结合较好。结论 疏调解郁汤核心药对MMD的治疗作用可能与MAPK1、FOS、JUN、AKT1、ESR1、STAT3共6个关键靶点及PI3K-AKT信号通路、MAPK 信号通路、Ras信号通路、Rap1信号通路、血管平滑肌收缩、胆碱能突触、MTOR信号通路、MAPK信号通路、多巴胺神经能突触、甲状腺激素信号通路、AMPK信号通路有关。
关键词:抑郁症;疏调解郁汤;网络药理学;分子对接;信号通路
中图分类号:R749.4+1 文献标志码:A 文章编号:1007-2349(2023)03-0054-10
抑郁症(major depressive disorder,MDD)是以显著而持久的心境低落、思维迟钝、认知功能障碍、兴趣活动减退为主要表现的心境障碍类疾病[1]。据WHO统计数据显示,全球约3.5亿人患有抑郁症,每年自杀行为的发生率约为28.5%~63.7%。我国抑郁症患者占总人口的4%~8%,目前其患病人数已超过2600万,已成为危害人类健康的第四大疾患[2]。根据相关文献显示抑郁症在近些年的发病中表现出了患病及复发率高、同时致残率高的特点[3],预计到2030年我国抑郁症的疾病造成的社会经济负担将位于首位[4]。抑郁症是一个由多种机制及多种因素共同参与而导致的疾病,被认为与遗传、神经生物学、社会文化心理因素及单胺递质等作用机制均相关[5-9]。抑郁症属中医“郁证、脏躁症、百合病”范畴,相关研究显示中医学对郁证具有较为系统的理论认识和丰富的诊治经验,在抑郁症防治中发挥积极作用,尤其是对轻中度抑郁及抑郁症巩固治疗、维持治疗阶段可发挥重要作用[10]。疏调解郁汤由云南首位国医大师张震研究员创立,张老强调在疾病的治疗过程中,须注意气机的疏达和调畅,方可取得较好的临床疗效,同时疏调人体气机需将疏利肝气与调护脾肾相结合。疏调解郁汤由疏调气机汤加刺蒺藜、佛手、石菖蒲、玫瑰花、素馨花、厚朴花化裁而来。张老认为疏调解郁汤中之核心成份柴胡、白芍、枳实具有四逆散之意可助气机之条畅与敷布,有缓解抑郁之作用;刺蒺藜可疏肝气之郁积,平抑肝阳之上亢,解心经之郁火;石菖蒲能开宣心窍肾窍,宁神益智;佛手疏调肝气,甘松解郁畅中;玫瑰花气味甘香,芳香袭人,能柔肝散郁,行气活血[11]。本研究利用网络药理学探讨疏调解郁汤中核心药对(柴胡、白芍、枳实、刺蒺藜、石菖蒲、甘松、佛手、玫瑰花)治疗MMD的生物学机制,并利用分子对接技术对其进行验证。拟为阐明疏调解郁汤核心药对治疗MMD的作用机制和后续的实验研究提供基础数据支撑。
1 材料与方法
1.1 药物成分筛选与靶点预测 疏调解郁汤核心药对,主要由柴胡、白芍、枳实、刺蒺藜、石菖蒲、甘松、佛手、玫瑰花8味药物组成。利用TCMSP数据库(http://tcmspw.com/tcmsp.php)[12],以药物名称“柴胡”、“白芍”、“枳实”、“刺蒺藜”、“石菖蒲”、“甘松”、“佛手”、“玫瑰花”作为关键词,对药物主要化学成分进行检索。设置口服生物利用度(OB)≥30%,类药性(DL)≥0.18作为筛选条件,将筛选出的有效成分利用TCMSP的有数据库进行靶点蛋白预测。并将预测的有效靶点蛋白利用Uniport(https://www.uniprot.org/)数据库查询对应基因名,将靶点蛋白与基因信息对应。
1.2 MMD疾病靶点筛选 以“major depressive disorder”作为关键词,在GeneCard数据库(https://www.genecards.org/)[13]、OMIM数据库(https://omim.org/)[14]、PharmGkb数据库(https://www.pharmgkb.org/)[15]、TTD數据库(http://db.idrblab.net/ttd/)[16]、DurgBank数据库(https://www.drugbank.ca/)[17]检索,物种条件设置为智人(homo sapiens)其中将GeneCard数据库中的Relevance score设定为≥10分,以筛选出与疾病相关度更高的基因。将筛选出的基因取并集,并去除重复基因,获得与MMD疾病相关基因。
1.3 疏调解郁汤核心药对治疗MMD靶点预测 利用venny(V2.1)软件对筛选出的药物作用基因与疾病相关基因取交集,并绘制韦恩图,将交集中的基因作为疏调解郁汤核心药对作用于MMD的预测基因靶点。
1.4 构建药材-化合物-靶点作用网络、蛋白相互作用(PPI)网络及筛选关键靶点 (1)将药物名称、药物成分、与疾病基因靶点名称对应,利用Excel输出为network(网络)文件。并将药物名称、药物成分、疾病基因靶点利用Excel输出为type(类型)文件。将两个文件导入Cytoscape 3.8.2软件中作图。(2)将筛选出的药物及疾病共有的基因,写入Excel文件中,并导入String数据库(https://string-db.org)构建PPI网络。将作图条件设定如下:物种为智人(“homo sapiens”),可信度≥0.9。如有游离节点,可设置为隐藏。(3)将图导出为tsv文件,并用Cytoscape 3.8.2软件打开进,利用软件中的Network Analyzer工具进行拓扑分析,以Closeness、degree、LAC、Eigenvector 4个参数作为参考标准,按degree值排序,重复2次,筛选关键基因靶点。
1.5 GO富集分析与KEGG富集分析及可视化处理 将1.3中筛选出的疾病和药物作用的共有基因,做生物学过程GO分析和KEGG通路分析。利用R(V4.1.2)软件,引用colorspace、stringi、ggplot2、BiocManager数据包、并导入DOSE、clusterProfiler、enrichplot插件。对共有基因的生物過程、分子功能、细胞组分进行富集分析,筛选矫正P值<0.05的项目。对共有基因进行KEGG通路富集分析,设定P值<0.05,并对相关通路进行排序。最后利用R软件对GO分析及KEGG分析的结果作图对其进行可视化处理。
1.6 成分和靶点分子对接验证 利用RSCB PDB数据库(https://www.rcsb.org/),下载关键基因靶点的3D结构的PDB文件,并使用PyMol(V2.4.0)软件删除文件中的水分子和小分子配体。利用PubChem 数据库(https://pubchem.ncbi.nlm.nih.gov/)下载有效成分2D 结构的SDF 格式文件,并用ChemOffice转换为3D结构,并用Mgitools(V1.5.6)软件使其能量最小化保存为pdbqt格式文件。最后用AutoDockVina(V1.1.2)软件进行分子对接验证。
2 结果
2.1 药物成分筛选与靶点预测结果 使用TCMSP数据库搜索药物有效成分,共获得有效化合物成分 88个。其中柴胡17个,枳实22个,白芍13个,刺蒺藜12个,石菖蒲4个,佛手5个,甘松5个,玫瑰花10个。运用Uniport数据库对TCMSP数据库中筛选出的基因名称进行规范化处理,经汇总后共得到1344个基因靶点,其中柴胡342个,枳实305个,白芍123个,刺蒺藜122个,石菖蒲103个,佛手48个,甘松68个,玫瑰花233个。经去重后共有233个靶点。
2.2 MMD疾病靶点筛选结果 在GeneCards数据库中检索共获得1038个基因,Durgbank数据库中共获得109个基因,OMIM数据库中共获得4个基因,PharmGkb数据库中共获得701个基因,TTD数据库中共获得67个基因。经去重并取并集后,获得与MMD相关基因靶点共1744个。(如图1所示)
2.3 疏调解郁汤核心药对治疗MMD靶点预测结果 利用venny(V2.1)软件,对筛选出的药物作用靶点和疾病基因靶点取交集。共得到105个靶点,作为疏调解郁汤作用于MMD的预测靶点。(如图2所示)
2.4 药材-化合物-疾病靶点作用网络、蛋白相互作用(PPI)网络及筛选关键靶点结果 (1)图3为得到的药材-化合物-疾病靶点作用网络图。圆圈为药物成分,其大小以degree值排列与圆圈越大疾病相关性越大。其中圆形中的不同颜色代表不同药物的有效成分。绿色为佛手,淡黄色为柴胡,紫色为刺蒺藜,红色为玫瑰花,淡蓝色为白芍,橘黄色为枳实,粉红色为甘松,深蓝色为石菖蒲。一个圆形有多种颜色代表该成分为多个药物共有。圆圈的大小按degree值排列,药物作用的靶点越多,则圆圈越大。中间的方形图标为药物作用于疾病相关靶点,相关性degree值排列,与疾病相关性越高,作用于该靶点的药物越多,图形越大,颜色越深。
(2)图4为得到的蛋白质相互作用网络图。其中蛋白质之间作用相互度越高,基因越处于图中间,且基因之间的连线越多。将由string数据库得到的PPI网络图,保存为tsv文件,用Cytoscape 3.8.2软件打开,使用Analyzer软件进行拓扑分析后,选取degree值超过中位数的基因,作为核心靶点。第一次degree值为5,黄色图标为首次筛选的核心靶点(图5所示)。将上述过程重复一次,第二次degree值为11,得,最终筛选出的核心靶点分别为MAPK1、FOS、JUN、AKT1、ESR1、STAT3。(图6所示)
2.5 关键成分筛选结果 根据药材-化合物-疾病靶点作用网络中,药物成分的degree值筛选出关键药物成分。选取degree大于平均值的成分作为关键成分。前20味的成分信息见表1。
2.6 生物学过程GO分析结果 共富集到2052条生物过程相关条目,113条分子功能相关条目,155条细胞成分相关条目。使用R用R(V4.1.2)软件,引用colorspace、stringi、ggplot2、BiocManager数据包、并导入DOSE、clusterProfiler、enrichplot插件。选取分子数量参与程度高的前10位绘制生物过程,细胞成分,分子功能的气泡图(如图7、8、9所示)。由图可见,生物过程主要涉及对异物刺激的反应、对金属离子的反应、对脂多糖的反应、对氧气水平的反应、对细菌的反应等。细胞成分主要涉及膜筏、膜微域、突触膜、转录调节因子、RNA聚合酶II转录调节因子等。分子功能主要涉及DNA的结合转录、RNA结合转录、G蛋白偶联受体激酶活动、神经递质受体活动、蛋白酶结合等。
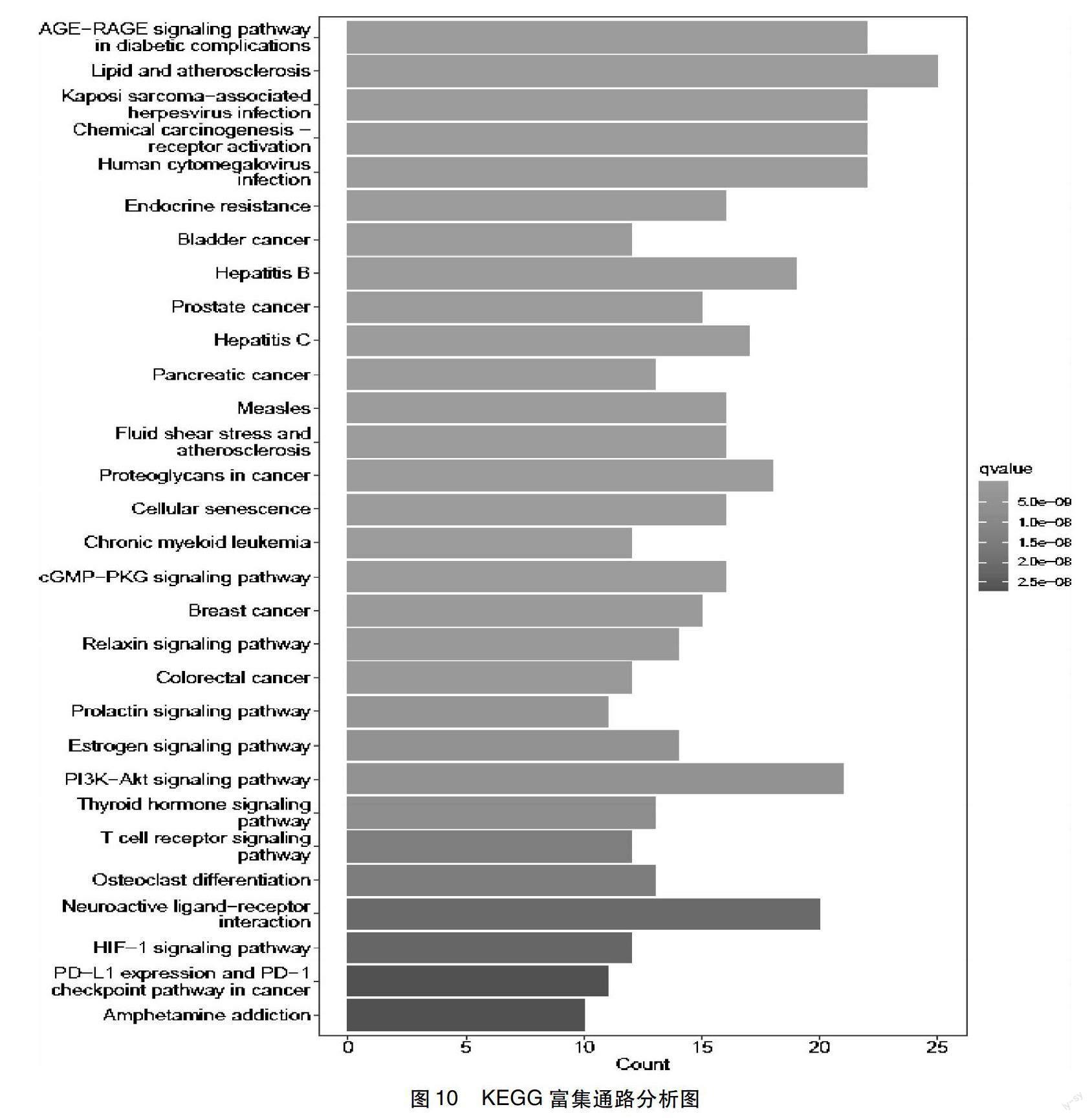
2.7 KEGG通路富集分析结果 利用R用R(V4.1.2)软件,安装Bioconductor数据库并引用“clusterProfiler”、“org.Hs.eg.db”、“enrichplot”、“ggplot2”、“pathview”对筛选出的基因进行KEGG通路富集分析。设定筛选条件为校正P值≤0.05,共富集到168条通路。由此可见,疏调解郁汤治疗MMD可能是通过多条通路,多个靶点起到治疗作用,这也体现了中药复方对疾病多靶点治疗的特点。同时筛选排名前20名的通路做通路图(图10)。其中涉及多条通路,如与糖尿病并发症相关的AGE-RAGE信号通路、脂质和动脉粥样硬化通路、卡波西肉瘤相关。
疱疹病毒感染通路、化学致癌受体激活通路、人巨细胞病毒感染、内分泌抵抗相关通路等。在168条通路中与MMD相关的主要通路为PI3K-AKT信号通路(基因占比21%)、MAPK 信号通路(基因占比17%)、Ras信号通路(基因占比10%)、Rap1信号通路(基因占比7%))、血管平滑肌收缩(基因占比8%)、胆碱能突触(基因占比12%)、MTOR信号通路(基因占比6%)、MAPK信号通路(基因占比17%)、多巴胺神经能突触(基因占比11%)、甲状腺激素信号通路(基因占比13%)、AMPK信号通路(基因占比5%)。
2.8 分子对接验证 使用筛选出的6个关键靶点(MAPK1、FOS、JUN、AKT1、ESR1、STAT3)与化合物中筛选出的排名前2的关键成分(槲皮素、木樨草素)进行分子对接验证。一般来说,结合能<0 kJ/mol,则说明受体和配体可以自由结合。目前对于结合能尚无统一筛选标准,通过阅讀相关文献,采用结合能≤-5.0 kJ/mol,作为标准[18]。(结果如表2所示)所有成分与关键靶点的分子结合能均小于上述标准,表明成分与靶点结合较好。
3 讨论
据相关流行病学调查显示,随着经济社会的不断发展,人们面临的压力也日益增大,MMD发病率在我国呈现逐年上升趋势。MMD自发现以来就被认为是多因素导致的疾病。西医认为其发病机制主要与单胺类神经递质及其受体表达异常、神经细胞可塑性及相关信号通路改变、下丘脑-垂体-肾上腺(HPA)轴持续激化引发功能紊乱、细胞因子的异常分泌引发抑郁等因素相关[19]。较西药治疗MMD而言,中药治疗MMD的优势有心神同治的整体观及丰富的临床实践经验。张老认为在抑郁症的发病过程中,核心原因主要为气血不和。正如《丹溪心法》云:“气血冲和,万病不生。一有拂郁,诸病生焉”。因此在治疗的过程中不仅要注重疏利调畅肝的气机升降,更应注重补益气血,顾护脾胃功能。疏调解郁汤核心药对中,柴胡主结气积聚、疏通肝木、推陈致新。白芍入肝家而清风,走胆腑而泻热,善调心中烦悸。枳实泻痞满而去湿,消陈腐而还清。刺蒺藜利血,宜入肝经,平肝疏肝。石菖蒲开心孔,补五脏,通九窍,明耳目。佛手疏肝理气,和胃止痛。甘松理脾胃,开气郁。玫瑰花柔肝醒胃,行气活血。现代药理学研究证明,柴胡、白芍、刺蒺藜、石菖蒲可通过单胺类神经递质及其离子通道(5羟色胺3受体)对抑郁症起治疗作用[20-24]。枳实可通过提高海马GRmRNA表达,抑制下丘脑—垂体—肾上腺皮质轴亢进、提高海马及皮质脑源性神经营养因子mRNA表达、参与提高神经递质类表达和释放及调节胃肠激素对MMD起到治疗作用[25]。佛手可通过调控HPT轴及HPA轴起到抗抑郁作用[26]。甘松可通过促进神经细胞增殖及调控cAMP、MAPK通路对抑郁症起治疗作用[27]。玫瑰花能显著增加抑郁小鼠中血清5-HT含量[28]。诸药合用,共同起到疏肝解郁,行气和血,健运脾胃之功。
疏调解郁汤为张老长期临床过程中,总结出的行之有效的处方和药味的综合体。体现了张老“调和气血”的主要思想。临床中对于缓解抑郁症患者的心理和生理症状,疗效较好。据前期临床观察显示。服用疏调解郁汤治疗的患者症状缓解明显,抑郁评分量表较服药前有所改善。本研究通过筛选疏调解郁汤核心药对中的药物活性成分及作用靶点与MMD相关疾病靶点,结果显示疏调解郁汤治疗MMD的作用与MAPK1、CTNNB1、FOS、AR、GSK3B、RUNX2、MYC、NR3C1、JUN、TP53、AKT1、HIF1A、CASP3、NCOA2、RB1等多个靶点相关。选取其中MAPK1、FOS、JUN、AKT1、ESR1、STAT36个关键靶点与药物关键成分槲皮素、木樨草素进行分子对接验证,结合能均≤-5.0 kJ/mol,表明关节化合物与核心靶点结合较好。
本研究的GO分析显示疏调解郁汤核心药对作用于MMD涉及了多个生物过程及分子功能,其中生物过程主要涉及对异物刺激的反应、对金属离子的反应、对脂多糖的反应、对氧气水平的反应、对细菌的反应等。细胞成分主要涉及膜筏、膜微域、突触膜、转录调节因子、RNA聚合酶II转录调节因子等。分子功能主要涉及DNA的结合转录、RNA结合转录、G蛋白偶联受体激酶活动、神经递质受体活动、蛋白酶结合等。有研究显示MMD的发病与细胞信号传导、线粒体能量代谢有明显关系,如cAMP-PKA传导、NDMA传导等[29-30]。KEGG通路分析显示,MMD的发病与多个通路,多种疾病均有关系。如与糖尿病并发症相关的AGE-RAGE信号通路、脂质和动脉粥样硬化通路、卡波西肉瘤相关疱疹病毒感染通路、化学致癌受体激活通路、人巨细胞病毒感染、内分泌抵抗相关通路等。近年来的研究表明,抑郁症可与肿瘤、心血管疾病、内分泌疾病等同时发生或诱发其他疾病。据相关文献显示恶性肿瘤和抑郁障碍普遍存在共病关系,癌症可能导致产生抑郁同时抑郁症导致肿瘤发生、发展、复发和转移的风险加剧[31]。同时与免疫相关的白细胞介素、肿瘤坏死因子也与抑郁症发生相关,TNF-α IL-6、IL-10通过MAPK、JAK/STAT信号通路参与RA发病的同时可导致抑郁症的发生[32]。
综上所述,疏调解郁汤核心药对MMD的治疗作用可能与MAPK1、CTNNB1、FOS、AR、GSK3B、RUNX2、MYC、NR3C1、JUN、TP53、AKT1、HIF1A、CASP3、NCOA2、RB1等多个靶点相关。可能对糖尿病并发症相关的AGE-RAGE信号通路、脂质和动脉粥样硬化通路、卡波西肉瘤相关疱疹病毒感染通路、化学致癌受体激活通路、人巨细胞病毒感染、内分泌抵抗相关通路有调控作用。同时对与MMD 相关的PI3K-AKT信号通路、MAPK 信号通路、Ras信号通路、Rap1信号通路、血管平滑肌收缩、胆碱能突触、MTOR信号通路、MAPK信号通路、多巴胺神经能突触、甲状腺激素信号通路、AMPK信号通路也具有治疗作用。因此,疏调解郁汤核心药对对MMD的治疗和干预是通过多靶点,多通路实现的。其具体机制和通路还需通过进一步动物实验研究和验证。
参考文献:
[1]范俭雄,张宁.精神病学[M].3版.南京:东南大学出版社,2017:782.
[2]江爱国.抑郁症患者自杀行为危.机干预观察[J].临床心身疾病杂志,2011,17(2):169-170.
[3]Askelund AD,Schweizer S,Goodyer IM,et al.Positive memory specificity is associated with reduced vulnerability to depression[J].Nat Hum Behav,2019,3(3):265-273.
[4]Ng M,Fleming T,Robinson M,Global,regional,and national prevalence of overweight and obesity in children and adults during 1980-2013:a systematic analysis for the Global Burden of Disease Study 2013[J].Lancet,2014,384(9945):766-781.
[5]Ménard C,Hodes GE,Russo SJ.Pathogenesis of depression:Insights from human and rodent studies[J].Neuroscience,2016,321(3):138-162.
[6]Ogodek E,Szota A,Just M,et al.The role of the neuroendocrine and immune systems in the pathogenesis of depression[J].Pharmacol Rep,2014,66(5):776-81.
[7]Jokela M,García-Velázquez R,Airaksinen J,et al.Chronic diseases and social risk factors in relation to specific symptoms of depression:Evidence from the U.S.national health and nutrition examination surveys[J].J Affect Disord,2019,15(50):242-247.
[8]Hayley S,Litteljohn D.Neuroplasticity and the next wave of antidepressant strategies[J].Front Cell Neurosci,2013,7(20):218.
[9]Bambico FR,Belzung C.Novel insights into depression and antidepressants: a synergy between synaptogenesis and neurogenesis[J]. Curr Top Behav Neurosci,2013(15):243-291.
[10]過伟峰,曹晓岚,盛蕾,等.抑郁症中西医结合诊疗专家共识[J].中国中西医结合杂志,2020,40(2):141-148.
[11]张震,田春洪.国医大师张震气机疏调论治[M].北京:中国医药科技出版社,2018:63.
[12]Jinlong Ru,Peng Li,Jinan Wang,et al.TCMSP:a database of systems pharmacology for drug discovery from herbal medicines[J].Cheminformatics,2014,16,6(1):13.
[13]Rebhan M,Chalifa-Caspi V,Prilusky J,et al.GeneCards:integrating information about genes,proteins and diseases[J].Trends Genet,1997,13(4):163.
[14]Hamosh A,Scott AF,Amberger JS,et al.Online Mendelian Inheritance in Man(OMIM),a knowledgebase of human genes and genetic disorders[J].Nucleic Acids Res,2005,1,33(Database issue):D514-517.
[15]Whirl-Carrillo M,McDonagh EM,Hebert JM,et al.Pharmacogenomics knowledge for personalized medicine[J].Clin Pharmacol Ther,2012,92(4):414-417.
[16]Zhu F,Shi Z,Qin C,et al.Therapeutic target database update 2012:a resource for facilitating target-oriented drug discovery[J].Nucleic Acids Res,2012 Jan,40(Database issue):1128-1136.
[17]Liang X,Li H,Li S.A novel network pharmacology approach to analyse traditional herbal formulae:the Liu-Wei-Di-Huang pill as a case study[J].Mol Biosyst,2014,10(5):1014-1022.
[18]邓燕君,刘博文,贺桢翔,等.基于网络药理学和分子对接法探索藿香正气口服液预防新型冠状病毒肺炎(COVID-19)活性化合物研究[J].中草药,2020,51(5):1113-1122.
[19]许鹏,章程鹏.基于抑郁症发病机制的中药防治规律[J].中国实验方剂学杂志,2020,26(7):232-238.
[20]李芳,王杰琼,宋春红,等.柴胡提取物对大鼠海马原代培养神经元5-HT_3受体介导离子通道的影响[J].世界科学技术-中医药现代化,2015,17(11):2224-2228.
[21]马海娟,李芳,宋春红,等.白芍提取物对大鼠海马原代培养神经元5-羟色胺3受体介导离子通道的影响[J].中草药,2017,48(6):1167-1171.
[23]沈双宏,沈晓东,胡随遇,等.刺蒺藜苷对抑郁模型大鼠海马齿状回神经发生的影响[J].中医药学报,2008(3):13-83.
[24]王联生,潘菊华.石菖蒲治疗抑郁症的研究进展[J].环球中医药,2017,10(4):509-512.
[25]张晓南,黄世敬.枳实、枳壳的抗抑郁作用[J].环球中医药,2014,7(1):77-80.
[26]宋美卿,馬澜,贾力莉,等.对药香橼佛手对抑郁大鼠HPT轴和HPA轴功能的影响[J].中华中医药杂志,2017,32(10):4633-4636.
[27]李琴.甘松新酮抗抑郁作用及作用机制初探[D].北京:北京中医药大学,2011.
[28]梁明坤,韦宇婷,梁杏秋,等.玫瑰花颗粒对抑郁小鼠行为学及血清5-HT的影响[J].陕西科技大学学报,2021,39(1):70-74.
[29]徐向青,唐启盛.抑郁症与细胞信号转导研究进展[J].中国医药导报,2012,9(36):49-50.
[30]刘少博,令狐婷,高耀,等.线粒体能量代谢障碍在抑郁症发病机制中的关键作用[J].中国药理学与毒理学杂志,2019,33(10):865.
[31]王苗苗,吴密璐.恶性肿瘤抑郁症的临床研究进展[J].现代肿瘤医学,2016,24(8):1315-1317.
[32]陈慧芳,王晓霞,何佳莉,等.肿瘤坏死因子α与白细胞介素6和白细胞介素10及相关信号通路在类风湿关节炎合并抑郁症中的研究进展[J].中国医药,2019,14(4):629-632.
(收稿日期:2022-05-06)

