瘤内微生物与肿瘤免疫治疗的研究进展
刘金燕,张 毅
1)郑州大学第一附属医院生物细胞治疗中心 郑州 450052 2)郑州大学第一附属医院省部共建食管癌防治国家重点实验室 郑州 450052
据估计,人体内有3万亿个细菌,参与调控机体生理过程和疾病易感性。虽然细菌数量和人体细胞数量相当,但是细菌的遗传多样性比人体细胞高100倍,其编码的基因能够使细菌具有很强的运动和代谢能力,不仅影响自身,还影响宿主组织特异性和免疫反应[1-3]。除细菌外,人体微生物还包括真核生物、真菌、原核生物和病毒等。微生物和人类互为共生关系,它们主要栖息在人体的黏膜组织(包括胃肠道、口腔、皮肤等),与人类的健康和疾病息息相关[4]。现已证实,肠道微生物参与糖尿病、阿尔兹海默症和肿瘤等多种疾病的发生、进展,并与临床疗效有关[5]。肿瘤组织中也存在微生物,虽然不足以诱导癌症,但间接促进了癌症的发生[3]。本文以瘤内微生物与肿瘤免疫反应的关系为切入点,探讨瘤内微生物与肿瘤免疫治疗的关系及其在肿瘤防治中的作用。
1 微生物和肿瘤关系的研究历史及进展
微生物与人类癌症关系的研究历史紧密交织[6]。13世纪,佩雷格林·拉齐奥西(1265-1345)因罹患癌症而面临截肢,截肢后发生严重感染,但癌症却神奇消失且再也没有复发[7]。19世纪,科赫和巴斯德观察到肿瘤内细菌的存在,这也是记载的最早观察到瘤内细菌的报道。19世纪晚期,威廉布施和弗里德里希分别独立报道了化脓性链球菌感染与肿瘤患者自发性肿瘤消退有关[8]。1891年,美国纽约纪念医院骨科医师威廉科利从因感染而自愈的癌症患者的伤口中分离出酿脓链球菌,并研发了灭活版的细菌,创立“科利毒素”疗法。虽然当时挽救了不少无药可医的恶性肿瘤患者,然而,由于当时使用的方案包含活的链球菌和沙雷菌而备受争议[9]。同时期,托马斯格洛弗和弗吉尼亚利文斯顿惠勒认为,细菌可以从肿瘤组织中培养出来,且细菌疫苗可治疗肿瘤,并提出了癌症的普遍细菌起源假说[2]。尽管这些早期的尝试充满了错误,癌症的细菌理论也被否定了,但瘤内微生物的存在却是不容置疑的事实。
随着二代测序技术的发展,肺、前列腺、膀胱、乳腺、肝脏和胰腺等曾经被认为是无菌的器官中也被检测出了低丰度的微生物类群。2020年,有学者[10]以胶质母细胞瘤、乳腺癌、卵巢癌、骨肉瘤、胰腺癌、黑色素瘤和肺癌等7种肿瘤1 500多例癌组织为研究对象,发现癌细胞和免疫细胞中均存在生物活性的细菌。此外,文献[10]证实,瘤内微生物失调与癌症发生、发展有关,包括口腔鳞癌、结直肠癌、肺癌、胰腺癌、乳腺癌、肝细胞癌、皮肤癌、肾细胞癌、前列腺癌、鼻咽癌等。这些肿瘤组织中常驻细菌被归类为“瘤内微生物”。当前,有3种假说解释瘤内微生物的起源。①黏膜入侵:由细菌或其他因素引起的黏膜屏障损伤会导致原本生活在这些黏膜部位的机会性微生物(肺、胃肠道、皮肤等黏膜器官中微生物)迁移至肿瘤部位。②邻近部位迁移:肿瘤邻近正常组织中的微生物向肿瘤组织迁移,如胰腺癌、肝癌等[11]。③循环系统入侵:口腔、肠道和其他部位的微生物可经血液扩散至肿瘤微环境[12]。
2 瘤内微生物特征
虽然不同类型的肿瘤组织中微生物的分布呈现很大差异[10],但多项研究证实,瘤内微生物具有一些共同特征:丰度远低于肠道[13];瘤内微生物群落多样性通常低于正常组织[14];瘤内菌群大多是共生生物,是活菌,主要存在于细胞内[10]。目前已知的微生物多达1012种,但只有11种被国际癌症登记协会(IACR)认定为人类致癌物,或称“oncomicrobes”,全世界大约13%的癌症病例与这些致癌物感染有关[15]。尽管IACR认定的致癌微生物在近十年都没有更新,且未明确新的可诱导癌症发生的微生物,但二代测序技术的发展证实数十种微生物间接调控或促进癌症发生,包括具核梭杆菌[1]、沙门菌[2]和脆弱拟杆菌[16]等。微生物参与调控肿瘤发生和进展的主要机制包括以下几方面。①直接接触的相互作用:细菌毒素介导的DNA损伤,诱导肿瘤发生[17];或激活β-连环蛋白等致癌途径[18]。②非接触依赖的相互作用:产生代谢生物活性分子和外膜囊泡,通过体循环到达肿瘤原发位点及转移位点,从而间接诱导肿瘤发生[19]。③免疫互作:局部或远端微生物参与调控先天性和适应性免疫反应,导致肿瘤微环境内或系统性的免疫反应和免疫监视[4,10]。综上所述,虽然瘤内微生物多样性低、丰度低,但可通过直接或间接的方式促进癌症的发生、进展。
3 瘤内微生物参与调控免疫反应
瘤内微生物最显著的特征之一是可以被免疫系统监视识别,从而引发特定的免疫反应[9]。目前,关于肠道菌群失调与免疫功能异常的相关性已有报道[20],但瘤内微生物调控免疫反应的作用和机制研究仍处于起步阶段。
一方面,瘤内微生物促进并维持免疫抑制微环境。主要机制如下。①产生大量活性氧:脆弱拟杆菌通过产生活性氧诱导并维持肿瘤免疫抑制微环境,进而促进结直肠癌进展[21]。②促进肿瘤细胞免疫逃逸:瘤内微生物通过降低肿瘤细胞表达主要组织相容性复合体分子[22],上调细胞程序性死亡-配体1(PD-L1)的表达[23],使得肿瘤细胞躲避杀伤性免疫系统的监视,从而发生免疫逃逸。③维持免疫抑制微环境[23-26]:瘤内微生物可以激活或招募髓源性抑制细胞、调节性T细胞、中性粒细胞、巨噬细胞等免疫抑制细胞亚群,进而抑制杀伤性T细胞功能[24]。④释放炎症因子:具核梭杆菌被认为是免疫抑制反应相关的微生物,可以诱导释放大量炎症因子[26]。⑤抑制杀伤性T细胞和自然杀伤细胞(NK细胞)的功能:瘤内微生物通过与免疫球蛋白和ITIM结构域蛋白受体结合,进而抑制T细胞和NK细胞活化[26]。此外,结直肠癌和黑色素瘤小鼠模型中,胃部幽门螺杆菌的感染降低杀伤性T细胞的浸润和活化,削弱免疫检查点抑制剂疗效;临床肺癌患者是否感染幽门螺杆菌与抗PD-1疗效存在负相关,并降低患者生存率[27]。瘤内清除乳腺癌组织中的具核梭杆菌可以显著减少肺转移[17]。以小鼠黑色素瘤为模型,抗生素治疗可通过降低细菌负荷减少调节性T细胞的浸润,而增加杀伤性T细胞和NK细胞活化,进而减少肺转移[28]。这些进一步证实肿瘤内细菌激发免疫抑制反应。
另一方面,瘤内微生物可以增强抗肿瘤免疫反应。主要机制如下。①激活干扰素基因刺激蛋白(STING)信号通路:嗜黏蛋白阿克曼菌产生的环二腺苷酸通过激活STING信号通路增强对肿瘤细胞的抗原呈递[29]。②促进三级淋巴结构成熟:肝螺杆菌通过促进三级淋巴结构成熟,增强抗肿瘤免疫反应[30]。③激活杀伤性T细胞和NK细胞:瘤内微生物可以促进杀伤性T细胞和NK细胞浸润和激活,诱导较强的抗肿瘤免疫反应[31]。④细菌肽段激活免疫系统:以恶性黑色素瘤为研究对象,发现癌细胞中存在细菌肽,可经肿瘤细胞呈递,进而诱发免疫反应[32]。⑤诱导并维持抗炎微环境:瘤内微生物通过分泌IL-17等细胞因子促进抗肿瘤免疫微环境的形成[33]。此外,鼠李糖乳杆菌可诱发较强的抗肿瘤免疫反应,从而减少小鼠黑色素瘤肺转移[28]。双歧杆菌通过增强机体抗肿瘤免疫反应,提高免疫检查点抑制剂的抗肿瘤疗效[34];而瘤内注射双歧杆菌,通过刺激STING信号通路增加树突状细胞数量,增强抗CD47免疫疗效[35]。这进一步证实部分肿瘤内细菌可以触发抗肿瘤免疫反应。
肿瘤微环境中免疫系统与微生物的相互作用有两种方式:①全身性,主要位于黏膜表面,通过代谢物和外膜囊泡影响全身[19]。②局部性,发生在淋巴器官内或肿瘤微环境中产生局部影响[14]。这两种方式均可调控先天性和适应性免疫反应,调控系统性或肿瘤微环境免疫反应。肿瘤内细菌对免疫系统的调控是复杂的,这可能是由菌群物种特异性和定居状态所决定的。
4 瘤内微生物调控肿瘤免疫治疗
瘤内微生物通过诱发炎症或局部免疫抑制等方式调控肿瘤微环境,这将改变人体免疫系统对肿瘤的响应,并影响临床疗效[7]。瘤内微生物的存在可能与全身疗法,尤其是免疫疗法,协调作用。恶性黑色素瘤内菌群的组成影响其对免疫检查点抑制剂的敏感性[10]。肿瘤内的微生物可提高PD-L1/PD-1单抗疗效。这可能与瘤内菌群促进杀伤性T细胞浸润和活化[36],上调PD-L1表达[37]或通过产物激活免疫反应、杀伤肿瘤细胞[38]等有关。此外,瘤内微生物还可能作为靶点用于制备疫苗或过继性细胞回输。EB病毒(Epstein-Barr virus,EBV)相关的淋巴增殖性疾病在移植后回输EBV特异性的CD8+T细胞可以有效恢复抗EBV的免疫反应[39],这为其他与EBV相关癌症,如鼻咽癌、霍奇金淋巴瘤和NK/T细胞淋巴瘤等的免疫治疗提供了重要参考[40]。虽然由于成本和制作复杂性,靶向人乳头瘤病毒的过继性T细胞疗法尚未在临床转化,但这依然被视为治疗头颈癌、宫颈癌等的曙光[40]。
尽管威廉科利试图通过微生物来治愈肿瘤的尝试由于使用活菌而备受争议,但这依然为现代细菌性癌症疗法提供了重要参考。目前美国食品药品监督管理局已批准两种类似药物:溶瘤病毒免疫疗法治疗晚期黑色素瘤和卡介苗治疗高风险、非肌肉浸润性膀胱癌[41]。此外,合成生物学和工程细菌癌症疗法正在临床前和临床试验中。细菌在肿瘤组织中选择性生长的独特能力,使得可以通过注射工程菌在肿瘤内产生药物进行治疗[42]。利用合成生物学方法,细菌也可以被改造成具有“感知”周围环境的能力,进一步提高它们的治疗或诊断能力[43]。通过分析肿瘤的微生物群,可能会发现细菌选择性地在肿瘤中定植[31]。这类细菌的发现将减少对特异性基因工程菌的需求,因为它们将在全身给药后自然定植于肿瘤。然而,这样的做法要成为现实,仍然面临着相当大的挑战。此外,研究者[32]发现,黑色素瘤组织中存在细菌,这些细菌主要定植在肿瘤细胞内,这使得细菌表达的多肽可以被抗原呈递细胞呈递并启动免疫反应,也可以成为免疫系统识别并攻击癌细胞的靶点。这意味着细菌表达的多肽可能作为肿瘤抗原,成为免疫治疗的靶点,但是这需要更多深入的研究来证实其有效性和安全性[44]。研究者尝试从促瘤微生物入手,开发微生物疫苗来增强抗肿瘤免疫反应,然而,这些研究均处于初期阶段[45]。
瘤内微生物和宿主免疫应答之间的相互作用较为复杂,这也导致对全身治疗的潜在有利和有害作用。因此,确定特定肿瘤类型中的优势微生物为个性化定制肿瘤治疗方案具有非常重要的现实意义。虽然大量临床前研究证据显示瘤内微生物调控与免疫治疗的关系,但将这种调节方法转化为商业化治疗方案尚需更多的研究来证实(图1)。
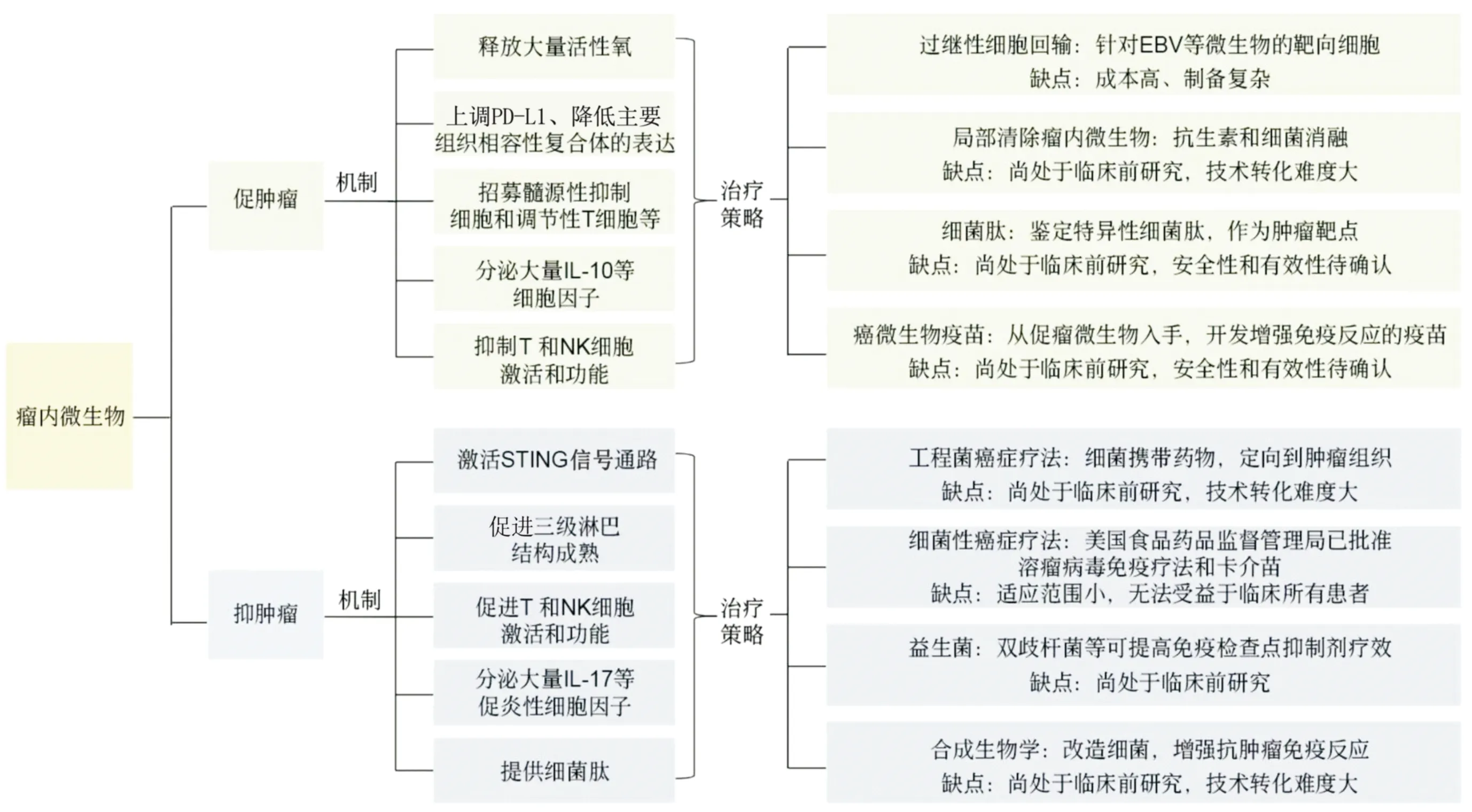
图1 瘤内微生物调控肿瘤免疫反应的机制和潜在治疗策略
5 靶向瘤内微生物以增强肿瘤免疫治疗效果
肿瘤组织是癌细胞、宿主与微生物相互作用的复合体,研究[27]证实,肿瘤微环境中的微生物群与免疫抑制微环境相关,并与临床PD-1单抗疗效和患者生存相关。那么,靶向清除瘤内微生物是否有助于提高肿瘤免疫治疗效果呢?研究[17]证实,瘤内清除乳腺癌组织中的具核梭杆菌可以显著减少肺转移。抗生素局部处理[28]和细菌消融[24]均可以通过重塑免疫微环境,增强抗肿瘤反应,提示局部清除瘤内菌群可能通过改变免疫微环境调控肿瘤免疫治疗效果。此外,研究[46]证实5-氟尿嘧啶可特异性清除结直肠癌细胞中具核梭杆菌,为临床清除瘤内有害菌进而增强抗肿瘤免疫治疗效果提供了重要参考。
然而,也有关于益生菌促进肿瘤免疫疗效的报道。沙门菌表达的LPS通过增加IL-1β表达,并通过炎症小体和Toll样受体4介导的信号通路调控抗肿瘤免疫反应[47]。革兰阴性细菌的鞭毛可通过促进杀伤性CD8+T细胞、抑制免疫抑制性调节性T细胞来促进抗肿瘤作用[48]。鼠李糖乳杆菌[28]和双歧杆菌[34]被报道通过激活抗肿瘤免疫反应,增强免疫检查点抑制剂疗效。上述研究提示鉴定并合理使用益生菌有助于增强临床肿瘤免疫治疗效果。由此可见,肿瘤微环境中复杂的微生物构成决定了无法使用统一的方案来进行干预以增强临床肿瘤免疫治疗效果。需要指出的是,无论是定向清除有害菌还是外源加入益生菌,均需要在肿瘤局部来完成,而肿瘤在空间和质地上的差异和复杂性加大了这一难度,还需研究更加安全、高效的策略来实现肿瘤的靶向治疗。此外,虽然瘤内益生菌的增多会促进抗肿瘤疗效,然而这种策略同时也有较大的风险,大量益生菌的无限增殖和随机迁移对机体会造成什么样的后果均需要深入研究。
6 展望
尽管瘤内微生物已有悠久的研究历史,然而直到最近几年才被认定为是肿瘤生态系统的组成部分。受益于技术的发展,瘤内微生物的研究取得了一定的突破。瘤内微生物参与了癌症发生、进展,并参与调控免疫微环境,与肿瘤病理类型、药物反应和临床预后相关。癌细胞进化比细菌慢,而肠道内共生菌在进化过程中会转化为致病菌。这意味着瘤内微生物可以作为药物靶点或佐剂与其他抗肿瘤方案联合使用。此外,肿瘤内细菌定植于细胞内和细胞外的特性使得它们成为递送药物的理想载体。虽然当前瘤内微生物的研究结果鼓舞着研究者开发针对性的治疗方案,但是我们应该始终牢记100多年前科利毒素由于结果不稳定而未在临床广泛推广的案例。因此,完全揭示瘤内微生物在癌症进程中的作用、探明肿瘤微环境中决定细菌疗法疗效的关键因素、开发动态追踪肿瘤内菌群时空活动的技术和模型等依然是瘤内菌群的研究重点。

