CAR和CD4+/CD8+与传染性单核细胞增多症合并肝损伤患儿病情及其预后的相关性
丁忠丽 崔蕾 储开东
传染性单核细胞增多症(IM)是EB病毒(EBV)感染所致的多因素和多类型的临床综合征,是儿童常见的感染性疾病之一[1]。IM大多为自限性疾病,但在疾病过程中可累及并导致多器官功能损害,其中以肝损伤最常见[2]。肝脏是EBV最易侵犯的器官之一,有70%~90%的IM患儿可出现不同程度的肝功能损害,多以肝转氨酶升高为主,部分可出现胆红素代谢异常导致急性淤胆型肝炎,极少数患儿出现暴发性肝炎提示预后不佳[3]。C-反应蛋白(CRP)是急性期正向反应蛋白,白蛋白(Alb)是急性期负向反应蛋白,C-反应蛋白/白蛋白比值(CAR)反映机体的急性炎症状态和肝功能水平,常应用于多种严重感染的诊断评估[4],但目前鲜见关于IM的相关研究报道。CD4+和CD8+T细胞维持和调节机体的免疫功能平衡,CD4+/CD8+表达水平与机体的免疫功能呈正相关[5]。本研究探讨CAR和CD4+/CD8+表达水平与IM肝损伤患儿病情程度和疾病预后的相关性,旨在为早期诊断、病情监测和预后评估提供参考依据。
资料与方法
一、一般资料
选择南通大学附属海安医院儿科2020年7月—2022年3月收治的IM患儿130例,列入观察组;按照肝功能检查是否异常分为肝损伤组(n=86)和非肝损伤组(n=34);选择同期在本院健康体检儿童50例,列入健康组。肝损伤组中男性48例,女性38例;年龄2~12岁,平均(7.26±2.38)岁;体质指数(BMI)为10.5~18.2 kg/m2,平均(14.84±1.56)kg/m2;病程2~7 d(3.58±1.04)d。非肝损伤组中男性28例,女性16例;年龄2~12岁,平均(7.21±2.35)岁;BMI为10.4~18.5 kg/m2,平均(14.89±1.52)kg/m2;病程2~7 d(3.54±1.06)d。对照组中男性29例,女性21例;年龄2~12岁,平均(7.34±2.39)岁;BMI为10.3~18.4 kg/m2,平均(14.80±1.55)kg/m2。三组一般资料比较差异无统计学意义(P>0.05),具可比性。
二、病例选择标准
(1)诊断标准:根据流行学、典型症状体征、血清学和抗体检测,符合IM的诊断标准[6];肝功能检查丙氨酸氨基转移酶(ALT)>50 U/L和/或天冬氨酸氨基转移酶(AST)>40 U/L和/或总胆红素(TBil)≥20 mol/L[7]。(2)入选标准:①首先发病;②年龄2~12岁;③患儿监护人知情同意和医院伦理委员会审批。(3)排除标准:①合并其他细菌、病毒、支原体等感染;②原发性肝胆疾病,其他因素导致的肝损伤;③免疫性疾病。(4)剔除标准:资料不完整,中途退出研究,失访等。
三、研究方法
(一)指标检测 (1)观察组于入院后第2天(对照组于体检当日),采集清晨空腹上肢静脉血液5 mL,以3000 r/min的速度离心10 min后备用。使用全自动生化分析仪,采用连续监测法检测ALT、AST、Alb和总胆汁酸(TBA)水平;采用酶联免疫吸附试验(ELISA)测定CRP和免疫球蛋白M(IgM)水平;使用流式细胞分析仪和配套试剂,检测T淋巴细胞亚群CD4+和CD8+的表达水平;使用荧光定量基因扩增分析仪,采用实时荧光探针定量PCR技术检测EBV DNA载量。计算CAR和CD4+/CD8+。(2)急性生理与慢性健康状况评分系统Ⅱ(APACHEⅡ)包括急性生理学变量、年龄因素和慢性健康状况等项目,总分0~71分,评分越高表示病情越严重[8]。
(二)临床分组 (1)根据肝功能异常程度,将观察组分成轻度肝损伤组(50 U/L>ALT和/或80 U/L
(三)分析方法 (1)比较观察组和对照组、观察组各亚组之间的CAR和CD4+/CD8+比值。(2)Pearson分析观察组患儿CAR和CD4+/CD8+与TBA、IgM和APACHEⅡ评分的相关性。(3)绘制受试者工作特征曲线(ROC),分析单独和联合检测CAR和CD4+/CD8+对IM合并肝损伤患儿的评估效能。
四、统计学方法
结 果
一、三组CAR和CD4+/CD8+的比较
肝损伤组的CAR高于非肝损伤组和健康组,呈递减趋势;CD4+/CD8+低于非肝损伤组和健康组,呈递增趋势,差异有统计学意义(P<0.05)。见表1。
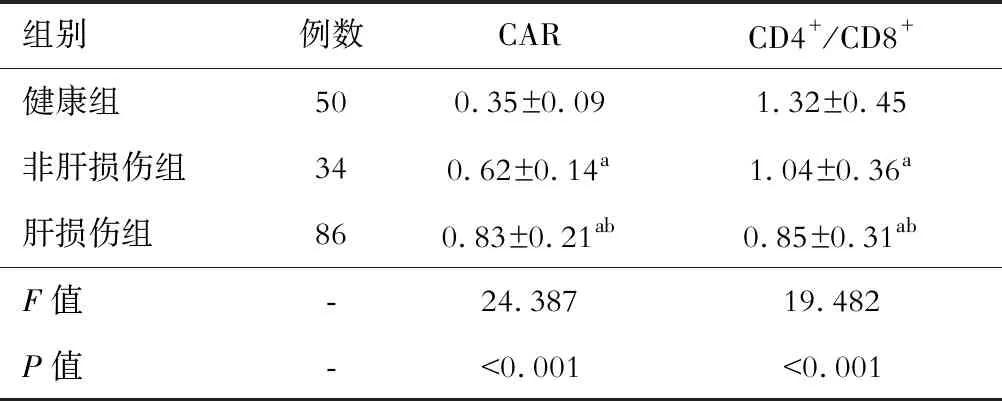
表1 三组NCAR和CD4+/CD8+的比较
二、不同肝损伤亚组CAR和CD4+/CD8+的比较
观察组中,重度肝损伤亚组的CAR高于中度和轻度亚组,呈递减趋势;CD4+/CD8+低于中度和轻度亚组,呈递增趋势,差异有统计学意义(P<0.05)。见表2。

表2 不同肝损伤亚组CAR和CD4+/CD8+的比较
三、不同EBV DNA载量亚组CAR和CD4+/CD8+的比较
观察组中,高载量亚组的CAR高于中载量和低载量亚组,呈递减趋势;CD4+/CD8+低于中载量和轻载量亚组,呈递增趋势,差异有统计学意义(P<0.05)。见表3。
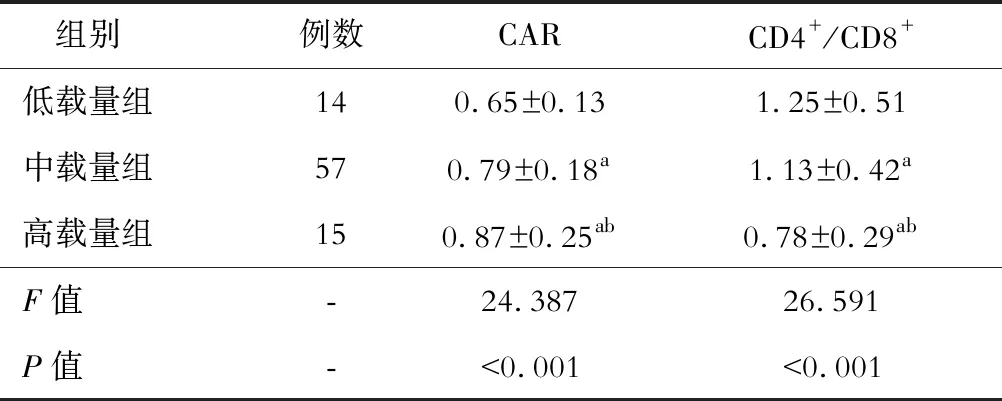
表3 不同EBV DNA载量亚组CAR和CD4+/CD8+的比较
四、不同病程CAR和CD4+/CD8+的比较
观察组中,急性期时的CAR高于康复期,CD4+/CD8+低于康复期组,差异有统计学意义(P<0.05)。见表4。
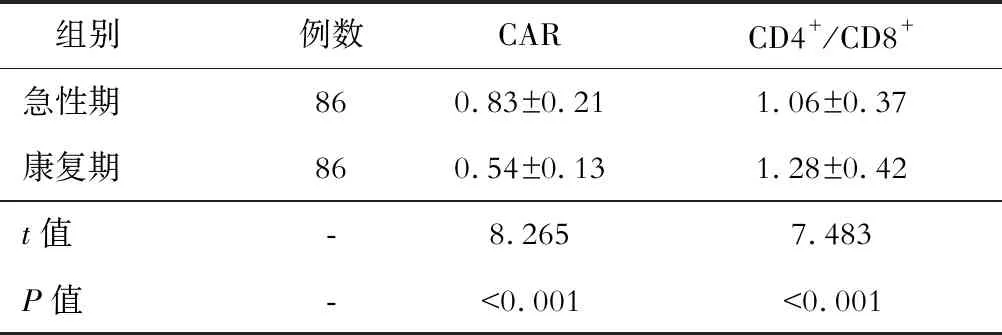
表4 不同病程CAR和CD4+/CD8+的比较
五、观察组CAR和CD4+/CD8+的与TBA、IgM和APACHEⅡ评分的相关性
Pearson分析显示,IM肝损伤患儿的CAR与TBA、IgM和APACHEⅡ评分呈正相关,CD4+/CD8+呈负相关(P<0.01)。见表5。
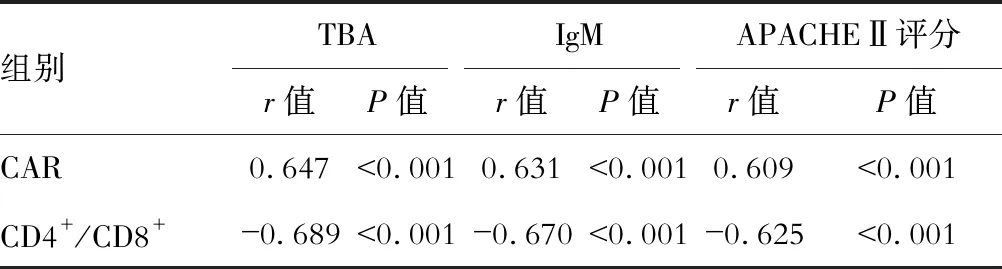
表5 CAR和CD4+/CD8+与TBA、IgM和APACHEⅡ评分的相关性
六、CAR和CD4+/CD8+联合检测对IM患儿肝损伤的评估价值
ROC显示,CAR和CD4+/CD8+单独及联合检测评估IM肝损伤患儿的AUC分别为0.794、0.758和0.916,联合检测的敏感度和特异性均高于任一单项检测的效能,差异有统计学意义(P<0.01)。见表6和图1。
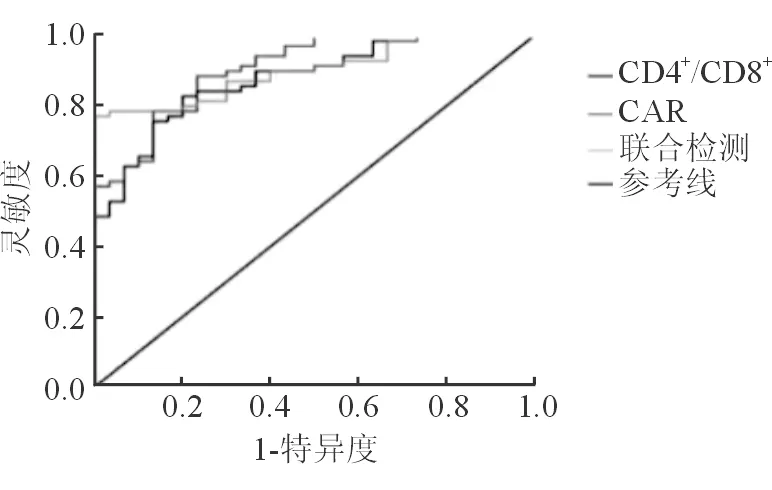
图1 IM肝损伤患儿CAR和CD4+/CD8+检测诊断的ROC曲线
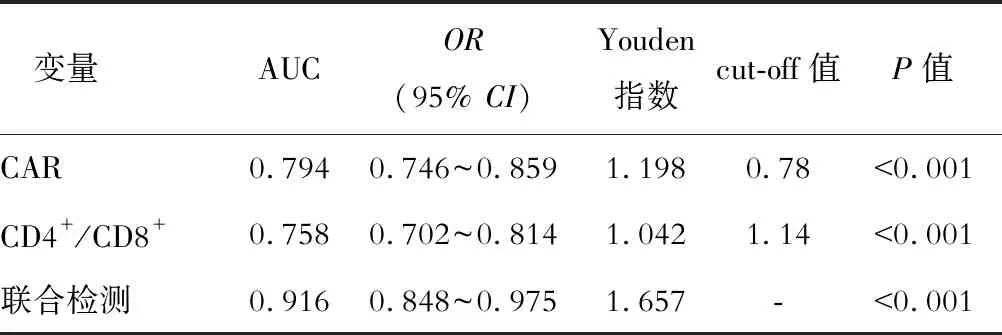
表6 CAR和CD4+/CD8+联合检测对IM患儿肝损伤的评估价值
讨 论
IM的病理机制为EBV感染诱发脂质过氧化应激反应,释放出大量的炎症介质和氧自由基,诱发炎症反应和血管内皮损伤,在肝脏内发生持续性炎症反应,导致肝酶和胆红素代谢异常等肝功能损害表现[9];EBV感染诱发机体发生免疫应答反应导致免疫功能紊乱,促使大量细胞因子释放,产生毒性反应损伤肝细胞[10]。EBV DNA载量可如实反映机体免疫和EBV之间的平衡性,与患儿炎症应激水平、免疫功能状态和肝损伤程度显著相关[11]。
CRP是肝细胞合成的急性时相正向反应蛋白,在机体遭受病毒或细菌等微生物感染的早期,可被炎症细胞因子和炎症介质激活,通过激活补体和吞噬细胞功能发挥炎症应激反应作用,加重感染和导致器官功能损伤[12]。Alb是由肝脏合成的急性时相负向反应蛋白,具有维持机体营养代谢和渗透压等重要的生理功能,当炎症反应增加毛细血管通透性和肝功能损害时血清水平略有下降[13]。国内外多项研究表明[14-15],CAR与机体的炎症反应水平、高凝状态、微血栓形成等密切相关,其水平变化与机体感染的严重程度显著相关,是骨科置入物手术患者术后发生感染的独立危险因素和预测因子[16];可评价机体的炎症状况和肝功能水平,是评估乙型肝炎病毒相关慢加急性肝衰竭患者病情和预后的炎症反应标志物[17];肝硬化患者的Alb水平明显降低,并发自发性细菌性腹膜炎(SBP)时CRP水平升高,导致CAR水平显著升高,是肝硬化患者并发SBP的独立危险因素[18];肺血栓产生炎症反应激活凝血酶原,促进多种细胞因子和黏附因子的表达,导致血管内皮损伤,CAR水平是肺血栓栓塞症患者疾病程度和预后的评估标志物[19]。本研究结果显示,IM肝损伤患儿的CAR水平显著高于非肝损伤患儿和健康儿童,且随着肝功能损害程度和EBV DNA载量的增加而逐渐升高,在疾病的康复期逐渐下降,提示CAR表达水平与IM合并肝损伤患儿的病情严重程度和疾病预后呈显著正相关,应早期给予抗炎和护肝治疗,可作为病情和预后评估的预测因子。
EBV感染通过诱发和激活机体免疫能力相关因子,导致以细胞凋亡为主要表现的靶器官功能损害[20]。B淋巴细胞表面有EBV受体,是EBV主要攻击和首先受累的靶细胞,可导致B淋巴细胞抗原性改变和转化为T淋巴细胞效应细胞[21]。CD4+T细胞具有激活细胞毒性T细胞并维持其数量和功能,生成和支持高亲和力抗体等生理作用[22];CD8+T细胞能溶解受感染失去免疫活性的靶细胞并使之凋亡,通过发挥细胞毒作用调节机体的免疫功能,是IM患者并发肝损伤的独立危险因素[23]。EBV侵袭患儿的免疫系统产生免疫应答反应,诱导CD8+T细胞大量增殖并被肝脏选择性捕获,血清表达水平显著升高[24]。大量CD8+T细胞通过T细胞内抗原和穿孔素等细胞毒性颗粒的高表达,产生大量的细胞因子和炎症介质,与肝窦内活化淋巴细胞发生旁观者效应,诱导脂质过氧化反应释放大量氧自由基,导致肝损伤[25]。大量具有细胞毒性的CD8+T细胞使具有免疫调节功能的CD4+T细胞被逐渐消耗,导致CD4+水平下降和免疫功能紊乱[26]。本研究显示,IM肝损伤患儿的CD4+/CD8+表达水平显著低于非肝损伤患儿和健康儿童,且随着肝功能损害程度和EBV DNA载量的增加而逐渐下降,在疾病的康复期逐渐升高,提示CAR表达水平与IM合并肝损伤患儿的病情严重程度和疾病预后呈显著负相关,可作为病情和预后评估的预测因子,应早期给予调节免疫和护肝治疗。IM患儿的CD4+/CD8+显著高于非IM患儿,通过检测末梢血淋巴细胞亚群水平可快速了解患儿的免疫状态,为早期诊断和免疫疗法提供理论参考[27];对IM患儿采用干扰素α1b联合辅助治疗后CD4+/CD8+水平显著升高,有效改善了免疫功能,减轻了炎症应激反应,促进了临床症状的缓解[28],均与本研究结果一致。
EBV感染浸润肝胆管释放大量的促炎细胞因子,影响肝窦和小胆管的转运功能,出现TBA水平升高等胆红素代谢功能异常表现[7]。B细胞是体液免疫的主要效应细胞,EBV感染B细胞后产生大量IgM,以期增强机体的免疫和抗感染能力[1]。APACHEⅡ评分包括生命体征、血流动力学、血生化、血常规和格拉斯哥昏迷量表等参数,评分与病情严重程度呈正相关[9]。本研究Pearson显示,IM肝损伤患儿的CAR与TBA、IgM和APACHEⅡ评分呈正相关,CD4+/CD8+呈负相关(P<0.01)提示IM肝损伤患儿的病情越严重,CAR表达水平越高,CD4+/CD8+表达水平越低,能反映病情严重程度和疾病预后。本研究进一步ROC显示,CAR和CD4+/CD8+单独及联合检测评估IM患儿肝损伤的AUC分别为0.794、0.758和0.916,联合检测的敏感度和特异性均高于任一单项检测的效能(P<0.01),提示CAR和CD4+/CD8+水平联合检测的效能显著高于任一单项检测,对IM肝损伤患儿的病情和预后评估的价值较高,与国内外[19, 29]研究结果一致。
综上,血清CAR和CD4+/CD8+表达水平与IM肝损伤患儿的病情严重程度和疾病预后显著相关,联合检测的效能更高,在早期诊断、指导治疗和预后评估等方面的临床价值较高。当然,本研究还存在未能多中心分组、样本量相对较小和对治疗康复的动态性监测不够等不足之处,有待于今后日常工作研究中注重。
利益冲突声明:所有作者均声明不存在利益冲突。

