超声E成像及MR mDixon序列检查对非酒精性脂肪性肝病的诊断价值
钟献凤 陈桂娥 陈彦婵 黄健源
目前NAFLD患病率高达6.3%~45.0%,已成为全球慢性肝病的首要病因,其发病机制复杂,多重打击学说已取代经典二次打击学说,认为环境因素不利、炎症通路异常、遗传易感、免疫功能紊乱、胰岛素抵抗、肠道微生态失衡等均参与NAFLD疾病进展[1-4]。肝活组织检查虽是诊断该病的金标准,但手术费用高,且需在特定条件下进行,有一定风险,导致患者及家属接受度不高[5]。超声E成像是基于常规超声发展起来的一种无创实时二维弹性成像技术,可通过定量检测肝杨氏模量来评估肝组织硬度,通常肝杨氏模量越大表示肝组织越硬,鉴于NAFLD不同进展阶段肝组织硬度不尽相同,可采用超声E成像技术为NAFLD的诊断提供影像学依据,但关于肝杨氏模量诊断重度NAFLD的效能仍未明确[6]。有研究表明,相较于超声和计算机体层成像,MR mDixon序列检查对肝脏脂肪含量的量化评估更为精准,但关于其所测脂肪含量诊断重度NAFLD的效能仍缺乏高质量的临床研究[7-8]。
资料与方法
一、一般资料
选择广西医科大学第一附属医院NAFLD患者147例和健康体检者125例,纳入时间为2020年1月至2022年6月。147例患者均满足NAFLD诊断标准[9],其中轻度58例,中度59例,重度30例。排除标准:重要脏器功能障碍;自身免疫性肝病、病毒性肝炎、酒精性脂肪肝、炎症性肠病、肝豆状核变性、甲状腺功能减退症;传染性疾病;急慢性胃肠道疾病;急慢性肾病;恶性肿瘤;既往有酗酒史;近期接受过调节肝脏脂肪代谢药物治疗者;精神异常;孕妇。受试者签署知情同意书,本研究获院医学伦理委员会批准。
二、方法
使用彩色多普勒超声诊断仪(飞利浦,型号:EPIQ 5,探头频率1~6 MHz)。受试者平卧位,右上肢适当上抬,于右侧第4~7肋之间可清楚显示二维图像时启动超声E成像模式,将弹性成像取样框放置于右肝包膜下约1 cm的肝实质处,嘱受试者屏住呼吸3 s,若图像稳定且取样框内颜色超过90%则代表成功,通常一般检测区域直径约20 mm,完成检测后存储数据和图像。同一感兴趣区肝杨氏模量反复测量5次,取其平均值为最终结果。同时,采用西门子Avanto 1.5T A Tim+Dot system行MR mDixon序列检查,扫描前对受试者行屏气训练。受试者仰卧位,全肝mDixon序列容积扫描结束后以三平面定位图像调整mDixon序列扫描范围(自肝顶至肝下极范围),于一个屏气相内完成mDixon序列采集。结束后在肝门静脉主干和第二肝门下方两个层面处的肝右叶前部、右叶后部、左外叶各取一感兴趣区,避开胆管、血管与肝外结构,分别测量6个感兴趣区的脂肪含量,取其平均值为全肝脂肪含量。
全自动生化分析仪(AU2700型,日本Olympus公司)检测血生化指标(德国罗氏诊断有限公司)。
三、统计学方法
结 果
一、两组血生化指标比较
NAFLD患者AST、ALT、ALP和TBil高于健康人(P<0.05),见表1。
表1 两组血生化指标比较(±s)
二、不同病情严重程度NAFLD患者血生化指标比较
重度NAFLD患者AST、ALT、ALP和TBil高于中度NAFLD患者和轻度NAFLD患者(P<0.05),见表2。
表2 不同病情严重程度NAFLD患者血生化指标比较(±s)
三、两组肝杨氏模量和脂肪含量比较
NAFLD患者肝杨氏模量和脂肪含量高于健康人(P<0.05),见表3。NAFLD患者超声E成像表现见图1。

A:43岁男性NAFLD患者,超声E成像显示肝弹性平均值为5.68 kPa;B:60岁男性NAFLD患者,超声E成像显示肝弹性平均值为14.6 kPa
表3 两组肝杨氏模量和脂肪含量比较(±s)
四、不同病情严重程度NAFLD患者肝杨氏模量和脂肪含量比较
重度NAFLD患者肝杨氏模量和脂肪含量高于中度NAFLD患者和轻度NAFLD患者(P<0.05),见表4。
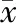
表4 不同病情严重程度NAFLD患者肝杨氏模量和脂肪含量比较(±s)
五、NAFLD病情严重程度与肝杨氏模量和脂肪含量的相关性
Spearman相关分析显示,NAFLD病情严重程度与肝杨氏模量和脂肪含量均呈正相关(r=0.680、0.526,均P<0.01)。
六、肝杨氏模量和脂肪含量诊断重度NAFLD的效能分析
分别绘制肝杨氏模量和脂肪含量单独或联合诊断重度NAFLD的ROC曲线,确定最佳截断点分别为6.460 KPa和6.100%。两者联合诊断的AUC为0.946,显著高于肝杨氏模量和脂肪含量单独诊断的0.867和0.849(P<0.05),见表5。

表5 肝杨氏模量和脂肪含量单独或联合诊断重度NAFLD的效能比较
讨 论
超声E成像技术即实时剪切波弹性成像技术,近年来已被广泛用于各种肝病诊断。朱宇莉等[10]报道,超声E成像技术获得的肝弹性值及脾弹性值可协助诊断临床显著门脉高压及严重门脉高压,评估乙型肝炎肝硬化门脉高压危险分级。Galina等[11]报道,超声E成像技术可评估自身免疫性肝病肝纤维化程度,尤其对≥F2期的诊断效能更为确切。Aksakal等[12]报道,超声E成像技术测得的杨氏模量值可预测慢性乙型肝炎患者肝纤维化分期。但现阶段关于超声E成像用于诊断NAFLD的研究仍不多,其所测肝杨氏模量诊断重度NAFLD的效能仍未明确。
本研究中,NAFLD患者AST、ALT、ALP和TBil高于健康人,且重度NAFLD患者AST、ALT、ALP和TBil高于中度和轻度NAFLD患者,与既往报道相符[13],提示NAFLD患者伴有肝功能损伤情况,其中重度患者肝功能损伤明显,推测与肝细胞脂肪变、炎症细胞浸润等有关。肝细胞内脂肪滴大量沉积,随着病情进展,逐渐发生肝脏炎性改变与纤维化,致使正常肝细胞逐渐减少,最终引起肝脏功能受损。本研究中,NAFLD患者肝杨氏模量高于健康人,且重度NAFLD患者肝杨氏模量高于中度和轻度NAFLD患者,病情严重程度与肝杨氏模量呈正相关,与既往报道相符[14]。肝杨氏模量诊断重度NAFLD的AUC为0.867,提示其诊断NAFLD患者病情严重程度具有较高的效能。通常肝脏组织弹性模量值由细胞内分子微细结构、胞质及细胞间隙内胶原蛋白含量决定,伴随着肝细胞损伤、凋亡与自噬的发生,肝内脂肪细胞逐渐发生变性、坏死,且纤维结缔组织增生,产生不可逆性肝纤维化,超声E成像技术可通过测量肝杨氏模量来反映肝组织弹性变化。随着病情进展,肝组织内脂肪细胞外基质大量沉积,胶原含量逐渐升高,致使肝组织逐渐变硬,肝杨氏模量逐渐增高。
MR mDixon技术作为一种影像学检查手段,可实现快速、简便测量肝脏脂肪含量目的,适用于屏气序列扫描,具有采集速度快等优势,与氢质子磁共振波谱成像的一致性较高[15]。马运婷等[16]报道,MR mDixon序列所测肝脏脂肪含量与NAFLD患者ALT、AST呈正相关,且与脂肪变性程度呈正相关。Choi等[17]报道,NAFLD患者MR mDixon序列检测的肝脏脂肪含量与超声E成像技术所测的肝杨氏模量呈正相关。本研究中,重度NAFLD患者肝脏脂肪含量高于中度及轻度NAFLD患者,且其病情严重程度与肝脏脂肪含量呈正相关,与既往报道相符[18],提示NAFLD严重程度与肝脏脂肪含量有关。ROC曲线分析结果显示,肝脏脂肪含量诊断重度NAFLD的AUC为0.849,提示其诊断NAFLD患者病情严重程度的效能较高。NAFLD以肝脏脂肪积聚等为主要特征,当肝内脂肪沉积过多时,可引起肝被膜膨胀、肝韧带牵拉等改变,致使NAFLD病情加重。
本研究中,两者联合诊断的AUC高于肝杨氏模量和脂肪含量单独诊断,证实两者联合对重度NAFLD具有良好的诊断效能。
综上所述,超声E成像和MR mDixon序列检查所测肝杨氏模量和脂肪含量在NAFLD诊断中具有重要的应用价值,两者联合对诊断NAFLD患者病情严重程度具有较高的效能。但本研究未分析肝杨氏模量与脂肪含量的相关性,有待于今后进一步研究。
利益冲突声明:所有作者均声明不存在利益冲突。

