戊型肝炎病毒感染对慢性丙型肝炎患者病情严重程度的影响
刘皇村 李优磊 刘永成
戊型肝炎病毒(HEV)是一种流行率可变的单链RNA病毒,包括4种基因型,其中HEV基因型1、2型常引起急性和流行性疾病,主要通过粪便-口腔传播或来自污染的水或食物,而基因型3和4型通常是通过人畜共患病、食用生的或未煮熟的猪肉或食用野生动物肉来传播的[1-3]。先前的研究表明,HCV感染患者会因合并感染HAV或HBV而加重肝脏损伤[4-6]。目前很少有研究评估HEV感染对慢性丙型肝炎(CHC)患者的影响[7-8]。本次研究旨在评估CHC患者中HEV感染的患病率及其对肝纤维化严重程度的影响。
资料与方法
一、研究对象
收集2016年1月—2021年10月广西壮族自治区南溪山医院收治的CHC患者184例,其中男性86例、女性98例,年龄60(31, 80)岁。依据CHC患者是否合并感染HEV分为单纯CHC组、合并HEV组。排除标准:①既往接受抗HCV治疗;②除HCV、HEV外其他嗜肝细胞病毒感染;③合并其他慢性肝病(酒精性肝损伤和非酒精性脂肪性肝病);④接受肾移植手术;⑤接受免疫抑制治疗。
二、研究方法
收集记录患者资料,包括血常规、生化指标、凝血指标以及透明质酸(HA)、Ⅲ型前胶原氨基端肽(PⅢNP)、Ⅳ型胶原(C-Ⅳ)及层黏连蛋白(LN)。使用化学发光法检测抗HEV-IgM、抗HEV-IgG(安图生物技术有限公司)。
三、统计学分析
应用IBM SPSS Statistics 24.0软件行统计学分析。根据资料类型,采用Mann-WhitneyU检验或卡方检验作比较。P<0.05为差异有统计学意义。
结 果
一、一般资料
CHC患者中22例(11.9%)检测为抗HEV-IgG阳性,3例(1.6%)检测为抗HEV-IgM阳性,另有1例(0.5%)检测为抗HEV-IgM、抗HEV-IgG均为阳性,HEV感染率为14.1%(26/184)。单纯CHC组(n=158)、合并HEV组(n=26)比较,年龄、糖尿病、PLT、ALT及TBil差异具有统计学意义(P<0.05),见表1。
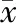
表1 单纯CHC组、合并HEV组一般资料[(±s), %]比较
二、血清肝纤维化指标
比较两组血清肝纤维化指标,与单纯CHC组比,合并HEV组HA、PⅢNP、C-Ⅳ及LN均显著上升(P<0.05,见表2)。

表2 单纯CHC组、合并HEV组血清肝纤维化指标比较
三、临床转归
如表3所述,与单纯CHC组比,合并HEV组黄疸持续时间、病程持续时间均显著延长,差异有统计学意义(P<0.05),而两组ALT恢复时间差异不具有统计学意义(P>0.05)。
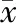
表3 单纯CHC组、合并HEV组临床转归(±s)比较
讨 论
本研究显示,HEV在CHC患者中的感染率为14.1%。先前的研究报道了类似结果[9]。Bricks等[10]报道,慢性HCV感染患者中HEV血清阳性率为10.2%,不过该研究中37.4%的患者既往接受了抗病毒治疗,由于聚乙二醇干扰素、利巴韦林或其他抗病毒药物可以消除HEV,因此这也导致了HEV患病率被低估。
HEV阳性CHC患者的年龄是显著高于HEV阴性者的,这与Kyvernitakis 等研究结果相似[7]。HCV感染可以诱导胰岛素信号变化,导致胰岛素释放受阻,从而阻止其在体内葡萄糖代谢的调节,即HCV感染可以间接引起胰岛素抵抗[10-12]。我们发现血清HEV阳性与糖尿病存在关联,相较于单纯CHC组,HEV组患者糖尿病比例显著升高。Bricks等[13]研究表明,HCV感染可能会增加患有糖尿病的几率,更甚的是,HEV阳性CHC患者合并存在糖尿病的风险也会进一步增加。
本研究比较了单纯CHC组、HEV组血清肝纤维化指标、临床转归结果。与HEV阴性病例比较,HEV阳性患者各项血清肝纤维化指标均显著增加,说明HEV感染可能影响肝脏疾病的严重程度。Wallace等[14]回顾分析了511例HEV感染患者临床资料,发现其中11.3%(n=58)存在肝硬化、21.5%(n=110)患有糖尿病,研究还记录到17例(3.3%)死亡病例,并分析出以下因素与死亡率明显相关:血液恶性肿瘤、肝硬化、TBil异常升高及慢性HEV感染(P<0.05)。除此之外,研究还报道511例HEV患者中35例(6.7%)出现急性肝炎、慢加急性肝衰竭或肝硬化急性失代偿,并且其中2例还需要肝移植治疗。Zhang等[15]发现相比于HBV+HAV重叠感染者,慢性HBV和HEV重叠感染患者并发症、肝功能衰竭的发生更为常见,同时他们的总体死亡率也显著上升。
总之,HCV感染患者中HEV血清阳性率较高,同时肝纤维化程度更高、临床转归更差。HEV筛查应当在HCV感染患者中常规开展。
利益冲突声明:所有作者均声明不存在利益冲突。

