氨氮对牛粪厌氧消化中四环素类抗性基因丰度及其驱动因子的影响
王秀君,朱文博,朱天娇,张秋萍,庞小可,许继飞*
(1.内蒙古大学生态与环境学院,呼和浩特 010021;2.内蒙古自治区环境污染控制与废物资源化重点实验室,呼和浩特 010021;3.山西师范大学生命科学学院,太原 030031;4.南开大学环境科学与工程学院,天津 300350)
畜禽粪便作为抗生素抗性基因(Antibiotic resis⁃tance genes,ARGs)的储存池已成为当下的研究热点[1]。四 环 素类ARGs(Tetracycline resistance genes,TRGs)在畜禽粪便中频频检出,为粪源ARGs 的主要门类[2-3]。同时,畜禽粪便也是一种应用价值高且常见的农业有机肥料[4]。由此,粪源ARGs 可能会随着畜禽粪便应用和养殖废水排放进入土壤、水体等自然环境,并经食物链传递等途径进入植物、动物体中,进而对生态环境和人体健康造成潜在威胁。
厌氧消化是粪便资源化的常用方式之一,可对粪源ARGs 在环境中的传播和扩散起控制作用[5]。作为消化基质,畜禽粪便的理化性质将影响厌氧消化对粪源ARGs 的作用效果,其中,氨氮可为ARGs 宿主微生物提供氮源,也可作为厌氧消化系统的缓冲剂,增强消化系统稳定性,然而,氨氮浓度高会抑制微生物的生命活动,进而导致消化失败[6]。朱文博等[7]的研究表明氨氮浓度对厌氧消化中粪源ARGs 的相对丰度变化有显著影响。Zhang 等[8]的研究发现猪粪中的ARGs经中温厌氧消化后的总相对丰度随粪便中氨氮浓度的升高而升高,且ARGs 发生水平基因转移的概率也随之增加。对于养殖场中的畜禽粪便,其氨氮浓度可能会随着养殖单元、养殖规模和清粪方式的不同而有差异。美英等[9]研究发现从产奶牛舍和待产牛舍收集的粪便中氨氮浓度高于其他养殖单元,且大规模养殖场的氨氮浓度高于中小规模养殖场。此外,高温会促进畜禽粪便中氨氮的释放,夏季奶牛粪便中氨氮浓度高于冬季。于厌氧消化而言,高温厌氧消化较中温厌氧消化更有利于减少ARGs 的丰度[10-11],然而,畜禽粪便中氨氮浓度对高温厌氧消化中粪源ARGs丰度变化及其驱动因子的影响尚有待阐明。
本研究以TRGs为目的基因,以牛粪为消化基质,并外源添加尿素以形成牛粪氨氮浓度梯度;在确保高温厌氧消化可运行的情况下,探究氨氮浓度对牛粪高温厌氧消化系统中TRGs丰度变化的影响,分析TRGs、可移动遗传元件(Mobile genetic elements,MGEs)和微生物群落结构的相关性以揭示TRGs丰度变化的驱动因子,以期进一步加深对畜禽粪便理化性质与厌氧消化工艺削减ARGs效果相互作用关系的理解。
1 材料与方法
1.1 试验材料与设计
本试验利用无菌聚乙烯塑料瓶于内蒙古呼和浩特某规模化奶牛养殖场采集新鲜牛粪(记为U0),4 ℃保存运回实验室。牛粪理化性质于48 h内测定,其余样品于-80 ℃保存。新鲜牛粪初始理化性质:可溶性COD(SCOD)浓度为7 575.00 mg·L-1;氨氮浓度为595.30 mg·L-1;pH 为6.08;总挥发酸(TVFAs)浓度为3 092.47 mg·L-1。为避免引入其他化学元素,采用尿素(CH4N2O)为外源添加物调节牛粪中氨氮浓度,并以牛粪和尿素的混合物作为厌氧消化基质。一般认为,当厌氧消化中的氨氮浓度超过1 500 mg·L-1时会对厌氧消化产生不利影响[12],基于此,本试验消化基质中氨氮浓度最终设定为600、1 100 mg·L-1和1 600 mg·L-1,记为U1、U2 和U3。选用500 mL 厌氧培养瓶为厌氧消化反应器。培养瓶内添加400 mL 新鲜牛粪和尿素混合物后通氮气5~8 min。发酵浓度为8%。以未检出ARGs 的厌氧微生物菌剂(广州微生源,中国)为接种物,接种率为0.1%(m/m)。利用水浴法保证反应温度为(55±1)℃,每组处理设置3个重复。
1.2 样品采集与理化性质测定
采用排水法收集气体,并每日记录日产气量。当日产气量小于5%反应体积(25 mL·d-1)时,视作厌氧消化反应终点。在反应前、反应第6 天、第16 天、第28 天和第45 天(反应结束)时采集样品。将1 mL 样品收集于离心管内,12 000 r·min-1离心5 min,上清液用于理化性质测定,沉淀物于-80 ℃保存,用于TRGs、MGEs 和16S rRNA 的定量分析以及微生物群落分析。
沼气成分采用沼气分析仪(MRU Optima7,德国)分析测定;SCOD 采用重铬酸钾法测定;氨氮采用纳氏试剂光度法测定;pH 值采用pH 计(PHS-3E,上海雷磁)测定;TVFAs采用酸性氯化铁比色法测定;碱度采用滴定法测定。
1.3 ARGs与MGEs定量分析
基因组DNA 的提取:采用粪便基因组DNA 提取试剂盒(天根DP-328,北京)提取每毫升样品沉淀物中的DNA,详细步骤参见试剂盒说明书。所提取的DNA 用超微量紫外分光光度计(Nanodrop-2000,美国)检测其含量和纯度(A260/280为1.7~2.0)。
实时荧光定量PCR(qPCR):通过普通PCR 仪(ABI 9902,美国)检测样品中的TRGs 和MGEs,目的基因为编码外排泵基因(tetA、tetC、tetG),编码核糖体保护蛋白基因(tetO、tetQ、tetT),转座酶修饰基因(tetX)以及MGEs(intI1,intI2和Tn916/1545)。采用荧光定量系统(Bio-Rad CFX96,美国)对上述目的基因进行定量分析,qPCR 所用引物序列、退火温度和反应程序等详见文献[10,13]。
1.4 高通量测序与微生物群落结构分析
委托上海派森诺生物公司利用Illumina Novaseq平台进行16S rRNA 高通量测序。测序区域为V3~V4区,引 物 为338F(ACTCCTACGGCAGGCAGCA)和806R(GGACTACHVGGGTWTCTAAT)。基于测序获得的原始序列经Qiime 2 平台中的dada 2 软件质控去噪获得扩增子序列变异(Amplicon sequence variants,ASVs),将代表序列ASV 与SILVA 16S rRNA 数据库进行比对,使用Naïve Bayes 分类器对物种进行注释,获得每个分类水平下的物种丰度信息。
1.5 数据分析
采用Microsoft Excel 软件整理原始试验数据;利用SPSS 22.0 进行单因素方差分析及Pearson 相关性分析;采用Origin Pro 9.0 绘制柱状图和折线图;采用R3.5.3绘制热图。
2 结果与讨论
2.1 氨氮浓度对牛粪厌氧消化性能的影响
图1 为不同氨氮浓度下牛粪高温厌氧消化产气速率和氨氮累积情况。当氨氮浓度为600 mg·L-1和1 100 mg·L-1时,厌氧消化分别在第4天和第5天达到产气峰值,最大产气速率分别为933 mL·d-1和800 mL·d-1,总产气量分别为8 036 mL 和7 696 mL。虽然氨氮浓度为1 100 mg·L-1的厌氧消化较600 mg·L-1的厌氧消化在产气性能方面略有降低,但未表现出显著差异(P>0.05)。然而,当氨氮浓度升高至1 600 mg·L-1时,厌氧消化的产气峰值推迟至第12天,其最大产气速率(280 mL·d-1)与其余两试验组相比分别下降了70%和65%,且其总气量(4 773 mL)较另两组厌氧消化也分别下降了40%和38%,这可能是因为牛粪中较高的氨氮浓度及其后续累积对系统中的产甲烷菌活性造成了不良影响,进而影响了厌氧消化性能[14]。各试验组的产气速率均在第30 天趋于稳定,并于第44 天结束。消化结束时,600、1 100 mg·L-1和1 600 mg·L-1处理的氨氮浓度分别累积至790、1 428 mg·L-1和2 201 mg·L-1(图1b)。
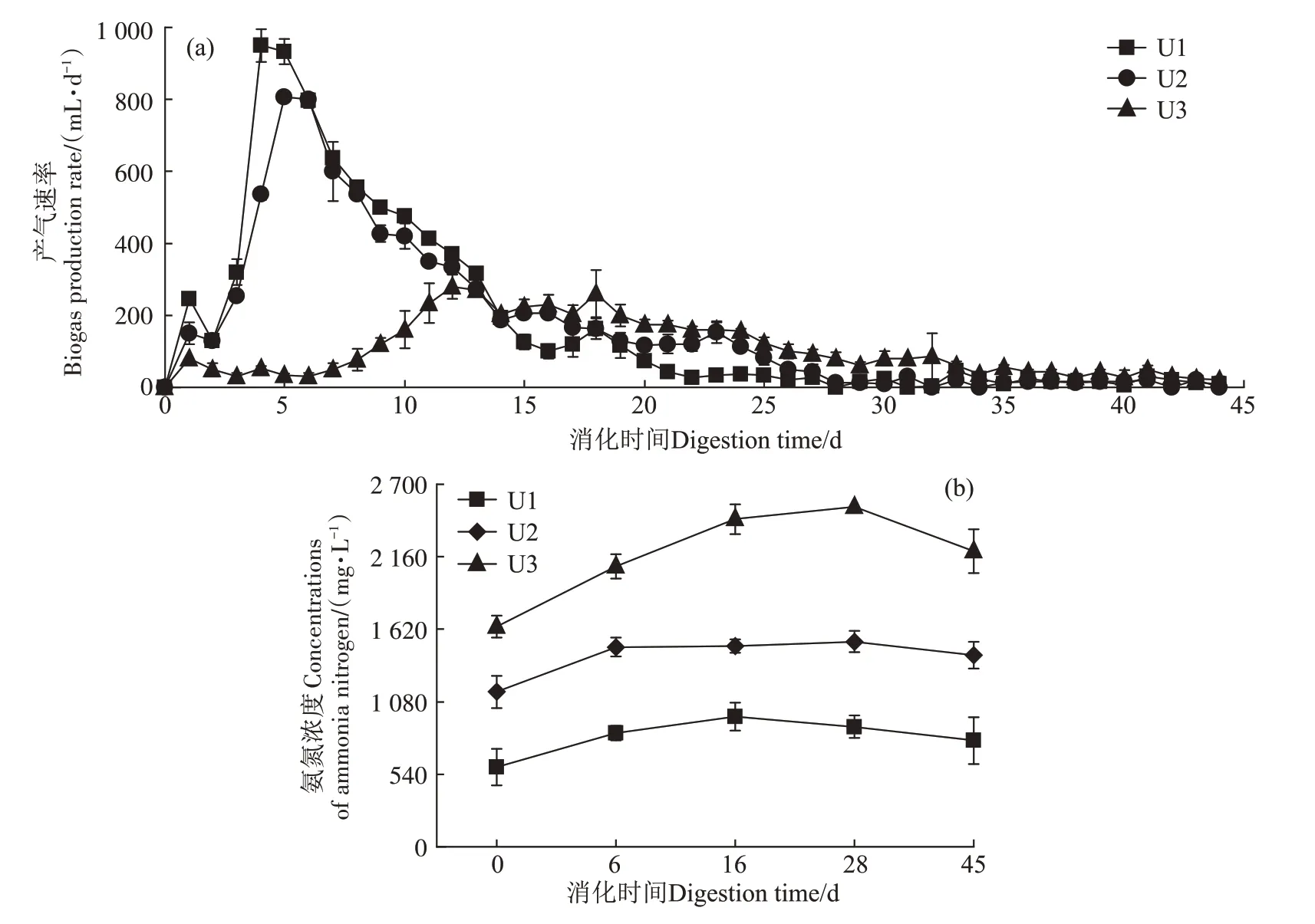
图1 牛粪高温厌氧消化过程中日产气速率和氨氮累积情况Figure 1 Biogas production rate and the concentration of ammonia during thermophilic anaerobic digestion based on diary manure
2.2 氨氮浓度对TRGs绝对丰度的影响
图2 为TRGs 的绝对丰度在厌氧消化中的变化。如图2a 所示,7 种目的基因均在牛粪中检测出,包括tetA、tetC、tetG、tetO、tetQ、tetT 和tetX,总绝对丰度为5.02×109copies·mL-1。tetQ的绝对丰度在7种目的基因中占比最大,为53%。这可能与多数tetQ 潜在宿主菌能够在常温环境下存活有关[15]。消化过程中,不同氨氮浓度条件下TRGs的总绝对丰度均随消化反应的进行先下降后升高,但氨氮浓度为600 mg·L-1的拐点发生在消化晚期(第28~45 天),而氨氮浓度为1 100 mg·L-1和1 600 mg·L-1的拐点发生在消化初期(第6~16 天),且1 600 mg·L-1的反应体系中TRGs 总绝对丰度始终高于600 mg·L-1和1 100 mg·L-1的反应体系(P<0.05)。这可能与在较高氨氮浓度(1 600 mg·L-1)的厌氧消化体系中微生物的停滞期延长有关[16]。各TRG 在氨氮浓度为600 mg·L-1和1 100 mg·L-1的消化过程中均被削减,但tetA和tetG却在氨氮浓度为1 600 mg·L-1的消化过程中大量增加。消化结束后,TRGs的总绝对丰度在氨氮浓度为1 600 mg·L-1条件下最高,为1.70×109copies·mL-1;在氨氮浓度为600 mg·L-1和1 100 mg·L-1条件下TRGs 的总绝对丰度接近,分别为4.56×108copies·mL-1和4.6×108copies·mL-1。箱线图中的中位数可表示TRGs绝对丰度在厌氧消化后的平均水平(图2b)。在氨氮浓度为1 600 mg·L-1时,厌氧消化后TRGs 的平均水平最高,为7.50 logs,该水平与氨氮浓度为1 100 mg·L-1的试验组接近(7.36 logs),当氨氮浓度为600 mg·L-1时,厌氧消化后TRGs 的平均水平最低,为6.67 logs,该结果表明高氨氮浓度的厌氧消化削减的TRGs 较少(P<0.05)。此外,对各TRG 在不同条件下厌氧消化后的绝对丰度进行对比可知,tetA、tetG、tetQ、tetT 和tetX 的绝对丰度在氨氮浓度为1 600 mg·L-1的条件下最高,特别是te⁃tA 和tetG,这两个基因经此条件下的厌氧消化后变为消化前的1.05 倍和1.85 倍。TetO 的绝对丰度在氨氮浓度为1 100 mg·L-1的条件下最高。仅tetC 的绝对丰度在氨氮浓度为600 mg·L-1的条件下最高,但其绝对丰度在数值上与其他条件下的结果无显著差异(P>0.05)。
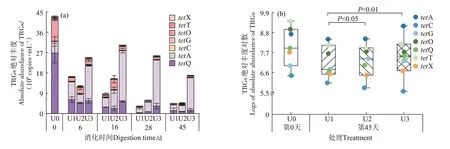
图2 牛粪厌氧消化过程中不同时间和不同处理的TRGs绝对丰度Figure 2 Absolute abundance of TRGs during anaerobic digestion based on diary manure
2.3 氨氮浓度对MGEs绝对丰度的影响
MGEs 是ARGs 在不同微生物之间转移的重要媒介,对ARGs 在环境中的扩散起重要作用,因此,检控其在厌氧消化中的绝对丰度变化十分重要。如图3a所示,在牛粪原料中,目的MGEs(intI1、intI2和Tn916/1545)均存在,其总绝对丰度为1.46×108copies·mL-1,其中Tn916/1545 的占比最高,为66%。随着消化反应的进行,MGEs 的总绝对丰度均先升高后下降。消化过程中,氨氮浓度为1 600 mg·L-1的试验组中MGEs 的总绝对丰度始终显著高于其他两试验组。消化结束时,氨氮浓度为600、1 100 mg·L-1和1 600 mg·L-1条件下的总绝对丰度分别为3.40×107、2.26×107copies·mL-1和6.01×108copies·mL-1。图3b 为各MGEs 绝对丰度在厌氧消化前后的倍数变化值(值大于1表示基因增加,小于1表示基因减少)。氨氮浓度为1 100 mg·L-1和600 mg·L-1的厌氧消化反应体系中各MGE 及其总绝对丰度均表现为削减,而氨氮浓度为1 600 mg·L-1的条件下MGEs 的总绝对丰度在消化后增加了4.11 倍,这是因为在该条件下intI1 和intI2较厌氧消化前分别增加了10.55 倍和11.85 倍(图3b)。整合子(intI1 和intI2)被认为是ARGs 发生水平转移的关键因子[17-18]。上述结果表明牛粪厌氧消化中氨氮浓度高时MGEs 将增加,由此TRGs 在不同微生物之间转移风险也将升高。
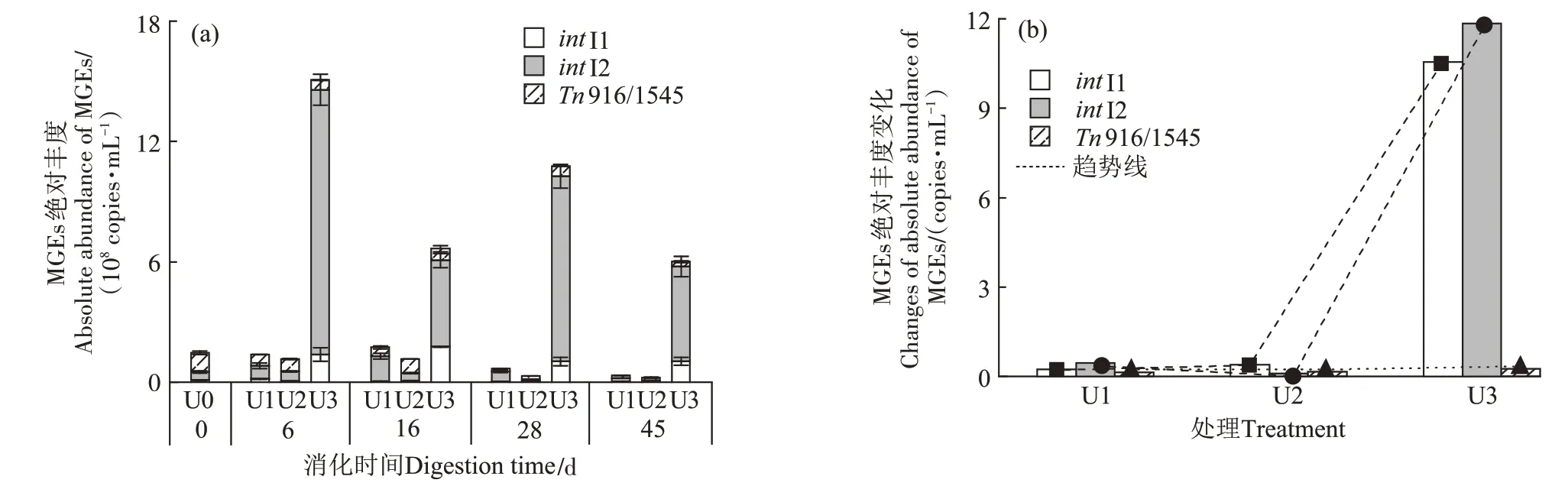
图3 厌氧消化过程中MGEs绝对丰度及其变化Figure 3 Absolute abundance of MGEs and their changes during anaerobic digestion based on diary manure
2.4 微生物群落结构变化
微生物是ARGs 丰度变化的主要驱动因子[19],其可能造成不同氨氮浓度条件下厌氧消化中TRGs绝对丰度变化差异。图4 为厌氧消化过程中门水平微生物群落结构变化。在牛粪原料中,Bacteroidetes 为优势菌门,占比为34%,其次为Firmicutes和Proteobacte⁃ria,占比分别为32%和17%。消化过程中,不同处理中的优势菌门发生改变。在消化初期(第6 天),氨氮浓度为600 mg·L-1和1 100 mg·L-1的厌氧消化系统中Firmicutes 变为第一优势菌门,占比高达71%和80%,而在氨氮浓度为1 600 mg·L-1的条件下消化系统中第一优势菌门为Proteobacteria(51%),Firmicutes 仅占34%。随着消化反应的进行,Firmicutes 的占比逐渐增大并变为第一优势菌门,Bacteroidetes 逐渐消失。这与Firmicutes 对氨氮浓度的耐受性高而Bacteroide⁃tes 的生长会受到氨氮浓度的抑制有关[20]。不同处理间微生物群落结构的差异主要由第二优势菌门造成。消化结束时,氨氮浓度为600 mg·L-1的系统中次要优势菌门为Spirochaetes,而氨氮浓度为1 600 mg·L-1的系统中次要优势菌门为Proteobacteria。研究表明Fir⁃micutes 对厌氧消化中纤维素的分解起关键作用,其优势地位也反映出氨氮浓度较高时反应体系中乙酸的积累[21]。Spirochaetes 多出现在底物匮乏的厌氧消化器中,能够发酵葡萄糖为乙酸、乙醇等[22],而Proteo⁃bacteria 多为寡营养厌氧菌,其在有机质较少的环境中易生存[7]。Wang 等[23]的研究表明上述菌门均为ARGs 的常见潜在宿主菌门,其丰度的差异可能是不同氨氮水平下TRGs绝对丰度差异的原因。
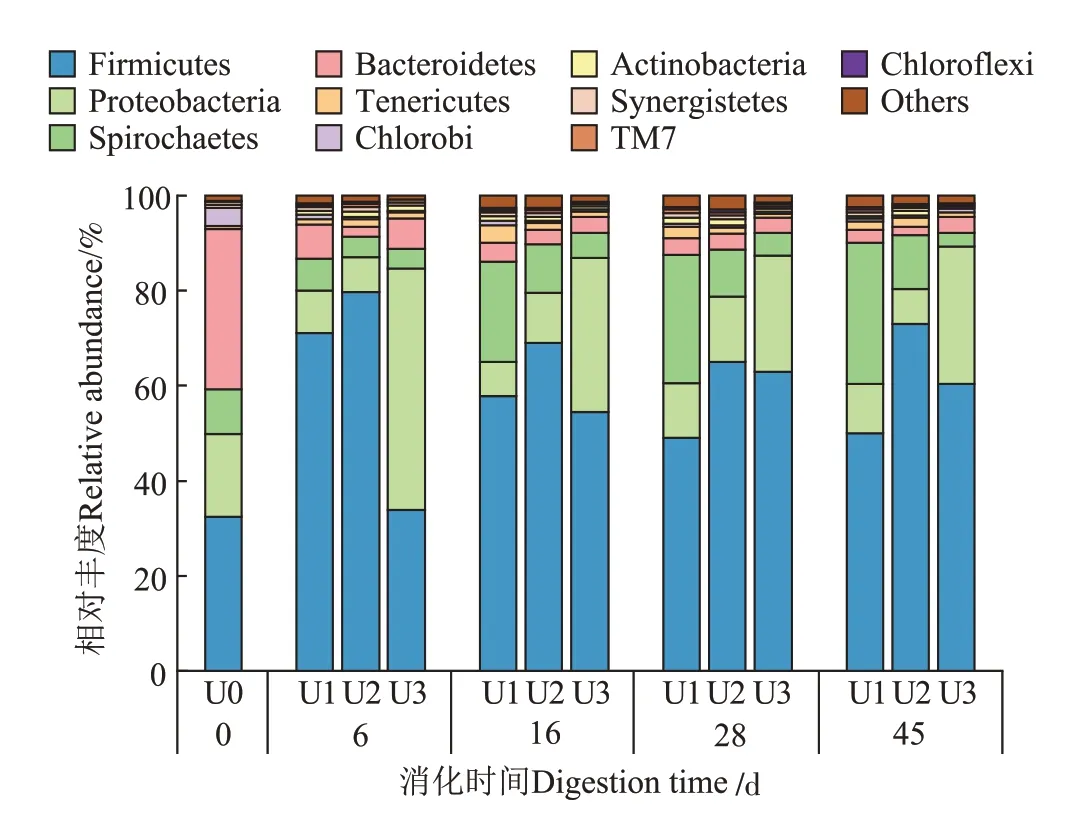
图4 厌氧消化过程中门水平细菌群落结构Figure 4 Relative abundances of bacterial community at the phylum level during anaerobic digestion
图5 为厌氧消化过程中属水平微生物(前50)的相对丰度变化,其中按行(样本)对数据进行标准化。经厌氧消化后,属水平微生物变化较为明显。一些菌属经厌氧消化后相对丰度显著降低甚至被消灭,如Acinetobacter、Coprococcus和Clostridium等,而一些菌属经厌氧消化后相对丰度显著增加,如Syntrophomon⁃as、Ruminococcus和Treponema等。不同氨氮浓度条件下厌氧消化体系中属水平微生物差异也较为明显。消化初期(第6 天),Comamonas、Pusillimonas和Sedi⁃mentibacter的相对丰度随氨氮浓度的升高而降低,而unidentified_Desulfovibrionaceae、 unidentified_MBA08
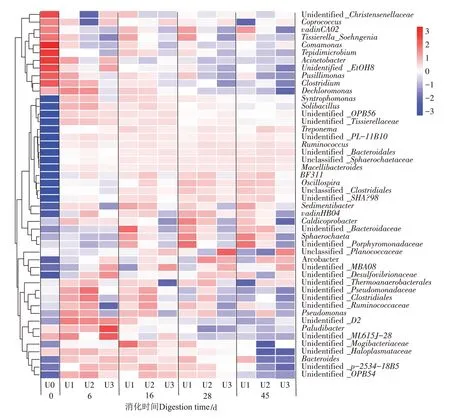
图5 厌氧消化过程中属水平细菌物种丰度Figure 5 Relative abundances of bacteria the genus level during anaerobic digestion
和Pusillimonas的相对丰度则呈相反趋势,且unidenti⁃fied_Pseudomonadaceae和unidentified_Thermoanaero⁃bacterales在氨氮浓度为1 100 mg·L-1的体系中最高。随着消化反应的进行,同一阶段不同处理的优势菌属均不同,表明微生物的群落结构受到了氨氮浓度的影响。消化结束时,unclassified_Planococcaceae、uniden⁃tified_MBA08和Arcobacter为氨氮浓度1 600 mg·L-1条件下的优势菌属,而unidentified_Bacteroidales和BF311为氨氮浓度1 100 mg·L-1条件下的优势菌属,unidentified_Porphyromonadaceae和Sphaerochaeta为氨氮浓度600 mg·L-1条件下的优势菌属。上述结果表明,不论消化过程中还是消化结束时,不同牛粪氨氮浓度条件下厌氧消化体系中的属水平微生物均存在差异。当这些微生物携带TRGs 时,势必会在一定程度上造成TRGs的丰度差异。由此,微生物与TRGs的关系需进一步分析。
2.5 TRGs、MGEs和微生物的相关性分析
在厌氧消化体系中ARGs 可通过垂直基因转移(Vertical gene transfer,VGT)和水平基因转移(Hori⁃zontal gene transfer,HGT)两种方式在微生物间传播,其中,HGT 是ARGs 在环境中被获得和传播的主要途径,具有更大环境危害性[24]。为考察不同氨氮浓度条件下TRGs 绝对丰度变化的驱动因子,对TRGs 与MGEs和属水平微生物进行相关性分析(图6)。TRGs与微生物之间的相关性分析可识别TRGs的潜在宿主菌。潜在宿主菌的相对丰度变化可在一定程度解释TRGs的丰度变化[25]。如图6 所示,tetO、tetQ、tetT 和tetX 拥有较多的潜在宿主,且多为共同宿主菌,如Clostridium、Comamonas和Coprococcus等。这些潜在宿主菌的相对丰度随着氨氮浓度的升高而降低(图5),与上述TRGs经不同氨氮浓度条件的厌氧消化之后绝对丰度的表现一致。tetC 与其潜在宿主菌也具有类似关系。tetA 和tetG 拥有的潜在宿主较少。不同氨氮浓度厌氧消化体系中tetA 和tetG 的潜在宿主菌的分布情况也有较明显差异。tetA 的潜在宿主菌主要存在于氨氮浓度为600 mg·L-1的反应体系中,而tetG 的潜在宿主菌则主要分布在氨氮浓度为1 100 mg·L-1的反应体系中。tetA 和tetG 的大部分潜在宿主菌在氨氮浓度600 mg·L-1条件下的相对丰度较高,在氨氮浓度为1 600 mg·L-1的反应体系中较少,如Paludibacter和Bacteroides,这与厌氧消化后tetA 和tetG 的绝对丰度变化矛盾。对MGEs 和TRGs 进行相关性分析可知,在氨氮浓度为1 600 mg·L-1的反应体系中,tetA 与intI1呈显著正相关(P<0.05),而tetG与intI2呈显著正相关(P<0.05),表明tetA 和tetG 的增加与intI1 和intI2 的增加有关。这可能是因为牛粪中较高的氨氮浓度对微生物的DNA 造成了损伤,引发了微生物的SOS 反应,因此,在形成质粒的过程中整合子及其上的TRGs 也被快速复制[26-27]。上述结果表明潜在宿主菌的相对丰度变化可在一定程度上解释TRGs 绝对丰度的变化,但氨氮浓度为1 600 mg·L-1的牛粪厌氧消化反应体系中部分TRGs 可能主要以HGT 途径增加,不利于通过厌氧消化方式控制TRGs 在环境中的传播。
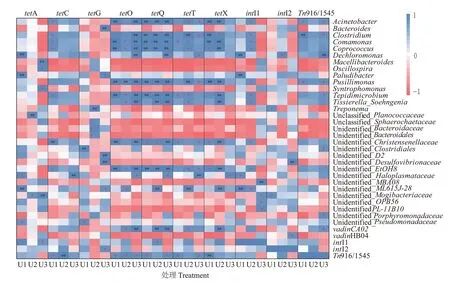
图6 TRGs、MGEs和属水平微生物的相关性分析Figure 6 Correlation analysis among TRGs,MGEs and bacterial community the genus level
3 结论
(1)氨氮浓度为1 600 mg·L-1时,tetA 和tetG 的绝对丰度在牛粪高温厌氧消化后增加。不同氨氮浓度条件下,tetC、tetO、tetQ、tetT 和tetX 的绝对丰度在消化后均减少。
(2)不同氨氮浓度条件下牛粪厌氧消化后体系中的第一优势菌门均为Firmicutes。氨氮浓度为1 600 mg·L-1条件下消化后体系中的第二优势菌门为Proteobac⁃teria,而氨氮浓度为1 100 mg·L-1和600 mg·L-1条件下消化后体系中的第二优势菌门为Spirochaetes。
(3)四环素类抗生素抗性基因(TRGs)潜在宿主菌的种类和数目差异可在一定程度上解释TRGs在消化过程中绝对丰度的变化。相关性分析表明,在氨氮浓度为1 600 mg·L-1的厌氧消化反应中tetA 和tetG 的增加主要与intI1 和intI2 的增加有关,说明利用含有较高氨氮浓度的牛粪进行厌氧消化时,TRGs 进行水平基因转移的可能性较大,TRGs 在环境中进一步扩散的风险较高。

