臭氧污染和EDU喷施对小麦叶际细菌群落的影响
苏熠,程诚,王琪,刘园园,徐彦森,冯兆忠
(南京信息工程大学应用气象学院,南京 210044)
植物的地上部分被大量微生物定殖,Partida-Martínez 等[1]认为不存在没有微生物的植物。据Vorholt[2]估计,全球叶表面积约6.4×108km2,能定殖1×1026个细菌细胞,每平方米约1×1016~1×1018个细菌细胞,数量远超植物本身细胞数量。已有的研究表明,植物叶际细菌群落对植物生长与健康及生态系统功能有重要作用。这些细菌能通过产生吲哚乙酸、铁载体等促生物质来促进植物对养分的吸收,提高植物生物量;通过产生抗氧化酶、抗生素等物质来抑制病原菌对植物的侵袭,提高植物对多种环境胁迫的适应性;甚至部分细菌还具有降解污染物的功能[3-5]。
臭氧(O3)作为最具植物毒性的空气污染物之一,其环境效应已经成为公众密切关注的问题。尽管1995—2014 年间欧洲和北美洲的大部分地区地表O3浓度有所下降,但是近年来东亚地区地表O3浓度仍呈现出普遍上升趋势,尤其是中国和印度[6-7]。O3浓度升高会对植物造成一系列损害,包括叶片肉眼可见受损、光合作用受抑制、产量和品质下降等[8-9],O3已成为全球作物生产和食品安全的主要威胁之一[10]。小麦较其他农作物对O3浓度升高更为敏感[11]。2010—2012 年间O3污染对印度和中国的小麦产量影响最严重,印度北部和中国西北部的大片地区产量损失超过15%[12]。Feng等[11]基于最新的O3剂量反应规律,发现O3污染使中国小麦产量下降了28.2%~36.9%。长三角作为农作物主产区之一,也是我国O3主要污染区之一。2014—2019 年间O3浓度升高致使该区域冬小麦年减产20.4%,年经济损失约7亿美元[13]。
O3主要通过引起氧化应激反应对农作物产生损害[14];植物通过气孔将O3吸收到质外体内后,O3迅速降解并产生活性氧,进而干扰各种生理和酶促过程[15]。迄今,科研工作者已从生理、产量与品质等方面系统研究了O3浓度升高对小麦的影响[16],但是鲜有研究关注O3浓度升高对小麦叶际微生物群落的影响。
亚乙基二脲(N-[2-(2-氧代-1-咪唑烷基)乙基]-N'-苯基脲,EDU)作为一种抗O3剂被广泛用于评价O3浓度升高对植被的影响[17]和筛选O3抗性品种[18-19]。EDU 常以叶面喷施、茎秆注射或土壤淋湿的方式施用于植物,其能有效增加植物光合色素含量、提高光合能力、改变抗氧化酶活性和抗氧化剂的浓度[20-24]。基于Meta 分析,Feng 等[25]发现,与对照相比,EDU 使O3引起的小麦叶片可见损伤降低76%,光合速率提高8%,地上生物量和小麦产量分别提高7%和15%。尽管大量研究表明EDU 可以保护植物免受O3伤害并抑制植物过早衰老,但其保护机制尚不清楚[26]。目前关于EDU 的作用机制主要包括:(1)可能通过降低气孔导度来降低O3气孔吸收通量[27];(2)通过增加酶促或非酶促抗氧化剂去除叶片活性氧[20];(3)作为氮肥[28];(4)作为异生物质,破坏激素稳态[26]。然而EDU 对农作物叶际微生物群落的调控研究尚未见报道。
植物根系微生物组相关研究表明植物会召集“胁迫微生物”来应对各种生物和非生物胁迫,且这种选择性的富集受植物代谢和免疫相关性状的差异驱动[29-30]。以上发现表明小麦也可能通过召集叶际“胁迫微生物”来应对O3胁迫。本研究利用完全开放式O3熏蒸系统(O3-FACE)对长三角地区广泛种植的小麦品种(农麦88)进行O3熏蒸,同时配以EDU 叶面喷施处理,于灌浆后期采集小麦叶片样品,利用细菌16S rRNA 基因高通量测序技术解析O3浓度升高和EDU 喷施处理对小麦叶际细菌群落结构与多样性的影响。本研究假设:(1)O3熏蒸会改变小麦叶际细菌群落alpha和beta多样性;(2)叶面喷施EDU也改变了叶际细菌群落alpha 和beta 多样性,且提高叶际有益菌群丰度可能是其增强小麦O3耐受性的作用方式。预期结果能进一步丰富小麦适应O3浓度升高及EDU缓解小麦O3胁迫的作用机理。
1 材料与方法
1.1 试验区概况
本试验于2020年11月至2021年5月在江苏省扬州市江都区的南京信息工程大学扬州绿色农业研究与示范基地(32°44'N,119°25'E)开展,该试验区地处长江中下游平原,属于典型的亚热带湿润气候。2020 年,该地区年均气温和年均降水总量分别为16.6 ℃和1 337.8 mm,年日照时数为1 455.4 h。该地区长期实行稻麦轮作,属于典型的农田生态系统[31]。0~15 cm 根层土壤的基本理化性质为pH 6.8、有机质2.06%、总氮1.1 g·kg-1、速效钾61 mg·kg-1、有效态磷30 mg·kg-1。
1.2 试验设计
试验以农麦88 作为供试植物,于2020 年11 月播种,2021年3月1日开始利用O3-FACE 进行两个O3浓度的熏蒸处理,包括环境O3浓度(浓度约为40.9 mg·L-1·h-1,A 处理)和1.5 倍环境O3浓度[浓度为(59.9±2.5)mg·L-1·h-1,E 处理],每个O3浓度设置4 个FACE圈重复,每个FACE 圈为直径14 m 的正八边形,各圈之间间隔大于50 m,以避免相互干扰。O3发生器(HY003,济南创成科技有限公司)产生的O3与空气混合后通过置于冠层上方的布气管释放到FACE 圈内,并利用自动化控制中心对FACE 圈内O3浓度进行实时检测,确保FACE 圈内O3浓度维持在正常范围内。晴朗天气每日熏蒸10 h(8:00—18:00),阴雨天则停止熏蒸,实际熏蒸49 d,O3浓度控制偏差率基本在15%以内(图1)。每个FACE圈设有3 m×3 m的亚区,熏蒸10 d 后开始对小麦进行叶面喷施450 mg·L-1EDU[32],以浇等量的水作为对照(水)处理,在喷施时,每株小麦的叶片能挂住溶液即可。每隔10 d 叶面喷施EDU溶液一次,如果喷施后的第二天遇上雨天则需要进行补喷,试验期间共喷施EDU 6次。
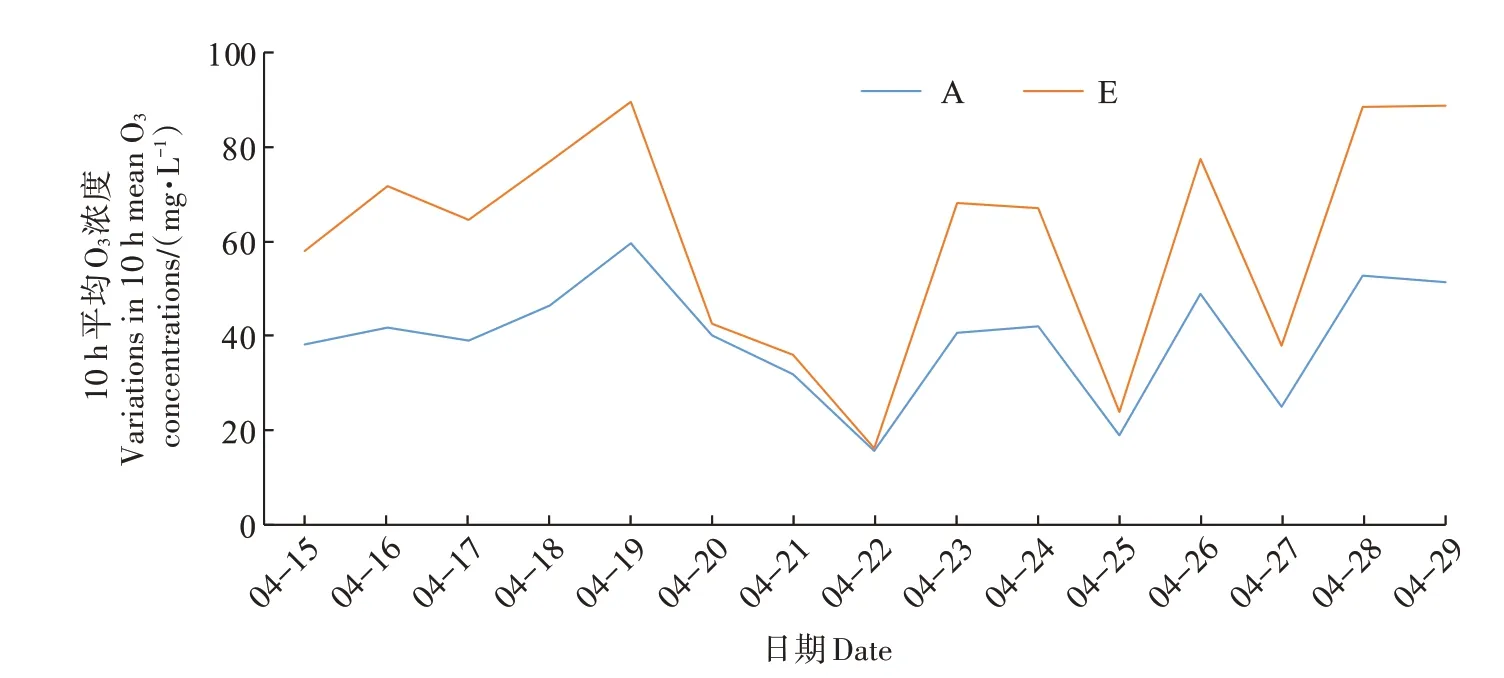
图1 O3-FACE平台10 h(8:00—18:00)O3浓度平均值的动态变化Figure 1 Variations of mean O3 concentrations in 10 h(8:00—18:00)
各圈播种时间、种植密度和日常管理均与周围大田相同。其中,肥料按氮肥220 kg·hm-2,磷肥(P2O5)和钾肥(K2O)均75 kg·hm-2的标准分别施入各圈,氮肥为尿素,磷肥和钾肥均为复合肥。
1.3 叶片样品收集与叶际微生物提取
于2021 年5 月13 日(即小麦灌浆期)采集叶片样品,用卷尺测定株高。双手用75%酒精消毒后,用表面消毒过的剪刀取各FACE 圈内小麦倒二叶(每个FACE 圈内每个小麦品种各取两穴,20 株左右),每穴叶片样品混合后放入无菌的牛皮纸袋带回实验室备用。参考Wang等[33]的方法收集叶际微生物,取5片小麦叶片,浸入装有300 mL无菌PBS缓冲液(0.02 mmol·L-1,pH 7.0,0.1%Tween 80)的1 L 三角瓶中,摇床28 ℃振荡1 h后,再超声振荡20 min。利用孔径为0.22 μm的滤膜抽真空富集叶际微生物,然后置于-80 ℃备用。按Fast DNA spin 试剂盒(MP Biomedicals LLC,美国)的使用说明书提取叶际微生物基因组总DNA,DNA经琼脂糖凝胶电泳验证后,采用NanoDrop™2000分光光度计(Thermo Scientific,美国)测定其浓度。
1.4 PCR扩增及高通量测序
利用引物799R/1993F 对叶际细菌16S rRNA 基因序列进行扩增[34]。每个引物上都连接了12 bp的独特的barcode 以区分不同样品。PCR 在50 μL 扩增体系中进行,包括25 μL PrimeSTAR Max Premix(2×)(TAKARA,大连)、正反向引物(Invitrogen,上海)各0.5 μL、1 μL DNA 模板(含DNA 10 ng)和23 μL 双蒸水。PCR 扩增程序:95 ℃预变性2 min 后,扩增20 个循环(95 ℃变性20 s,55 ℃退火20 s,72 ℃延伸45 s),最后72 ℃延伸3 min[35]。PCR 产物经琼脂糖凝胶电泳验证后,使用AxyPre PCR 清洁系统(Axygen,杭州)对其进行纯化。将纯化后的PCR 产物等摩尔质量混合后,利用Illumina MiSeq 测序仪进行高通量测序。原始数据已于NCBI数据库获得登录号(SRP375487)。
1.5 数据统计
参照Wang等[36]的方法,利用i-Sanger(http://www.i-sanger.com)云数据分析平台处理高通量测序获得的细菌16S rRNA 基因序列。原始数据质控处理后,利用UCLST 将高质量序列聚类成OTU(相似性不低于97%)[37]。利用RDP 数据对每个OTU 进行鉴定,置信阈值为0.80[38]。为避免不同测序深度对结果分析产生干扰,从每份样本中随机抽取15 000条序列进行后续alpha和beta多样性分析。
以香农指数(Shannon)[39]和辛普森指数(Simp⁃son)[40]来表征细菌群落的alpha 多样性。基于Bray-Curtis 距离计算方法,采用非度量多维尺度(NMDS)和主坐标分析(PCoA)对不同处理样品细菌群落结构进行聚类分析。利用Shapiro-Wilk 和Levene 检验检查数据的正态分布和方差齐性后,用JMP 10.0软件中的双因素方差分析(ANOVA)来解析O3、EDU 及其相互作用对株高、叶际细菌群落alpha 多样性及优势种群相对丰度的影响。利用Tukey-Kramer HSD 检验不同处理间的显著差异性[31]。
2 结果与分析
2.1 对小麦生长的影响
如图2所示,在对照处理条件下,E处理显著降低了小麦株高(较A处理降低了9.4%)。A处理条件下,喷施EDU对小麦株高没有产生显著影响。E处理条件下,喷施EDU 使小麦株高提高了11.0%(P<0.05)。O3和EDU的交互作用对小麦株高没有产生显著影响。
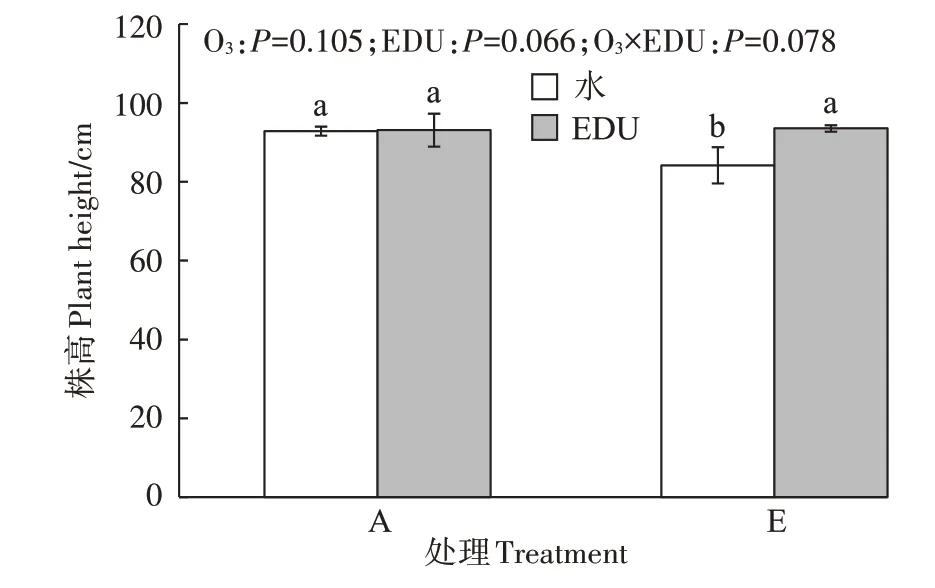
图2 O3浓度升高和EDU叶面喷施对灌浆期小麦株高的影响Figure 2 Effects of O3 and EDU leaf spraying on plant height
2.2 对小麦叶际细菌群落alpha多样性的影响
如表1 所示,不同处理样品细菌群落的覆盖度(在序列97%的相似度的水平上)均高于0.97,表明本试验的测序深度包含了大多数细菌群落,能满足后续序列分析的需要。不同处理条件下Shannon 指数和Simpson 指数没有发生显著变化,说明O3浓度升高、EDU 喷施及其交互作用均对小麦叶际细菌群落alpha多样性没有显著影响。
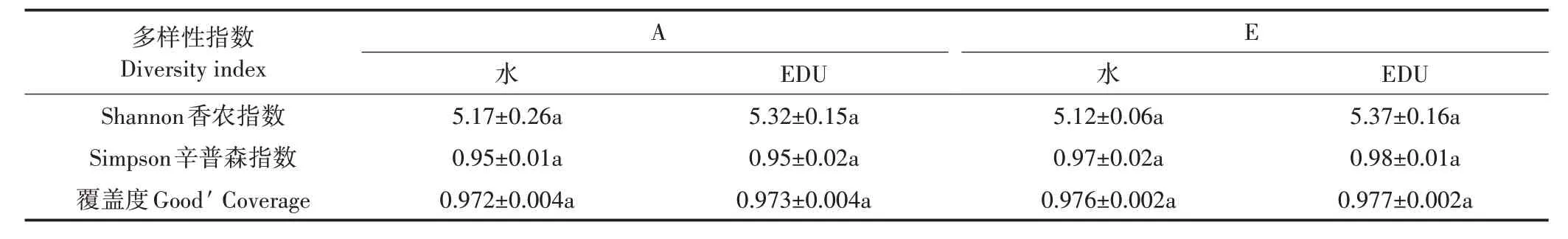
表1 不同试验处理条件下小麦叶际细菌群落alpha多样性指数Table 1 Alpha-diversity indices of phyllosphere bacterial community of NM88 under different treatments
2.3 对小麦叶际细菌群落结构的影响
基于不同样品间的Braye-Curtis 相似距离计算,采用NMDS和PCoA 对不同样品叶际细菌群落进行聚类分析。结果发现在NMDS图和PCoA图上A-水、AEDU、E-水、E-EDU 4 种处理的试验样品分别聚成了不同的圈(图3),这表明O3浓度升高和EDU喷施均改变了小麦叶际细菌群落结构。
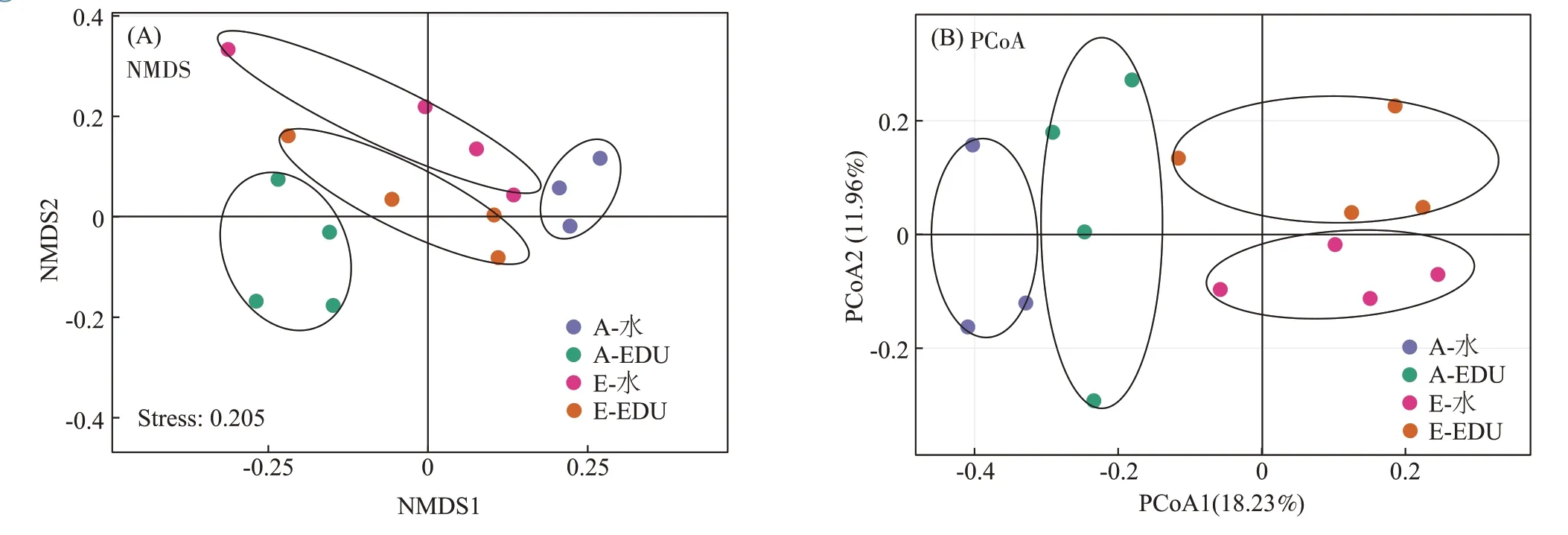
图3 不同处理条件下细菌群落的非度量多维尺度分析(NMDS)和主坐标分析(PCoA)Figure 3 Nonmetric multidimensional scaling(NMDS)analysis and principal coordinates analysis(PCoA)plot depicts the Bray–Curtis distance of bacterial communities in different treatments
2.4 对小麦叶际细菌优势菌门的影响
门水平上,小麦叶际细菌优势菌门为Proteobac⁃teria(84.7%~94.8%)、Bacteroidota(1.3%~13.1%)、Fir⁃micutes(1.6%~5.4%)。其中,Proteobacteria 中最优势纲为Gammaproteobacteria,占总细菌群落的75.2%~94.3%。如图4所示,水处理条件下,O3浓度升高提高了Gammaproteobacteria 和Alphaproteobacteria 的相对丰度,但是未达到显著水平。EDU 处理条件下,O3浓度升高使叶际Gammaproteobacteria 的相对丰度降低了14.3%(P<0.05),同时显著提高了Alphaproteobacte⁃ria 和Bacteroidetes 的相对丰度(与对照相比分别提高了1.4倍和8.7倍)。
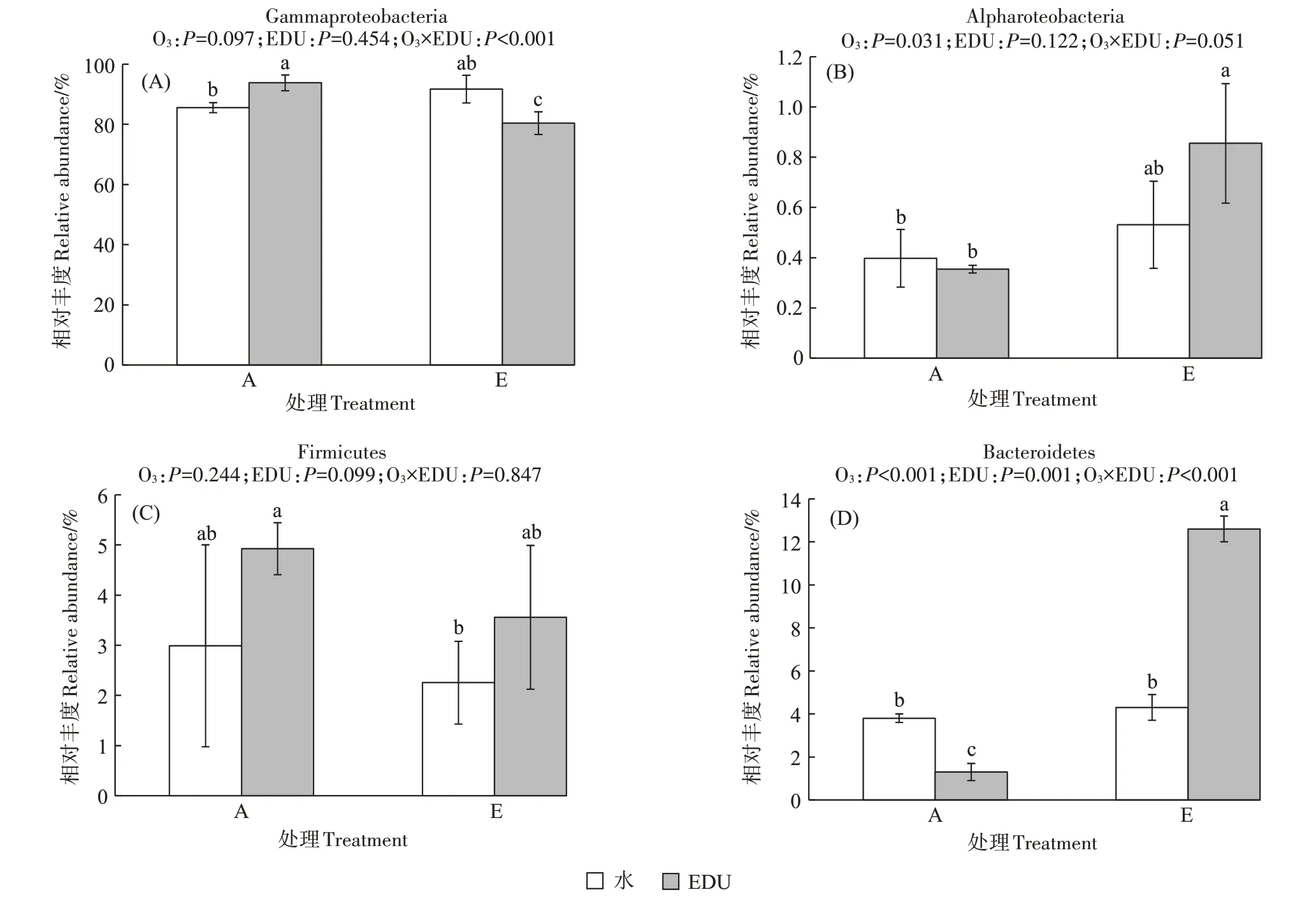
图4 O3浓度升高、EDU喷施及其交互作用对小麦叶际优势细菌门相对丰度的影响Figure 4 Effects of O3,EDU and their interaction on the relative abundance of dominant bacterial phyla inhabiting phyllosphere and endosphere of rice leaves
A 处理中,EDU 喷施使Gammaproteobacteria 的相对丰度增加了9.7%(P<0.05),并使Bacteroidetes 的相对丰度降低了65.8%(P<0.05)。E 处理中,EDU 喷施却使Gammaproteobacteria 的相对丰度降低了12.3%,使Bacteroidetes 的相对丰度增加了1.9 倍。O3和EDU的交互作用对Gammaproteobacteria 和Bacteroidetes 的相对丰度产生了显著影响(P<0.001)。
2.5 对小麦叶际细菌优势种属的影响
将总的叶际细菌群落中相对丰度高于1%的属定义为优势属,发现所有样品中农麦88 的优势属相对丰度由高到低依次为Pseudomonas(21.8%)、Pan⁃toea(17.1%)、Duganella(9.7%)、Serratia(7.2%)、Er⁃winia(5.0%)、Sphingomonas(3.5%)、Paenibacillus(3.0%)、Massilia(2.6%)。
如 表2 所示,O3浓 度升高 对Massilia、Pantoea、Pseudomonas和Serratia的相对丰度产生了显著影响。水和EDU 处理条件下,O3浓度升高使Pseudomonas和Serratia相对丰度均较A 处理分别显著下降了50.6%~57.2%和41.4%~65.5%。EDU 处理条件下,O3浓度升高使Massilia相对丰度显著下降了25.8%,而水处理下O3浓度升高对其相对丰度则无显著影响。O3浓度升高仅在水处理条件下使Pantoea相对丰度显著提高了5.7倍。
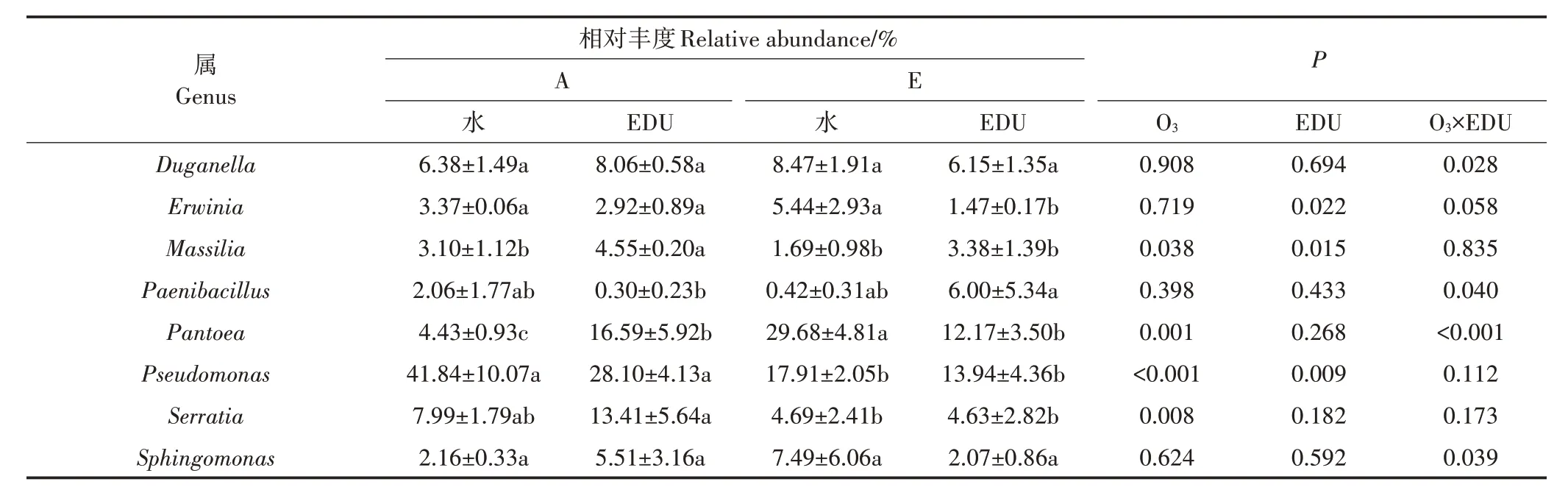
表2 O3浓度升高、EDU叶片喷施及其相互作用对叶际优势属(占比1%以上)相对丰度的影响Table 2 Main effects of elevated O3,EDU leaf spraying,and their interaction on the relative abundance of abundant genus(more than 1%)
EDU喷施对Erwinia、Massilia和Pseudomonas的相对丰度产生了显著影响。如表2 所示,E 处理下EDU使Erwinia相对丰度显著下降了73.0%,而A 处理下EDU 对其相对丰度则无显著影响。EDU 在A 处理条件下使Massilia和Pantoea相对丰度分别显著提高了46.7%和274.0%。A 和E 处理下EDU 均降低了Pseu⁃domonas的相对丰度,但未达到显著水平。O3和EDU的 交 互 作 用 对Duganella、Paenibacillus、Pantoea和Sphingomonas的相对丰度产生了显著影响。
3 讨论
本研究发现,环境O3浓度由40.9 mg·L-1·h-1升高至(59.9±2.5)mg·L-1·h-1对小麦的生长有抑制作用,具体表现为降低了小麦的株高(图2)。之前的研究通过盆栽和田间试验也发现O3浓度升高显著降低了小麦的生物量[41-42]。其主要作用机制为具有强氧化性的O3通过气孔进入植物体内后经一系列生化反应产生活性氧自由基(ROS),ROS 进一步破坏细胞结构,造成植物生理代谢混乱,进而减弱光合作用并抑制生长[43]。而EDU 处理能使小麦保持较高的抗氧化酶活性和较高浓度的抗氧化剂,以保护细胞免受O3诱导的ROS 的伤害,维持叶片中较高的光合色素和蛋白质水平[27],并将更多的光合作用物质转移到生殖部位,从而提高产量。Tiwari 等[44]发现叶面喷施300 mg·L-1EDU 显著提高了印度小麦(品种M533)的株高;本研究也发现在环境O3浓度和1.5 倍环境O3浓度条件下喷施EDU 均提高了小麦株高,尤其是1.5 倍环境O3浓度条件下喷施EDU 对小麦的促生作用更明显(图2)。Shang 等[45]利用开顶箱式O3熏蒸系统(OTC)通过盆栽试验发现在环境O3浓度[(39.6±1.9)mg·L-1·h-1]下叶面喷施EDU 能完全缓解水稻的O3胁迫,而在高浓度O3[(87.3±0.9)mg·L-1·h-1]下叶面喷施EDU 则部分缓解了O3胁迫。由此可知,叶面喷施EDU 对O3胁迫的缓解效果可能因品种和试验条件的不同而异。
生态系统多样性越丰富,其对环境变化的耐受性也越高[46]。Wang 等[47]利用OTC 熏蒸系统发现,较之于炭过滤大气,环境O3浓度升高40 mg·L-1·h-1时显著提高了杂交稻南粳5055 叶际细菌生物多样性,这可能是南粳5055对O3胁迫的一种积极应对策略。本研究中1.5 倍环境O3浓度与叶片EDU 喷施处理及其相互作用,均没有显著影响叶际细菌群落的alpha 多样性(表1)。研究结论的不一致可能与作物品种、O3熏蒸浓度及熏蒸方式相关。
本研究中叶际细菌群落的优势菌门按相对丰度由高到低排列依次是Proteobacteria、Bacteroidota 和Firmicutes,根据已有的报道可知这3个菌门为植物叶际优势菌门[2,8,48],与韩筱璇[49]和Xu等[50]的研究结果一致,本研究也发现Gammaproteobacteria 是小麦叶际最优势的种群。基于宏基因组研究,Sessitsch 等[51]发现在植物叶际占绝对优势的Gammaproteobacteria 参与了氮循环。氮是所有活细胞中尿素、氨基酸(蛋白质)、核酸(DNA和RNA)、三磷酸腺苷(ATP)和烟酰胺腺嘌呤二核苷酸(NAD)的基本成分[52],另外氮也是植物光合作用所必需的叶绿素的重要成分[53]。由微生物介导的氨化作用、硝化作用等氮循环过程能为植物提供速效和丰富的氮源,因此对植物生长与产量具有重要意义。由此可知Gammaproteobacteria 可能在维持植物生长与健康中起重要作用。另外Gammapro⁃teobacteria 也被报道能帮助植物抵御外部生物、非生物因子的干扰[54]。
PCoA 结果表明O3浓度升高和叶面喷施EDU 均显著改变了小麦叶际细菌群落结构(图3)。本研究发现水处理条件下O3浓度升高对Gammaproteobacte⁃ria 没有显著影响(图4),这表明Gammaproteobacteria在维持小麦叶际细菌群落稳定性中扮演了重要角色。另外在环境O3浓度条件下EDU 的喷施显著提高了Gammaproteobacteria 的相对丰度,这可能是由于EDU为叶际细菌提供了丰富的氮源,而Gammaproteobacte⁃ria 是叶际氮循环的重要参与者。另外在本研究中,在O3浓度升高条件下叶面喷施EDU 显著提高了Bac⁃teroidetes 的相对丰度,而在环境O3浓度下EDU 反而降低了Bacteroidetes的相对丰度(图4)。Bacteroidetes从人类肠道到海洋水环境等各种环境都有着较高的丰度,尽管数据库中储存的属于Bacteroidetes 的菌株序列并不多[55]。长期以来,滑动运动被认为是Bacte⁃roidetes 的一个标志性特征,它允许菌株主动运动到叶片表面具有更多水分和养分的有利位置,并可能通过对养分或植物信号分子的趋化作用来辅助完成该过程[56]。Bacteroidetes 在进化过程中还保留了高效节能的ACIIIcaa3COX 呼吸超复合体,这提高了它们竞争高分子量碳水化合物的适应性[56]。另外,Bacte⁃roidetes 可以利用柔红素家族色素作为紫外线保护剂[57]。综上说明Bacteroidetes 对胁迫环境具有更强的适应性。因此,环境O3浓度下喷施EDU 为叶际细菌提供了丰富的氮源,从而降低了Bacteroidetes 的相对丰度;而1.5 倍环境O3浓度下小麦生长受到胁迫,叶面喷施EDU 可能通过提高Bacteroidetes 的相对丰度来增强小麦对O3胁迫的适应性;但该结论仍需要后续试验进一步验证。
相对于栖息在植物地下部的微生物,叶际微生物在更开放的生境中面临更多环境压力[2],叶际微生物势必需要采取不同的策略应对环境压力以便在小麦叶片定殖。研究表明,Pantoea作为叶际细菌群落的优势属,在固氮、促进植物生长和抵御病原菌侵害中起重要作用[5]。本研究中水处理条件下O3浓度升高显著提高了叶际Pantoea的相对丰度(表2),这可能是小麦自主适应O3胁迫而提高叶际细菌氮素利用效率的一种适应性策略。另外,叶际的优势菌属Pseu⁃domonas和Sphingomonas也具有通过色素沉着来避免紫外线辐射的功能。优势属Massilia在植物表面的定殖能力很强,能通过产生吲哚乙酸、铁载体有效促进植物的生长,且其对微生境中养分的可用性与竞争也非常敏感,能通过产铁载体和纤维素酶等途径有效抵御包括Pythium等在内的植物病原菌的侵袭[58]。综上可知,叶际细菌从叶片表面获得稳定的微生境的同时也对植物生长有利。
了解叶际微生物的驱动因素是制定植物管理策略的第一步,能促进形成健康的叶际微生物群落结构,从而有利于植物的健康和生态功能[59]。一般来说,植物微生物群落结构由植物基因型、土壤、植物发育阶段、植物组织、气候和人类活动等因素决定[60-61]。作为一个开放的生境,叶际微生物比内生菌对非生物因素(包括辐射、干旱、风速等)更为敏感[2]。Ueda等[62]认为O3胁迫下不同程度的碳源有效性(如挥发性有机物VOCs 利用率)可能会影响水稻叶际微生物养分的有效性,从而影响微生物群落的组成。植物VOCs 排放对植物表面微生物群落的形成起重要作用[63],然而这一观点仍需通过进一步的试验来验证。Yan 等[64]发现叶片的形貌特征在叶际细菌群落的形成过程中发挥了重要作用。此外,电解质渗漏、叶片表面脂质转化和蜡质也可能对叶际微生物产生影响。这些生理参数将在今后的研究中进一步探讨。
另外,尽管本试验为O3浓度升高、EDU 喷施及其交互作用对小麦叶际微生物群落的影响提供了新的见解和重要视角,但还需要更多的试验数据来阐明O3浓度升高和EDU 喷施对不同小麦品种的不同生长阶段叶际微生物菌群的持续影响与重演性。特别是叶际微生物群落alpha多样性和群落结构与小麦产量之间的关系仍有待进一步研究。
4 结论
(1)O3浓度升高降低了农麦88 的株高,叶面喷施EDU能有效缓解O3胁迫对小麦生长的抑制。
(2)O3浓度升高、EDU叶面喷施显著改变了农麦88叶际细菌群落结构,但对alpha多样性没有显著影响。
(3)农麦88 叶际优势细菌门相对丰度由高到低依次为Proteobacteria、Bacteroidotes 和Firmicutes,其中Gammaproteobacteria 为最优势纲;O3浓度升高条件下EDU 显著降低了Gammaproteobacteria 的相对丰度,同时提高了Bacteroidetes 的相对丰度;EDU 可能通过提高逆境适应性强的Bacteroidetes 的相对丰度来增强小麦对O3胁迫的适应性。
——硫酰氟熏蒸应用技术

