Cd在地肤[Kochia scoparia(L.)Schrad.]中的化学形态及亚细胞分布
吴亮,朱姝,张皓,谭菊,王凡,牛鸿宇,谭璐,杨海君*
(1.核工业二三〇研究所,长沙 410007;2.湖南农业大学资源环境学院,长沙 410128;3.湖南省伴生放射性矿产资源评价与综合利用工程技术研究中心,长沙 410007;4.湖南省长沙生态环境监测中心,长沙 410001;5.长沙环境保护职业技术学院,长沙 410004)
《2020 中国生态环境状况公报》显示,影响农用地土壤环境质量的主要污染物是重金属,其中Cd 为首要污染物。据统计,全国农田土壤Cd 污染面积已超过2.8×105hm2,受到Cd 污染的谷类作物高达1.46×108kg[1]。耕地Cd污染已严重威胁到农产品质量安全和人民群众身体健康,对耕地Cd 污染的治理迫在眉睫。重金属在土壤中具有隐蔽性、滞后性、形态多样性、累积性、消除难度大等特点,如何采取有效的技术方法修复土壤Cd 污染已成为当前研究的重点和热点。常见的土壤重金属污染治理方法有土壤置换、电动修复等物理法和化学固定、化学淋洗等化学法,但采用这些方法治理Cd 污染存在可实施范围窄、成本高、会破坏土壤原有结构,且易造成土壤和地下水的二次污染等问题,因此至今未能大规模推广应用,也不适宜于大面积Cd污染农田土壤的修复治理。而植物修复技术具有安全、廉价等特点,不仅可用于重金属重度污染区(如矿山)的复垦,而且还可用于重金属中轻度污染土壤的改良,同时对修复后的植物进行资源化利用,可能产生一定的经济效益。相比于其他方法,植物修复技术引起次生环境问题的可能性小,且可通过回收与集中处置修复后的高富集性植物,彻底将重金属从土壤中移除[2]。植物修复被认为是重金属污染土壤修复治理最有效的方法[3-4],其关键是筛选获取超富集植物以及对收获植物的资源化利用。随着对重金属耐受性植物与超富集植物研究的日渐增多,植物修复作为一种净化土壤的生态技术被推广,相关的工程性试验研究以及实际应用效果也显示了植物修复技术商业化的可行性[5-6]。目前,国内研究者已筛选出Cd 超富集植物80 种,隶属于29 科69属[7]。这些超富集植物在修复土壤Cd 污染的过程中发挥了较大作用[8-10],但受自身生物量小、或本身具有入侵性、或栽培成本高、或经济价值低而影响到农业生产者收入等诸多问题制约,其中某些超富集植物的推广应用受到限制。因此,探寻高富集、生物量大、易管理、适生性强、资源化利用程度高、经济价值高及有助于改良土壤的先锋植物是目前植物修复研究的重点。
地肤[Kochia scoparia(L.)Schrad.]别名扫帚菜,为藜科地肤属一年生草本植物,成熟期株高50~100 cm,冠幅50~60 cm,花期7—9 月,果期8—10 月。地肤极耐旱、耐盐碱和贫瘠、适生性强、根系发达、生长快、生物量大。地肤被人们广泛栽种,其幼嫩部分可入药或食用,成熟后可用于制作扫帚。目前对地肤的研究主要集中于其营养成分[11-12]、耐盐生理特性[13-17]、栽培与园林应用等方面,也有研究报道了地肤对矿区土壤重金属的累积特性[18-20]、耐受和富集能力[21-22],但尚未见到有关酸性土壤和Cd胁迫对地肤生长及耐性机制的研究报道,该方面研究是对地肤开展实际应用的前提。因此,本研究采用盆栽控制试验,测定Cd胁迫下地肤生物量及不同器官中的Cd 含量,分析地肤对Cd 的生长响应、各器官中Cd 的迁移转化规律以及亚细胞分布和化学形态,揭示地肤对Cd 的积累和耐性机制,以期为其在耕地Cd 污染修复实践中应用提供理论基础和科学依据。
1 材料与方法
1.1 试验地点与材料
试验地位于湖南农业大学耘园基地(30°07'N,111°18'E)。试验时间为2021 年5 月3 日至10 月14日。供试盆栽土壤由自然土和营养土按体积比4∶1混合而成,混合后盆栽土壤pH 6.10,含水量25.88%,总Cd 1.253 mg·kg-1,有效态Cd 0.942 mg·kg-1。自然土采自试验地附近农田表层土(0~20 cm),去除土壤中植物残体和石子后,将土样用竹筒充分碾细,碾细后自然土pH 6.23,总Cd 1.005 mg·kg-1,有效态Cd 0.895 mg·kg-1。营养土购于厦门市花仙谷农业有限公司,pH 5.78,含水量31.15%,有机质43.5%,总Cd 0.246 mg·kg-1,碱解氮337.6 mg·kg-1,有效磷660.6 mg·kg-1,速效钾8 771 mg·kg-1,阳离子交换量54.6 cmol·kg-1,交换性钙31.2 cmol·kg-1,交换性镁10.9 cmol·kg-1,电导率0.262 mS·cm-1(水土比10∶1),铵态氮85.5 mg·kg-1,硝态氮306.8 mg·kg-1,通气孔隙度25.89%,持水孔隙度49.97%。
本试验所用地肤苗来自湖南省长沙县黄花镇长湖村科研合作基地。地肤在移栽培植期间仅发生少量蚜虫危害(为保障试验结果不受干扰未喷施任何杀虫剂产品)。在地肤移栽培植期,每间隔7~10 d 浇水1次,待植株生长至25~30 cm,追施有机肥水溶液(N+P2O5+K2O≥5%,总Cd 0.07 mg·kg-1),第一次追肥后,每间隔35 d追肥一次。
1.2 试验设计
本试验盆栽土为混合土,土壤总Cd 含量1.253 mg·kg-1,设定每盆土壤质量为10 kg(约占盆体积的4/5),Cd2+添加量(CdSO4溶液制备)依次为0、0.3、0.9、1.5、3.0、9.0 mg·kg-1,盆栽土壤中最终实测Cd 含量分别 为1.253、1.553、2.153、2.753、4.253、10.253 mg·kg-1。结合长株潭地区耕地土壤pH 特征(pH 在4.5~6.5 之间的土壤占比89.34%),本试验盆栽土壤初始pH分别设定为6.1(T处理)和5.0(TS处理),试验各处理设计见表1。每盆土壤平衡14 d 后,于2021 年5 月17 日统一移栽株高、长势、生物量等均较一致的地肤幼苗。每盆移栽3 株地肤,株距均匀分布,盆下垫一浅托盘,植苗后统一移入活动式塑料大棚内,移栽当日浇足水。移栽后1 周左右根据盆中土壤干湿情况进行适量补水,借助便携式土壤水分含量测定仪,使土壤含水量保持在70%左右。当气温升至35 ℃及以上时,定期补水使土壤湿润,并保证光照充分,在强光照射和高温天气对地肤采取遮阳网防护。成熟期地肤样品采集时间为2021年10月14日。
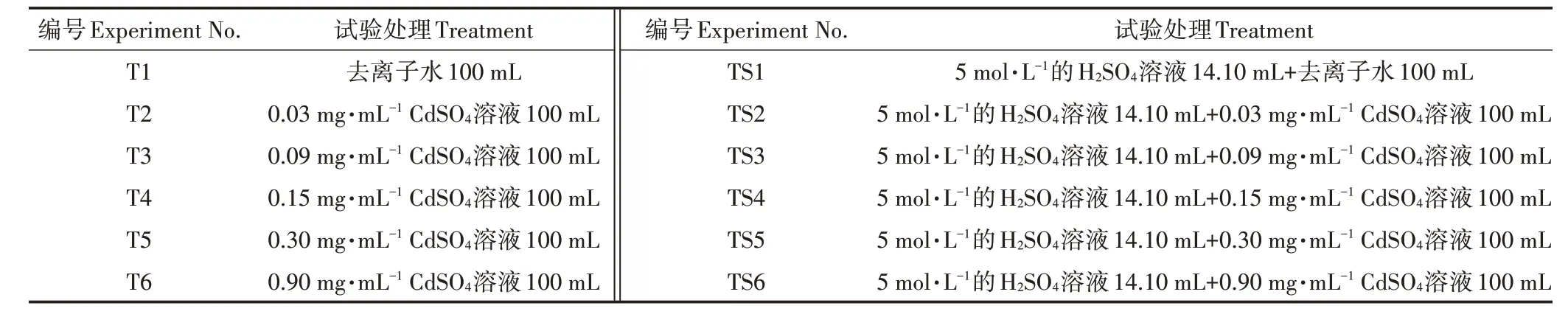
表1 试验设计Table 1 Experiment design
1.3 测定项目与方法
在T1~T6 和TS1~TS6 处理中,每处理选取3 盆株高、长势、冠幅等均较一致的地肤进行采样,并在选取的3盆中各拔出1株完整地肤植株,用陶瓷剪刀剪下其根系和茎(上、中、下部混合剪取约5 g)鲜样用于Cd的亚细胞及化学形态分析。将每盆中剩余的2株地肤用陶瓷剪刀分离植株根系和地上部,分装于密封袋中并编号,进行地肤的根系和茎Cd含量测定(因在采集成熟期地肤时,大部分叶已凋落,加之地肤叶生物量小,故未对地肤叶单独进行Cd含量检测与分析)。
1.3.1 样品Cd的测定
采用湿式消解法[23],分别称取一定量干燥后的根系、茎样品粉末置于硬质消解管中,加入10 mL 浓硝酸(14.5 mol·L-1),盖上弯颈漏斗浸泡过夜,用管式消解炉消解,升温程序为70 ℃保持30 min,90 ℃保持30 min,120 ℃保持120 min,140 ℃保持120 min,然后赶酸至1 mL左右定容过滤,保存待测。
1.3.2 亚细胞组分的测定
亚细胞组分的分离采用差速离心法[24]。剪碎称取地肤鲜样(根系、茎)0.2 g,加入10 mL 预冷的提取液进行研磨,提取液组成如下:0.25 mol·L-1蔗糖溶液,50 mmol·L-1Tris-HCl(pH 7.5)缓冲液,1 mmol·L-1二硫苏糖醇溶液。提取液少量多次加入,在4 ℃低温下用研钵将样品研磨成匀浆,然后转移到50 mL 离心管中,使用高速冷冻离心机(4 ℃)以4 000 r·min-1离心10 min,下部沉淀为细胞壁组分(Fcw),将上清液继续在10 000 r·min-1下离心分离45 min,得到的下部沉淀为细胞器组分(For),上清液则为可溶性组分(Fs)。
1.3.3 Cd化学结合形态测定
参照Lu 等[25]的方法,利用化学试剂对地肤根系、茎细胞中不同化学形态的Cd进行逐步提取。称取地肤冰冻样品0.5 g,少量多次加入20 mL 提取剂,用研钵将样品研磨成匀浆后转移至50 mL 离心管中,放入25 ℃的恒温培养箱振荡24 h 后,以4 000 r·min-1的转速离心15 min,将上清液分离,向离心管内的沉淀物中再加入10 mL同种提取剂,25 ℃恒温振荡1 h后,于4 000 r·min-1离心15 min,将两次离心后的上清液合并,形成以下由5 种提取剂依次逐步提取得到的Cd形态:FE,由80%乙醇提取后的硝酸盐、氯化物为主的无机盐及氨基酸等;Fw,由去离子水提取后的水溶性有机酸盐、重金属的一代磷酸盐[M(H2PO4)2]等;FNaCl,由1 mol·L-1NaCl 溶液提取后的果胶酸盐、与蛋白质呈结合态或吸着态的重金属Cd 等;FHAc,由2%HAc 提取后的难溶的金属Cd 磷酸盐等;FHCl,由0.6 mol·L-1HCl 提取后的草酸盐等;FR,残渣态。将上述分离的上清液和沉淀组分装入三角瓶中,并置于电热板(70 ℃)上蒸发至近干后,用HNO3-HClO4消解定容,采用ICP-MS测定Cd含量。
1.4 数据处理
试验数据采用3 个重复样的算术平均值±标准偏差(SD)表示。采用SPSS 25.0 软件中的单因素方差(ANOVA),及最小显著差数法(LSD)进行显著性检验(P<0.05)。采用LSD 对数据进行多重比较,用重复度量法分析不同pH 值、不同添加量Cd处理及二者交互效应对地肤根系、茎中亚细胞Cd含量的影响,采用GraphPad Prime 8.3制图。
富集系数(BCF)为地肤植株体内(根系、茎)Cd含量(mg·kg-1)与土壤Cd含量(mg·kg-1)的比值。
转运系数(TF)为地肤植株地上部分(茎)Cd 含量(mg·kg-1)与地肤植株地下部分(根系)Cd 含量(mg·kg-1)的比值。
Cd 积累量(mg)为地肤植株各部位Cd 含量(mg·kg-1)与植株各部位干质量(kg)的乘积。
2 结果与分析
2.1 不同处理对成熟期地肤生物量的影响
表2 为土壤Cd 胁迫对地肤生物量的影响。在T3~T6 处理下,地肤总生物量和茎生物量均逐渐升高,而根系生物量在T1~T5 处理下逐渐升高。T5 和T6 处理下的地肤总生物量相比T1 处理显著增加(P<0.05),且T6 处理地肤茎生物量达到最高,比T1 处理增加了51.79%。地肤根系生物量在T5处理下达到最高,为T1 处理的2.22 倍。在TS 处理组中,随着Cd 添加量的升高,地肤总生物量、根系生物量均呈先降低后升高的趋势。在TS3 和TS4 处理下,地肤茎生物量相比TS1处理显著降低(P<0.05),分别下降了42.73%和38.84%。在TS4、TS5及TS6处理下,地肤根系生物量相比TS1 处理显著降低,分别下降了47.19%、61.82%和51.22%。对比发现,T4和T5处理下的地肤总生物量分别高于对应的TS4 和TS5 处理,且TS1 处理的地肤茎和根系生物量在所有Cd 处理中均最高,显著高于对应的T1 处理(P<0.05),说明地肤在设定的酸性土壤环境中均能正常生长,进一步证实了地肤对酸性土壤的适应性强。
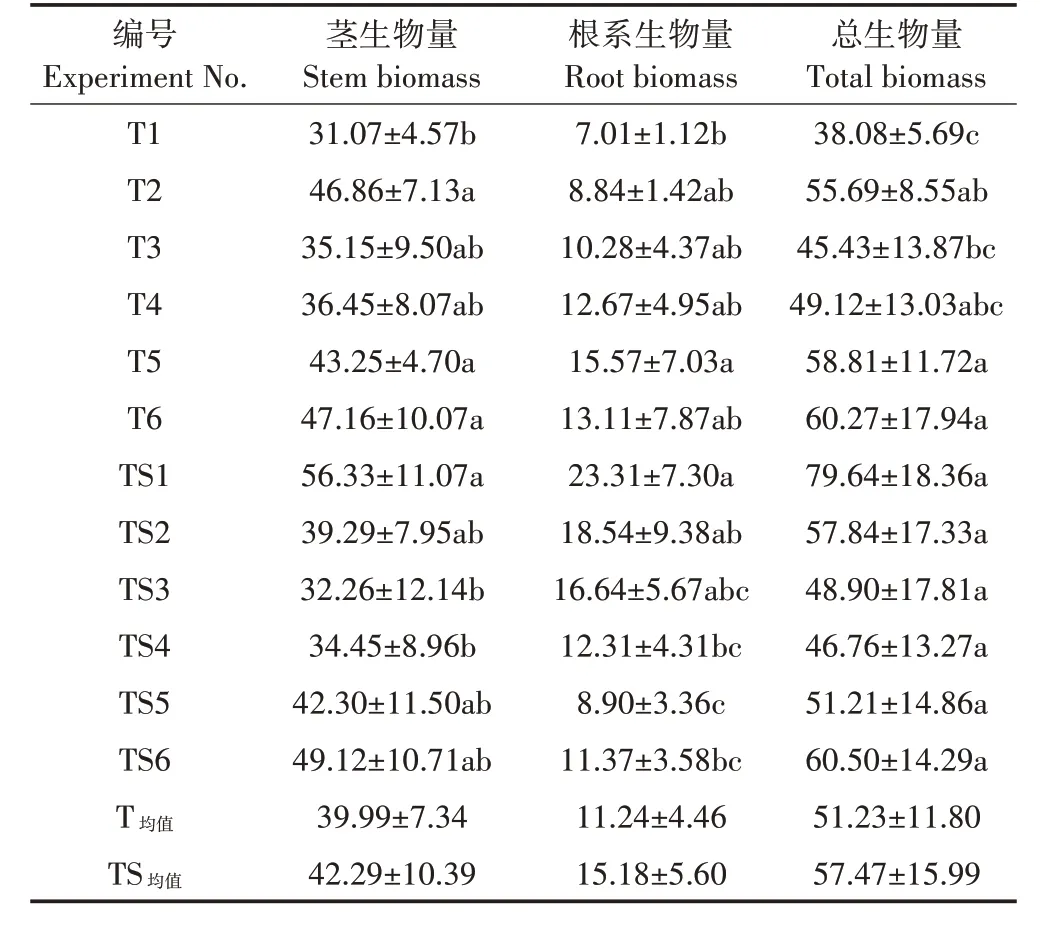
表2 不同处理地肤的生物量(g,以干质量计)Table 2 Biomass of Kochia scoparia(L.)Schrad.in different treatments(g,calculated by dry weight)
2.2 地肤植株对Cd的积累及其富集与转移特性
图1(a)为Cd 胁迫下地肤根系、茎中Cd 含量及根系与茎混合样品Cd含量。T处理组地肤根系Cd含量变化范围为3.27~13.36 mg·kg-1,茎部Cd 含量变化范围为3.66~21.4 mg·kg-1,约为根系的1.12~1.60倍。随着Cd添加量增加,地肤根系中Cd含量呈降低-升高-降低-升高的变化趋势,茎中Cd含量呈升高-降低-升高-降低-升高的变化趋势,且相同Cd 添加量处理下茎中Cd 含量均高于根系。TS 处理组地肤根系中Cd含量呈升高-降低-升高-降低-升高的变化趋势,茎中Cd 含量呈先降低后升高的趋势,除TS2 处理外,其余相同Cd 添加量处理下茎中Cd 含量均高于根系。从图1 还可知,T4 和T6 处理的地肤茎中Cd 含量均显著高于T1 处理(P<0.05),且T6 处理下地肤根系与茎中Cd 含量均达到最高值,分别为13.36 mg·kg-1和21.40 mg·kg-1,分别为T1 处理下的3.23 倍和4.91 倍;TS6处理下地肤根系与茎中Cd含量均显著高于TS1处理(P<0.05),且TS6处理时地肤根系与茎中Cd含量均达到最高值,为15.67 mg·kg-1和16.08 mg·kg-1,分别是TS1 处理下的4.65 倍和4.12 倍。对比不同pH 值、相同Cd 添加量处理得知,除Cd 添加量为0.9 mg·kg-1时TS 处理地肤茎部Cd 含量高于T 处理外,在其余Cd添加量下,T处理地肤茎部Cd含量均高于TS处理。
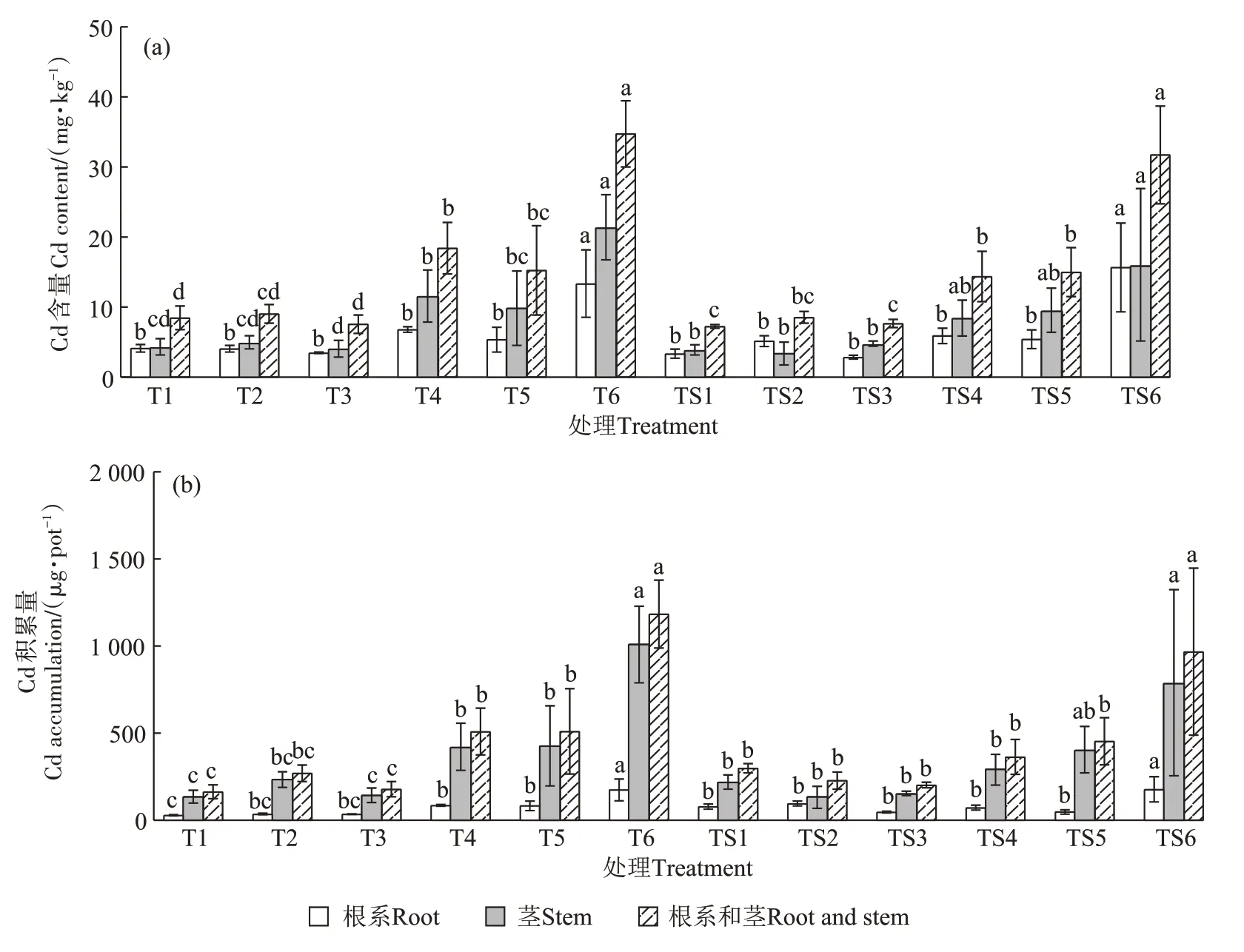
图1 Cd胁迫下地肤根系和茎中Cd含量及其积累量Figure 1 Cd content and accumulation in the root and stem of Kochia scoparia(L.)Schrad.under Cd stress
图1(b)为Cd胁迫下地肤根系、茎中Cd积累量及根系与茎混合样品Cd 积累量。所有处理下茎部Cd积累量均大于根系,说明Cd主要积累在地肤茎部。T处理组,随着Cd 添加量升高,地肤根系中Cd 积累量呈现升高-降低-升高-降低-升高的变化趋势,在茎中则呈现升高-降低-升高的变化趋势,且茎中的增幅尤为明显。T6 处理下根系和茎的Cd 积累量均达到最高值,为175.15 μg·pot-1和1 009.22 μg·pot-1。T 处理组中地肤茎的Cd 积累量为根系的4.01~6.50倍。TS处理组地肤根系的Cd积累量变化趋势与T处理组大体相同,而茎的Cd 积累量则呈先降低后升高的趋势,TS6 处理下根系和茎的Cd 积累量均达到最高值,分别为178.24 μg·pot-1和789.75 μg·pot-1。TS处理组中茎的Cd 积累量为根系的1.39~8.40 倍。此外,对比不同pH 值、相同Cd 添加量处理可知,T4~T6处理地肤茎部Cd积累量均高于TS4~TS6处理。
表3 为Cd 胁迫下地肤根系、茎及其混合样品Cd含量和Cd 积累量的相关性分析结果。可以看出,地肤根系Cd 含量、根系与茎Cd 含量在T 处理与TS 处理组间相关系数均高于0.98,达极显著相关水平(P<0.01),茎Cd 含量、茎Cd 累积量和根系与茎Cd 累积量组间相关系数均高于0.96,达显著相关水平(P<0.05),但根系Cd累积量组间相关系数仅为0.76,相关性不显著(P>0.05),表明地肤茎是积累Cd 的主要器官,地肤在不同土壤pH条件下,其茎部对Cd的富集能力不同。
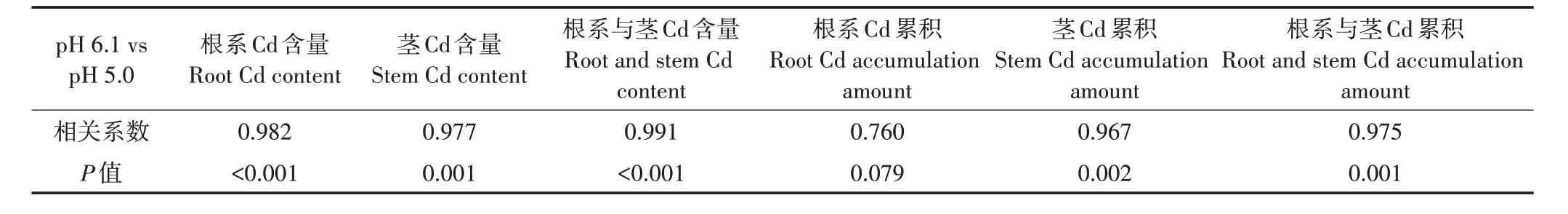
表3 地肤根系、茎、根系与茎的Cd含量和Cd积累量的相关性分析Table 3 Correlation analysis of Cd content and accumulation in roots,stems,roots and stems of Kochia scoparia(L.)Schrad.
图2 为地肤根系和茎在Cd 胁迫下的富集系数和转运系数。T和TS处理组中地肤根系和茎Cd富集能力均为茎>根。T 处理组中地肤根系和茎的富集系数均大于1,均值分别为2.09 和2.84;TS 处理组地肤根系和茎的富集系数也大于1,均值分别为2.06和2.34。从图2 还可知,随着土壤Cd 添加量增加,T 处理组地肤茎部对Cd的富集能力呈现降低-升高-降低的变化趋势,茎富集系数在T3 处理时最低,为1.70,而在T4处理时最高,是T3 处理的2.48 倍。TS 处理组的变化趋势与T 处理组大致相同,茎富集系数在TS6 处理时最低,为1.57,在TS1 处理时最高,其次是TS4 处理。除TS2处理外,所有处理地肤的转运系数均大于1,且在T4~T6 和TS3~TS5 处理时,地肤对Cd 的转运能力较强。对比不同pH 处理和相同土壤Cd 添加量下地肤茎部富集系数发现,除T6处理外,其余Cd处理下T处理组地肤茎部富集系数均高于对应的TS 处理组,且T4~T6 处理组地肤的转运系数高于TS4~TS6 处理组。结合前文分析可知,地肤对pH 6.1 和Cd 含量范围在2.0~10.0 mg·kg-1下的土壤富集能力较好,尤其对Cd含量为2.753 mg·kg-1(T4处理)下的土壤富集能力更佳。
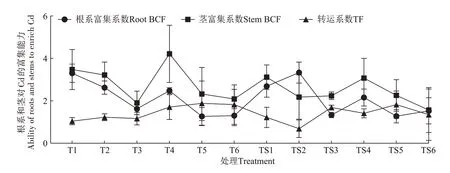
图2 Cd胁迫下地肤根系、茎的富集系数及转运系数Figure 2 BCF and TF in the roots and stems of Kochia scoparia(L.)Schrad.under Cd stress
2.3 地肤根系与茎中Cd的亚细胞分布
图3 (a)为Cd在地肤根系亚细胞组分中的分布情况。Cd 胁迫下,细胞壁组分中Cd 的占比显著高于可溶性组分和细胞器组分。T处理组地肤细胞壁组分占比为56.65%~84.33%,TS处理组地肤细胞壁组分占比为68.76%~84.51%;其次是可溶性组分,T处理组地肤可溶性组分占比为11.54%~31.89%,TS 处理组为11.02%~23.47%;T 处理组地肤细胞器组分占比为2.40%~6.67%,TS 处理组为2.12%~4.26%。从细胞内Cd的分布比例来看,随着Cd添加量增加,T处理组地肤根系细胞器组分和可溶性组分中Cd占比均呈现增加-减少-增加-减少的变化趋势,并在T3处理时达到最高,分别占比6.67%和31.89%,而细胞壁组分中的Cd占比随Cd添加量的增加呈减少-增加-减少-增加的变化趋势。TS处理组中,地肤根系细胞器组分和可溶性组分中Cd占比呈现先减后增的趋势,其中TS1处理时占比最高,分别占比4.26%和23.47%,而细胞壁组分中Cd的占比随Cd添加量增加呈先增后减的趋势。
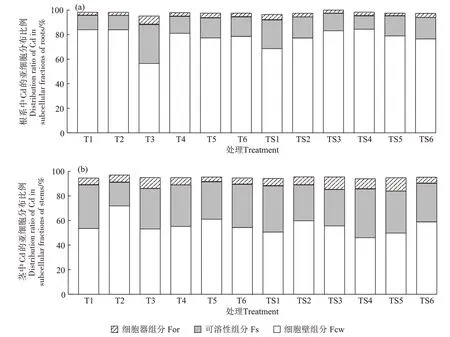
图3 Cd在地肤根系和茎的亚细胞组分中的分布比例Figure 3 Distribution ratio of Cd in subcellular fractions of the roots and stems of Kochia scoparia(L.)Schrad.
图3(b)为Cd在地肤茎部亚细胞组分中的分布情况。T和TS处理组地肤茎部亚细胞中的Cd含量分布与根部一致,为细胞壁组分>可溶性组分>细胞器组分。各组分中的分布比例随Cd添加量的增加变化幅度较小,茎Cd主要贮存于细胞壁组分和可溶性组分,其分布比例分别为T 处理53.35%~72.12%、TS 处理46.26%~60.06% 和T 处 理19.23%~35.73%、TS 处 理29.12%~39.68%,而TS处理组细胞器组分占比比根系中略高,为4.73%~10.84%。可以看出,地肤根部细胞壁的固持作用和液泡的区隔化作用较强,使得根系中细胞器Cd含量较少,基本维持在2%~3%,而地肤茎部是主要受Cd 胁迫的器官,其细胞器组分Cd 含量在4%~11%之间。对比不同pH、相同Cd 添加量处理下茎部亚细胞Cd含量发现,T1~T5处理组茎部细胞壁组分和可溶性组分中Cd含量之和高于TS1~TS5处理组,可见在pH 6.1的土壤中,地肤对Cd的抵御能力更强。
2.4 地肤根系与茎中Cd的化学形态特征
图4 (a)为地肤根中不同提取态Cd 含量分布特征,其中以移动性和毒性相对较低的醋酸提取态(FHAc)Cd 分配比例最大,T 处理为37.31%~56.24%,TS处理为40.98%~52.32%。随着Cd 添加量增加,各处理组地肤根系中不同提取态Cd占比无明显变化。地肤根系中Cd主要以醋酸提取态、氯化钠提取态(FNaCl)和乙醇提取态(FE)为主,T 处理组三者占总提取态的82.96%~88.17%,其中醋酸提取态和氯化钠提取态Cd分别占总提取态的37.31%~56.24% 和15.80%~27.68%,乙醇提取态、盐酸提取态(FHCl)、去离子水提取态(FW)所占比例分别为13.47%~24.01%、4.08%~5.53%和0.41%~1.89%,残渣态(FR)占比最小,仅占总提取态的0.81%~1.39%,且各处理间变化不明显;TS处理组三者占总提取态的83.70%~89.70%,其中醋酸提取态和氯化钠提取态分别占总提取态的40.98%~52.32%和14.59%~21.04%,乙醇提取态、盐酸提取态、去离子水提取态所占比例分别为17.94%~25.89%、3.88%~7.97%和0.96%~1.22%,残渣态占比最小,为0.63%~1.13%。
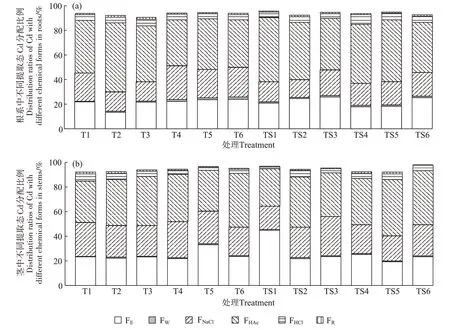
图4 成熟期地肤根系与茎中各化学形态Cd分配比例Figure 4 Distribution ratios of Cd with different chemical forms in the roots and stems of Kochia scoparia(L.)Schrad.
图4(b)为地肤茎中不同提取态Cd 含量分布特征,与根部情况一致,Cd 主要以醋酸提取态、氯化钠提取态和乙醇提取态为主。氯化钠提取态和乙醇提取态占比接近,残渣态Cd含量最低。整体上看,茎中各化学形态Cd 含量比根部低。从所占比例来看,醋酸提取态所占比例最高(T 处理为33.20%~43.70%,TS 处理为30.39%~45.81%),氯化钠提取态和乙醇提取态占比较为接近,T 处理组分别为23.25%~29.32%和21.99%~33.20%,TS 处理组分别为19.13%~32.00%和19.35%~45.02%,其次为盐酸提取态、残渣态和去离子水提取态,T处理组中占比分别为2.66%~5.99%、0.46%~1.16%和0.35%~0.83%,TS 处理组中分别为1.69%~5.20%、0.44%~1.16%和0.41%~0.92%。可见,地肤植株体内的Cd 主要以醋酸提取态为主,说明Cd在地肤植株体内主要以难溶于水的重金属磷酸盐形式存在。此外通过对比发现,TS1~TS4处理组的乙醇提取态和去离子水提取态所占比例高于T1~T4处理组,该两种提取态的Cd 对植物细胞毒害最大,说明本研究地肤在pH 6.1、Cd添加量小于2.153 mg·kg-1的土壤中对Cd污染的抵御能力较好。
3 讨论
3.1 Cd胁迫对地肤生长及其Cd含量的影响
重金属胁迫直接反映在植物生长状况和生物量的变化程度上。不同重金属元素对植物生长影响有不同的阈值[26],当环境中重金属浓度超过阈值时,植物的生长发育就会受到抑制,表现为生长迟缓、植株矮小甚至死亡,进而影响到植物的生物量[27]。本试验表明,在地肤成活率方面,所有处理组地肤在移植初期均能正常生长,到移植中期,48 盆供试材料中仅有T5和TS6处理各有1株死亡,成活率为98.6%;在病虫害方面,除少部分地肤在移栽中期发生轻微蚜虫危害外,未见其他病虫害发生;在Cd 毒害症状方面,未发现明显的外观反应症状,如叶片斑点或枯黄、植株矮小等生长异常现象。综合表明,当重金属Cd 进入地肤体内之后,植株表现出较强的适应能力,生长过程未受到显著抑制,未发生如其他植物受到重金属毒害时所表现出的叶片褪绿、生长迟缓、植株矮小、产量下降甚至死亡等症状。由表2可知,Cd胁迫对地肤植株生物量产生了一定影响,说明地肤对不同程度Cd污染土壤具有不同的耐受性。在T处理组中,T6处理的地肤茎部生物量达到最高,比T1处理增加了51.79%;根系生物量在T5 处理时达到最高,为T1 处理的2.22 倍。这进一步说明在pH 6.1 和Cd 添加量为0~9.0 mg·kg-1的土壤中,地肤生长受Cd胁迫影响较小。在TS1、TS2及TS3处理下,地肤根系生物量分别与对应的T1、T2、T3处理相比均更大,但在TS4、TS5及TS6处理下,地肤根系生物量分别与对应的T4、T5 及T6 处理相比显著降低,从而反映了在pH 5.0下低Cd含量处理(1.2~2.1 mg·kg-1)一定程度刺激了地肤根系的生长发育,但在高Cd 含量?(2.7~9.0 mg·kg-1)胁迫下,地肤根系作为主要的Cd 积累部位受到了显著影响,说明高含量的Cd 在弱酸性土壤中对地肤根系具有抑制作用,该研究结果与张杨杨等[28]的结论一致。就此来看,同一植株不同器官对Cd胁迫响应结果不同的现象有待进一步研究。
植物应对重金属胁迫通常采用排斥和积累两种策略。就积累策略而言,一些植物大量富集Cd 离子后,将少量的Cd 储存在根部,其余转移到地上部分[29]。本研究发现地肤植株中的Cd 含量及积累量均表现为茎>根系,T和TS处理组的地肤茎部Cd积累量分别占植株总积累量的80.03%~86.67%和58.09%~89.35%,这与洋野黍、粗毛牛膝菊、珊瑚树等植物对重金属的积累分布规律[30-31]一致,可见地肤适用于南方酸性土壤的Cd 污染修复。刘欢[32]的研究结果表明,低浓度的低分子量有机酸能促进植物体内的Cd从地下部向地上部转移,因此地肤地上部Cd 含量大于地下部的原因可能与试验土壤均呈弱酸性有关。Baker 等[33]将地上部Cd 富集量达到100 μg·g-1以上的植物称为Cd 超积累植物。在已报道的超积累植物中[34],天蓝遏蓝菜地上部Cd 含量为213 mg·kg-1,商陆地上部Cd 的最高富集量达482.25 mg·kg-1,宝山堇菜地上部Cd 含量高达1 168 mg·kg-1。与之相比,本研究对象地肤的Cd富集量最高未达到50 mg·kg-1,原因之一是本试验设计的Cd胁迫量显著低于上述报道的土壤背景值。富集系数可衡量植物从土壤/基质中富集重金属的能力,也可以间接反映植物对重金属的耐性[35]。富集系数越大,富集能力越强,越有利于植物修复。同时,转运系数是用来指示重金属从植物根系转移到其他器官的能力的值,转移系数越大表示重金属运送能力越强,植物对重金属的耐性也越强[36]。本研究中,T 和TS处理组(除TS2外)地肤的根和茎在不同添加量Cd胁迫下的富集系数均大于1,且根茎转移系数也大于1,表明地肤在酸性土壤中对Cd有较强的富集能力。由此可见,地肤是一种较具潜力的土壤Cd污染修复植物。T6处理地肤根系和茎的富集系数相较T1 处理分别下降了60.96%和39.94%,TS6 处理地肤根系和茎的富集系数相较TS1 处理分别下降了43.12%和49.37%。Sun等[37]的研究也表明,低污染土壤中植物对重金属的富集系数要高于严重污染的土壤,这可能是因为高浓度重金属污染导致植物的生命活动受到抑制,造成植物富集能力降低。
需要说明的是,本研究为盆栽控制试验,这在一定程度上与大田生产实际存在差异。盆栽过程限制了地肤根部的生长和拓展,相同种植条件下对比测定结果显示,地肤盆栽植株根部生物量相比大田降低17%~22%,根部生物量的降低直接减少了植株对土壤Cd的积累和修复效果;从生长基质来看,本研究采用混合土壤作为栽培基质,与大田的全自然土壤存在差别,Cd在其中的赋存形态、生物有效性等均有一定差异,这些都是可导致地肤对Cd富集效率、修复效果等方面的不确定性的因素;此外,盆栽环境在一定程度上缩短了地肤的生长周期,据观测,盆栽地肤的花果期相比田间开敞环境下提前了8~12 d,这直接造成了成熟期植株整株生物量和分蘖数量的下降,从而进一步影响了其修复效果。彭云霄等[38]比较了大田与盆栽条件下重金属Cd赋存形态的差异,通过数据对比验证了盆栽试验的可行性。本研究采用人工模拟和人工控制方式完成,对地肤的生长习性、Cd 富集效率及土壤修复潜力均进行了较深入完备的探索,为后续研究奠定了较好的基础。如何更精准地阐明地肤在不同生长环境中的修复表现并将本成果更好地应用于生产实际,是开展下一步工作的方向。
3.2 Cd在地肤亚细胞中的分布
重金属被植物吸收后,会选择性地分布在植物细胞的不同区域,以减轻重金属的毒害作用。例如,植物对重金属的耐受性表现在细胞壁的区室化固定作用,或以低毒、无毒的形式将其储存在液泡中[39]。Cd在细胞中的区室化效应可极大地影响细胞中游离Cd的水平,从而影响Cd在植物中的活动[40]。因此,Cd在植物中的亚细胞分布被认为是影响其迁移、积累和植物耐受程度的重要因素,不同植物在Cd的吸收、积累和分布方面存在显著差异[41]。本研究对象地肤根和茎细胞中Cd的分布均表现为细胞壁>可溶性组分>细胞器,表明细胞壁和可溶性组分是贮存Cd 的主要位点,这与唐敏等[42]的研究结果相一致。但也有研究认为植物体内大部分Cd 储存在细胞的可溶性组分(53.7%~68.3%)[43],这种差异可能由土壤Cd含量不同以及植物对Cd的耐受机制不同所致。细胞壁可沉淀Cd2+,并可抑制其跨膜运输以降低细胞器中的Cd并维持正常生理功能,从而保护原生质体免受Cd 毒害[44]。从细胞壁结构组成看,其主要由多糖(包括纤维素、半纤维素和果胶)和蛋白质组成,可提供大量官能团,包括羧基、羟基、氨基和醛基等[45],这些基团可与Cd2+以配位键的方式结合,从而有效阻止Cd2+进入细胞。当细胞壁中的结合位点达到饱和时,Cd 即被转运到液泡中,液泡中的细胞液是植物细胞重要的可溶性组分[46]。已有研究表明,细胞液中存在多种氨基酸、无机盐、有机酸和有机碱[47],Cd2+一旦进入细胞质基质,大部分即被转运至液泡中,植物便可通过形成金属螯合物来减少细胞质基质中游离Cd 的浓度以避免Cd胁迫[48],从而极大地降低Cd 对细胞器结构和功能的损伤。由此可见,细胞壁固定和液泡区室化作用均是植物提高重金属解毒和耐受性的重要机制[49]。
3.3 Cd在地肤植株体内的化学形态特征
除亚细胞分布外,Cd 在植物体内的毒性和迁移能力也与其化学形态紧密相关[50]。在Wang 等[51]的研究中,重金属的生物有效性随着提取剂极性的增加而下降,对植物的毒害作用也逐渐减弱,6 种化学形态的Cd 毒性大小顺序为FE>FW>FNaCl>FHAc>FHCl>FR,以无机盐态(FE,80%乙醇提取)和水溶态(FW,去离子水提取)赋存的金属离子对植物细胞毒害最大;其次是果胶酸盐态、蛋白结合态(FNaCl,NaCl 提取)和难溶性磷酸盐态(FHAc,2%醋酸提取);草酸盐态(FHCl,HCl 提取)的毒性最低。本研究中,地肤植物体内Cd的主要赋存形态为醋酸提取态、氯化钠提取态和乙醇提取态,氯化钠提取态和乙醇提取态Cd 含量相近,这与Wang等[52]的研究结果一致。而在有些研究中[53-54],植物体内Cd 的主要赋存形态为1 mol·L-1NaCl、2%HAc和0.6 mol·L-1HCl 作为提取剂的提取态,这表明不同化学形态的Cd 在不同植物中的作用差异很大。目前,人们认识到难溶于水的重金属磷酸盐主要存在于细胞壁和液泡中[55],而果胶酸盐态、蛋白质结合态或吸附态的重金属主要存在于液泡内[56]。由此可知,Cd化学形态的分析结果与Cd 的亚细胞分布相关性显著,即Cd 主要存在于地肤的细胞壁组分和可溶性组分中。此外本研究还发现,地肤根部80%乙醇和去离子水的提取态Cd 在大部分处理中高于茎部,这两种提取态的Cd 主要与细胞中硝酸盐、氯化物为主的无机盐、氨基酸盐以及水溶性有机酸盐相结合,具有较强流动性[57]。流动性强的Cd 在植物根和茎中分布比例较高将有利于Cd 通过共质体途径运输至地上部,这可能是地肤将更多的Cd 富集在茎中的一个重要原因。综上所述,地肤根和茎中大量的Cd 以毒性较弱的醋酸提取态和氯化钠提取态赋存是其降低Cd生物有效性、减少Cd毒害的一种重要防御机制。
4 结论
(1)地肤具有对不同Cd胁迫水平的耐性,且对酸性土壤有较强的适生性,适合用于南方酸性农田土壤的修复治理。
(2)地肤根系和茎在不同水平Cd 胁迫下的富集系数和转运系数均大于1,茎部是积累Cd 的主要器官。本试验在1.5~9.0 mg·kg-1的Cd 添加量下,pH 6.1土壤中地肤的转运系数高于pH 5.0的土壤,说明土壤基质的酸碱度直接影响地肤的修复效果。
(3)亚细胞水平上Cd 含量分布规律表现为细胞壁>可溶性组分>细胞器。地肤根部细胞器Cd所占比例比茎部低。在0~3.0 mg·kg-1的Cd 胁迫下,pH 6.1的土壤中,Cd 在地肤茎部细胞壁和可溶性组分中的占比高于pH 5.0的土壤。
(4)地肤植株中Cd 的主要赋存形态为醋酸提取态(FHAc)、氯化钠提取态(FNaCl)和乙醇提取态(FE),表明地肤体内的Cd 主要与磷酸盐、果胶酸盐、蛋白质及以硝酸盐、氯化物为主的无机盐等物质相结合,Cd 的这种赋存形态是地肤植株耐受Cd 污染的重要机制之一。

