海洋生境棘孢木霉TCS007 缓解蚕豆干旱胁迫的研究
陈 赛, 倪敏姿, 崔 峰, 陈 杰
(浙江农林大学 林业与生物技术学院 生物农药高效制备技术国家地方联合工程实验室,杭州 311300)
干旱胁迫是影响植物生长、发育和作物产量的主要非生物胁迫之一[1-2]。据报道,仅因干旱造成的作物产量损失就超过所有植物疾病的总和[3]。研究表明,干旱胁迫会诱导植物产生一系列生理和代谢反应,如活性氧 (ROS) 的产生、细胞损伤增加以及抗氧化酶失活等[4],从而影响植物的正常生长发育。
蚕豆Vicia fabaL.为一年生作物,是西北干旱缺水地区的重要食用豆类之一,其播种时间一般在多干旱少雨的10 月初至11 月初[5],因而其产量和质量受到干旱的严重威胁。解决这一问题的主要手段是制定有效的栽培管理办法,如采用滴灌、喷灌、疏通渠道等。此外,通过分子育种获得耐旱新品种是减轻作物受干旱胁迫影响的另一途径,然而育种工作存在耗时长、投入大,短期内难以见效等诸多问题。当前,使用具有促进植物生长、提高植物抗逆性的微生物制剂来增强植物对生物和非生物胁迫的耐受性已成为农业生产中的重要措施[6-7]。
施用生物菌肥可以有效提高植物对极端自然环境的耐受性,在可持续农业的发展中发挥着重要的作用[8]。木霉属Trichodermaspp.根际真菌是一种对农业和环境非常重要的真菌,在促进植物生长发育[9]、诱导植物系统抗性[10-11]以及作为真菌病害的生防剂[12]等方面效用显著。已有研究表明,棘孢木霉T34 能够缓解干旱对玉米种子萌发的影响[13]。此外,接种棘孢木霉GF332 能增加甘蔗对干旱胁迫的耐受性,减少ROS 对甘蔗造成的损害[14]。然而,大多数研究局限于陆生木霉对作物的影响,关于海洋木霉作为促生菌在提高作物抗旱性方面的研究鲜有报道。
TCS007 菌株由本实验室分离自南极海洋沉积物,郑柯斌等[15]通过研究确定了该菌株为具有抗逆性能的棘孢木霉T.asperellum,其对黄瓜和水稻分别具有抗寒和抗盐作用。本研究通过测定干旱胁迫下经TCS007 孢子悬浮液处理的蚕豆株高、株重、根系活力和根重以及植株叶片中光合色素、总糖和总蛋白含量、抗氧化代谢酶活性和植物激素含量等指标,评估TCS007 对蚕豆在干旱胁迫下的影响,以期为该菌株开发成生物菌肥产品提供理论依据。
1 材料与方法
1.1 试验材料与仪器
1.1.1 供试菌株 海洋生境棘孢木霉T.asperellumTCS007 由本实验室分离自南极海洋沉积物,已对其进行培养驯化和复合诱变育种并鉴定,菌株保藏于中国微生物菌种保藏管理委员会普通微生物中心 (CGMCC),保藏号CGMCC No.15677。
1.1.2 供试植物 蚕豆Vicia fabaL.。
1.1.3 试剂与培养基 蒽酮、考马斯亮蓝-G250、植物吲哚乙酸 (IAA) 和脱落酸(S-诱抗素,ABA)酶联免疫分析试剂盒、植物过氧化物酶 (POD) 、超氧化物歧化酶 (SOD) 和丙二醛 (MDA) 酶联免疫分析试剂盒,均购自武汉赛培生物有限公司。马铃薯葡萄糖琼脂 (PDA) 培养基参照文献方法[16]配制,用于TCS007 菌株的培养。
1.1.4 主要仪器 人工气候箱 (上海一恒科学仪器有限公司);紫外分光光度计U2801 (日本日立公司);ME104E1/1000 电子天平 (赛多利斯科学仪器有限公司);SW-CJ-2FD 型洁净工作台 (苏州安泰空气技术有限公司);ZQZY-CF 型振荡培养箱 (上海知楚仪器有限公司);全波长酶标仪 (上海赛默飞世尔科技公司)。
1.2 试验方法
1.2.1 TCS007 孢子悬浮液制备 用无菌水清洗培养7 d 的TCS007 PDA 平板,将得到的菌悬液通过2 层无菌纱布过滤,得到孢子悬浮液,用血球计数板法测定其浓度后,再用无菌水稀释到1 ×1010CFU/mL,备用。
1.2.2 蚕豆苗种植 蚕豆种子在75%的乙醇溶液中浸泡30 min 后,用蒸馏水洗净,转移至清水中浸泡。待种子发芽后播种至大盆中。发芽期结束(约15 d) 后,选取大小一致的蚕豆苗移栽到塑料花盆中,盆中装有2/3 的珍珠岩、蛭石及育苗混合培养基质 (其质量比为1 : 1 : 1) 的营养土,置于人工气候室培养,隔天适量补水。气候室的光照强度设为200 μmol.m-2.s-1,光周期为12 h (光照)/12 h (黑暗),温度为24 ℃ (昼) /21 ℃ (夜),相对湿度为70%。
1.2.3 蚕豆苗处理 待蚕豆种子播种15 d 后出芽期结束时,选取大小一致的蚕豆苗分为4 组。空白对照组 (CK) A 和C 用无菌水、处理组B 和D 用1 × 1010CFU/mL 的TCS007 孢子悬浮液对蚕豆苗进行浸根处理。将蚕豆幼苗根系浸泡在无菌水或TCS007 孢子悬浮液中5 min,随后移栽到盆中,各组浸根用液量均为400 mL。每处理设置15 盆重复,共计60 盆蚕豆幼苗。对处理组C 和D 的蚕豆苗采取中度干旱处理 (土壤水分含量为土壤最大持水量的30%~40%) 15 d。如图1 所示。
1.2.4 土壤水分含量保持 参照高静[17]的方法测量土壤含水量 (W)。称量铝盒,质量记为m1,把采集的湿土样装入铝盒中,称量铝盒及湿土的总质量,记为m2,随后,将装有湿土的铝盒去盖后置于105 ℃恒温干燥箱中烘干。约12 h 后取出铝盒,带盖称量铝盒及干土的总质量,记为m3。按公式 (1) 计算土壤含水量。每一土样至少重复测量3 次。
正常浇水处理:保持土壤含水量为其最大持水量的70%~80%。中度干旱处理:土壤水分含量为其最大持水量的30%~40%。用称重法进行水分控制,每2 d 补充损失水分以控制土壤水分达到处理条件。
1.2.5 蚕豆形态指标测定
株高:采用毫米刻度尺测定幼苗根基部到生长点的距离。
株重:将幼苗从花盆中取出,用自来水洗净(避免伤根)。用纸巾吸去多余水分后称重。
1.2.6 蚕豆根参数测定 参考朱秀云等[18]的方法测定蚕豆的各项根参数指标:根体积采用排水法测定;利用清水反复冲洗根系,再用吸水纸吸干称量根系鲜重;利用烘箱将蚕豆根系烘干至恒重,再称量各处理组根系干重;根系活力采用氯化三苯基四氮唑 (TTC) 法测定。
1.2.7 蚕豆叶片叶绿素含量测定 处理7 d 后,采用分光光度法[19]测定各处理组蚕豆叶片中的叶绿素含量,分别根据公式 (2)~(4) 计算蚕豆苗中叶绿素a、叶绿素b 和总叶绿素的质量浓度,再根据公
式 (5) 统一将其换算为叶绿素含量。
式中:Ca、Cb分别为叶绿素a、b 的质量浓度,mg/L;A为吸光度;CT为总叶绿素质量浓度,mg/L;V为提取液总体积,mL;Chl素为叶绿素含量,mg/g。
1.2.8 蚕豆叶片可溶性糖和可溶性蛋白含量测定
可溶性糖 (soluble sugar, SS) 含量采用蒽酮乙酸乙酯法[20]测定,可溶性蛋白 (soluble protein, SP)含量采用考马斯亮蓝法[21]测定。
1.2.9 蚕豆根、茎和叶中IAA 和ABA 含量测定
采用植物IAA 和ABA 酶联免疫分析试剂盒应用双抗体夹心法[22]分别于干旱处理后1、5、10 和15 d 测定各处理组蚕豆根、茎和叶中 IAA 和ABA的含量。用纯化的IAA 和ABA 抗体包被微孔板制成固相抗体,向包被单抗的微孔中依次加入IAA 和ABA,再与辣根过氧化物酶 (HRP 酶) 标记的IAA 和ABA 抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物 3,3′,5,5′-四甲基联苯胺 (TMB) 显色。TMB 在 HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的IAA 和ABA 呈正相关。用酶标仪在 450 nm 波长下测定吸光度 (OD 值),通过标准曲线计算样品中植物激素IAA 和ABA的质量浓度。
1.2.10 蚕豆根、茎和叶中POD、SOD 活性和MDA
含量测定 采用植物POD 、SOD 和MDA 酶联免疫分析试剂盒,于干旱处理后15 d 分别测定各处理组蚕豆根、茎和叶中的 POD、SOD 活性和MDA 含量。
1.2.11 蚕豆叶片失水率的测定 采用离体测量法[23]测定。于干旱处理后第10 天,取各处理组的蚕豆叶片 (尽量选取每株同一位置的叶片),并于叶片摘取后0、20、40、60、80、100、120、140、160、180 和200 min 分别称量其质量。按公式 (6) 计算失水率 (X)。每处理 3 个重复。
式中:m5表示叶片摘取时的质量,g;m6表示离体叶片在某个离体时间的质量,g。
1.2.12 蚕豆叶片相对含水量测定 分别于处理第1、5、10 和15 天取各处理组蚕豆叶片,测定其鲜重、干重和叶片饱水重,按公式 (7) 计算相对含水量 (RWC)。
式中:m1表示叶片鲜重,g;md表示叶片烘干后恒重,g;mt表示叶片饱水重,g。
1.3 数据统计分析
运用Excel 整理数据,用SPSS 22.0 软件制作相关标准曲线,用Graphpad prism 9 软件对数据进行单因素方差分析 (ANOVA) 与绘图。
2 结果与分析
2.1 TCS007 对蚕豆生长与形态指标的影响
在非干旱胁迫 (图2A) 与干旱胁迫 (图2B) 条件下,用1 × 1010CFU/mL 的TCS007 孢子悬浮液浸根处理15 d 后,蚕豆植株的株高和根系生长相比用无菌水浸根的处理组均有显著提高 (图2),其在干旱胁迫下株高、株重、根鲜重、根干重、根体积和根系活力分别增加了28.7%、42.9%、34.2%、17.1%、39.6%和61.7%;在非干旱胁迫下株高、株重、根鲜重、根干重、根体积和根系活力分别增加了25.5%、15.8%、22.1%、18.4%、34.9%和27.5% (图3)。
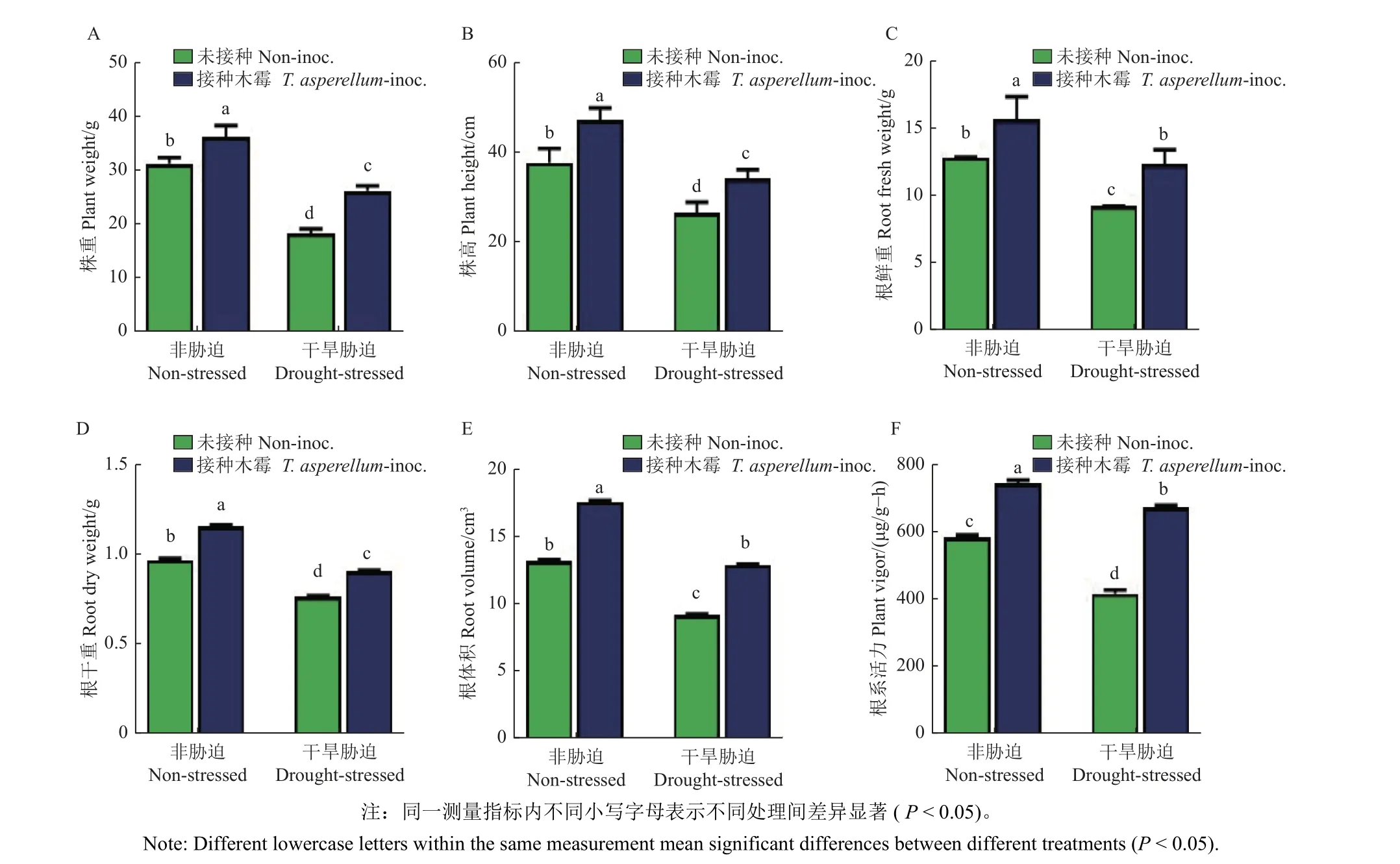
图3 不同处理组蚕豆苗株高 (A)、株重 (B)、根鲜重 (C)、根干重 (D)、根体积 (E) 和根系活力 (F)Fig.3 Plant height (A), plant weight (B), root fresh weight (C), root dry weight (D), root volume (E) and root viability (F) of fava bean seedlings with different treatments
2.2 TCS007 对蚕豆叶片光合色素含量的影响
不同处理组蚕豆叶片的光合色素含量不同。在干旱胁迫条件下,接种TCS007 的蚕豆叶片中叶绿素a、叶绿素b 和总叶绿素的含量较无菌水处理组分别提高了16.0%、42.6%和26.2%。在非干旱胁迫条件下,接种TCS007 的蚕豆叶片中叶绿素b 和总叶绿素的含量,分别提高了15.0% 和8.8%,叶绿素a 的含量无明显变化 (图4)。
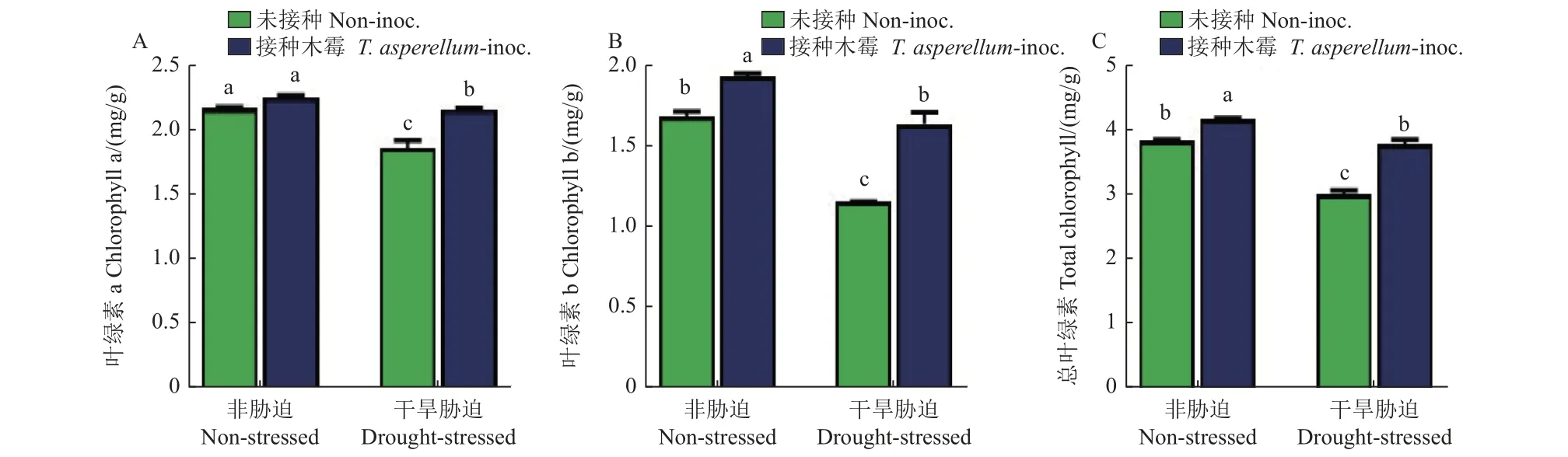
图4 不同处理组蚕豆叶片叶绿素a (A)、叶绿素b (B) 和总叶绿素 (C) 含量Fig.4 Chlorophyll a (A), chlorophyll b (B) and total chlorophyll (C) content in fava bean leaves with different treatments
2.3 TCS007 对蚕豆根、茎和叶中SOD、POD 酶活性和MDA 含量的影响
干旱胁迫下,接种TCS007 能显著提高蚕豆苗根、茎、叶中SOD、POD 的活性并降低MDA的含量,SOD 在蚕豆苗根、茎和叶中分别提高28.8%、13.3%和8.0%,POD 在蚕豆苗根、茎和叶中分别提高10.8%、22.4%和14.8%,MDA 分别降低37.2%、14.7%和12.1%。干旱胁迫组的SOD、POD 活性和MDA 含量均高于非胁迫组。非干旱胁迫条件下,接种TCS007 对蚕豆根、茎和叶的SOD、POD 活性和MDA 含量无明显影响(图5)。

图5 各处理组蚕豆根、茎和叶超氧化物歧化酶 (A)、过氧化物酶 (B) 活性和丙二醛 (C) 含量Fig.5 Superoxide dismutase (A), peroxidase (B) activity and malondialdehyde (C) content in fava bean roots,stems and leaves with different treatments
2.4 TCS007 对蚕豆叶片总糖含量的影响
在干旱胁迫与非胁迫下,蚕豆叶片中总糖的含量在接种TCS007 后1、5、10 和15 d 均显著提高,且非胁迫组总糖含量均高于胁迫组。在干旱胁迫组中,蚕豆叶片在经TCS007 处理后1、5、10、15 d,总糖含量较无菌水处理组分别提高24.6%、42.1%、11.1%和106.0%,相同趋势在非干旱胁迫组中亦被观测到 (图6)。
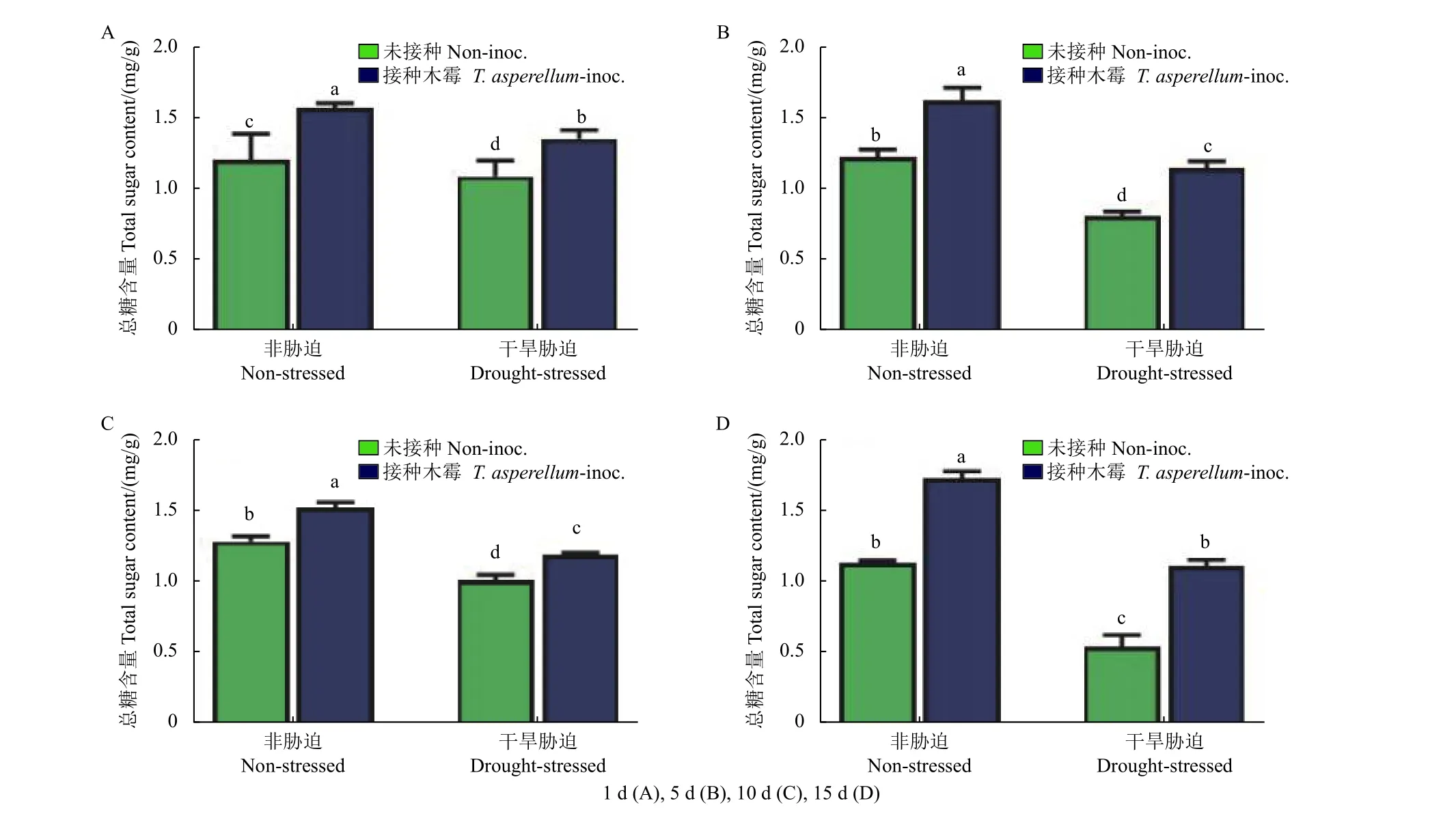
图6 不同处理天数各组蚕豆叶片总糖含量变化Fig.6 Total sugar content in fava bean leaves after different days of treatments
2.5 TCS007 对蚕豆叶片总蛋白含量的影响
在干旱胁迫与非胁迫下,接种TCS007 后第1、5 和10 天,蚕豆苗叶片中总蛋白的含量较无菌水处理组均显著增加。非胁迫组总蛋白含量在第1、10 和15 天均高于胁迫组,而在处理的第5天,胁迫组蛋白含量高于非胁迫组。在接种TCS007后的第1 天,干旱胁迫与非胁迫组总蛋白含量分别增加了68.8% 和39.4%,第5 天分别增加了67.3% 和31.7%,第10 天分别增加了38.0% 和10.2% (图7)。
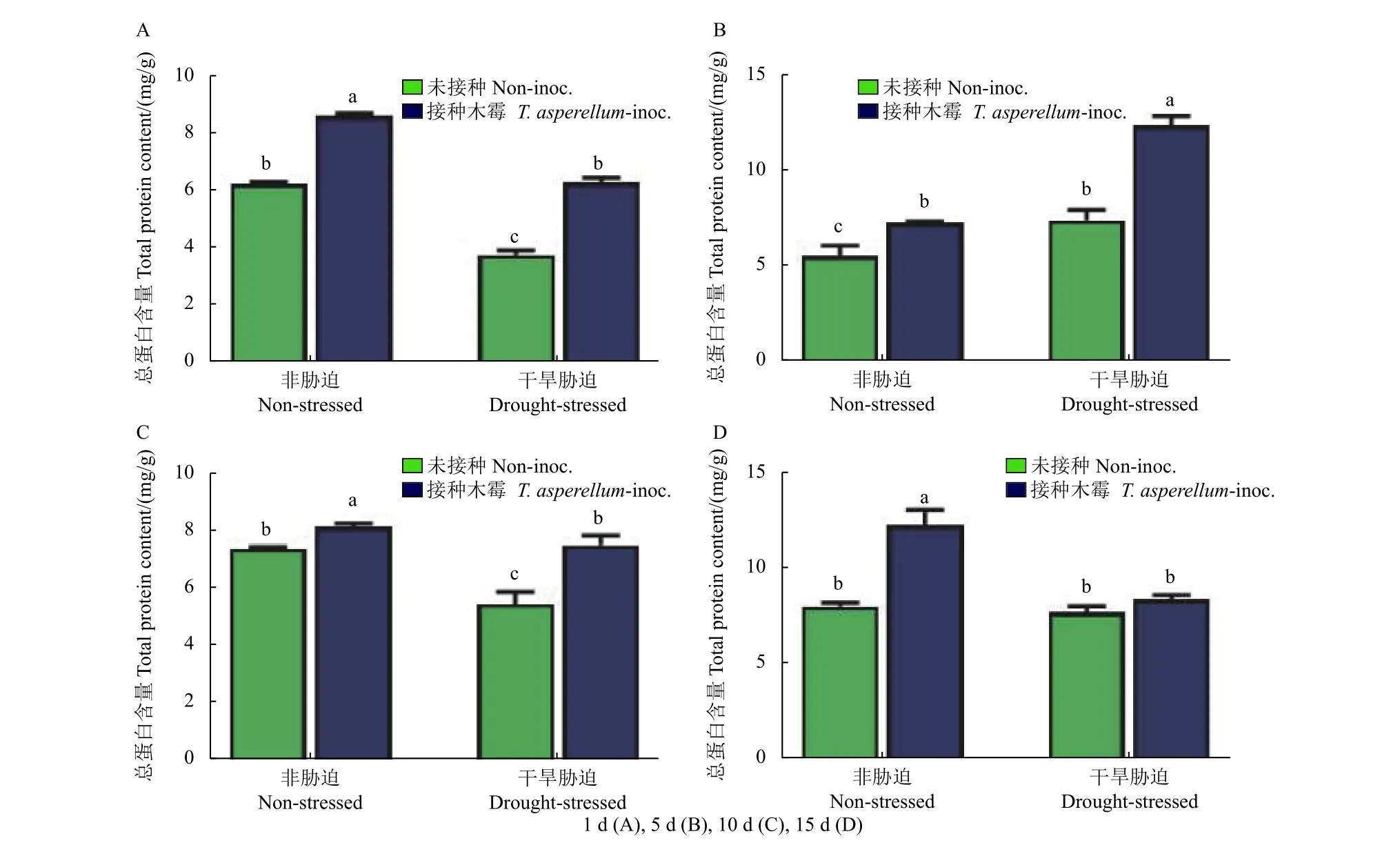
图7 不同处理天数各组蚕豆叶片总蛋白含量变化Fig.7 Total protein content in fava bean leaves after different days of treatments
2.6 TCS007 对蚕豆根、茎和叶中IAA 和ABA含量的影响
无论是在干旱胁迫还是非胁迫下,接种TCS007 在处理初期的第1 和5 天对蚕豆根中IAA 含量均无明显影响,而在接种TCS007 后第10 和15 天,蚕豆根中IAA 含量较无菌水处理组分别增加了29.0%、29.9%和20.9%、41.6% (图8A)。接种TCS007 均显著增加了蚕豆苗根中ABA 的含量,在接种TCS007 后第5 天,干旱胁迫与非胁迫组的ABA 含量分别增加了21.1%和35.7%,第10 天分别增加了33.2%和31.4%,第15 天分别增加了31.4%和21.0% (图8B)。
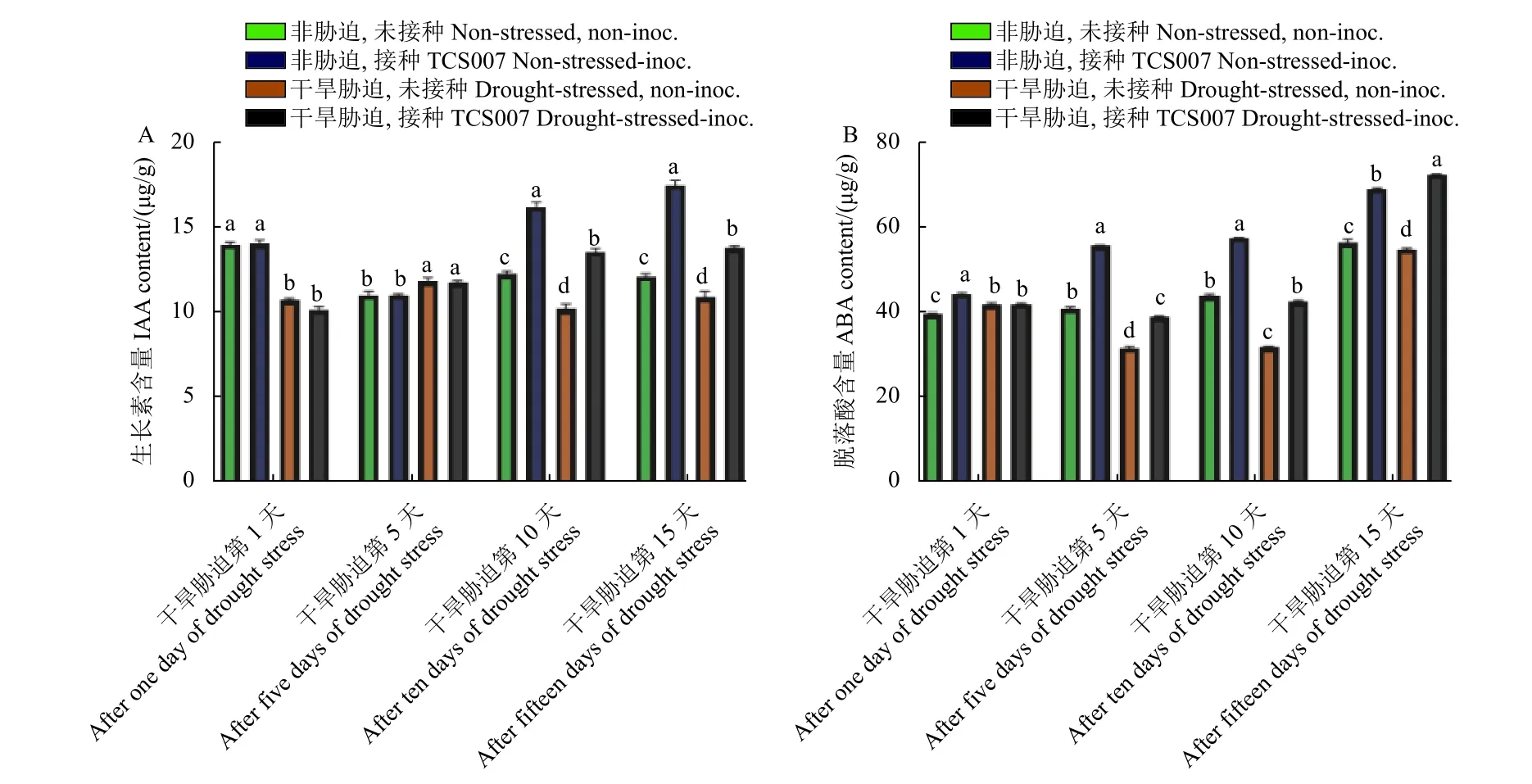
图8 不同处理天数各组蚕豆根中IAA (A) 和ABA (B) 含量变化Fig.8 IAA (A) and ABA content (B) in fava bean roots after different days of treatments
在干旱胁迫下,较无菌水处理组,接种TCS007在处理第1 和5 天都显著增加了蚕豆茎中IAA 的含量,而在处理后第10 和15 天对茎中IAA 含量影响不显著。相反,在非胁迫下,接种TCS007在处理后第1 和5 天无明显影响,而在处理后第10 和15 天显著增加了蚕豆茎中IAA 的含量。在第1 和5 天,干旱胁迫下接种TCS007 其IAA 含量分别增加了37.3% 和19.7%。第10 和15 天,非胁迫下接种TCS007,其IAA 含量分别增加了38.9%和8.9% (图9A)。在干旱胁迫与非胁迫条件下,接种TCS007 的蚕豆茎中ABA 的含量较无菌水处理组在第5 天增加了60.6% 和36.9%,第10 天增加了44.9%和34.6%,且非胁迫组ABA含量均高于胁迫组 (图9B)。
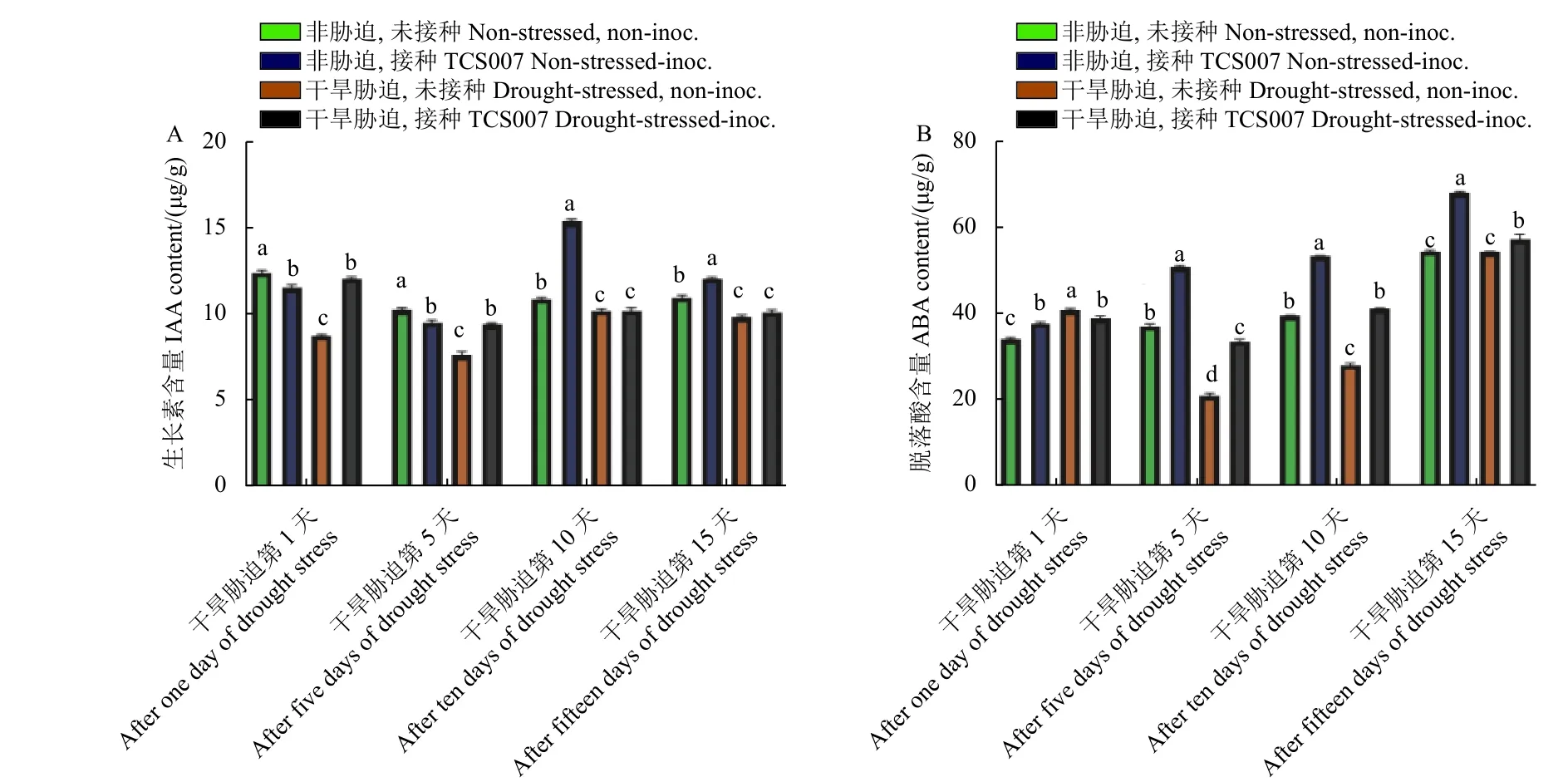
图9 不同处理天数各组蚕豆茎中IAA (A) 和ABA (B) 含量变化Fig.9 IAA (A) and ABA (B) content in fava bean stems after different days of treatments
在干旱胁迫下,接种TCS007 在处理后第1、5、10 和15 天蚕豆叶片中IAA 的含量较无菌水处理组分别增加了17.2%、23.8%、15.7%和11.1%;在非胁迫下,接种TCS007 后第10 和15 天蚕豆叶片中IAA 的含量分别增加了35.5% 和29.4%(图10A)。在干旱胁迫下,接种TCS007 后第1 天对蚕豆叶片中ABA 含量无明显影响,而在第5、10 和15 天,ABA 的含量分别增加了78.7%、28.2%和30.9%;在非干旱胁迫下,接种TCS007的蚕豆叶片中ABA 的含量分别增加了25.9%、37.9%和18.9% (图10B)。

图10 不同处理天数各组蚕豆叶片中IAA (A) 和ABA (B) 含量变化Fig.10 IAA (A) and ABA (B) content in fava bean leaves after different days of treatments
2.7 TCS007 对蚕豆叶片相对含水量和失水率的影响
在干旱胁迫下,随着处理时间的延长各处理组叶片相对含水量逐渐降低,但较于无菌水处理组,接种TCS007 的处理组在处理后第1、5、10、15天蚕豆叶片中的相对含水量分别增加了7.0%、18.9%、11.0%和19.0%;而在非干旱胁迫下,接种TCS007对蚕豆叶片中的相对含水量无明显影响 (图11A)。

图11 不同处理组蚕豆叶片相对含水量(A)和失水率(B) 变化Fig.11 The relative water content (A) and water loss rate (B) in fava bean leaves with different treatments
在干旱胁迫和非胁迫下各处理组的失水率均随着时间的延长而显著增加,但较于无菌水处理组,接种TCS007 的处理组的失水率均低于未接种的处理组 (图11B)。
3 结论与讨论
干旱胁迫是导致植物生理生化变化、影响植物生长和降低作物产量的主要环境胁迫因素之一[2]。据报道,木霉菌可以在非生物胁迫下提高番茄[24]、小麦[6]、水稻[11,25]和玉米[13,26]的产量和质量。本研究结果表明,在干旱胁迫下,TCS007 处理能显著提高蚕豆的株高、株重和根重,且处理组蚕豆植株的光合作用能力、叶片总糖和总蛋白含量、抗氧化代谢能力和植物激素的水平均高于对照组,与前人的研究结果一致。
叶绿素含量被广泛用作衡量作物非生物耐受性的重要指标[27]。处于干旱胁迫下的植物通常由于叶绿素的快速降解而表现出明显的黄化[6],导致植物生长迟缓。本研究结果显示,蚕豆植株中的叶绿素含量在干旱胁迫条件下显著低于非胁迫条件下,而接种TCS007 的蚕豆植株中叶绿素含量均显著高于对照组,由此推测接种TCS007 可能通过提高蚕豆的光合作用效率而促进其生长。接种TCS007 的植株中总糖和总蛋白含量显著高于对照组,这一现象的发生可能是由于TCS007 促进了蚕豆根部对养分的吸收,且碳水化合物作为渗透保护剂和信号分子,可与抗氧化代谢协同作用而减轻干旱胁迫对蚕豆所造成的负面影响[28-29],因此,蚕豆组织中总糖和总蛋白含量的增加能提高其在干旱胁迫下的耐受性。
干旱胁迫下,在接种TCS007 的蚕豆植株中,叶绿素降解的减少和光合作用效率的增加也可能与抗氧化系统抗性的增加有关。植物在受到干旱胁迫刺激时会产生ROS,而ROS 的过量产生会导致植物蛋白质、核酸等大分子和细胞结构的损害[30],并形成具有细胞毒性的氧化终产物MDA。本研究评估了蚕豆植株中抗氧化酶SOD、POD 的活性和MDA 含量。接种TCS007 能在干旱胁迫条件下显著提高蚕豆根、茎和叶中SOD、POD 的活性并降低MDA 的含量。由此推测蚕豆植株中SOD、POD 活性的增加可以帮助清除ROS 自由基并保护植物细胞免受氧化[6],从而提高蚕豆对非生物胁迫的抗性。
木霉属真菌 (Trichodermaspp.) 被认为是植物激素合成器,其产生的化合物有助于与植物激素IAA 共同促进植物细胞壁的扩张[8],并能促进根和小根的发育以及对水和养分的吸收,从而增加植物地上部的干重[10]。木霉菌除了能诱导宿主体内激素合成外,它们自己还会产生少量的植物激素来提高植物的抗逆性。有研究表明,哈茨木霉T115 和绿木霉T49 可以在添加或不添加色氨酸的培养基中产生不同水平的植物激素ABA、IAA、水杨酸 (SA)、赤霉素 (GA1和GA4)[31]。棘孢木霉也能在培养基中培养时分泌ABA、IAA 和GA,其对黄瓜幼苗生长有促进作用和缓解盐胁迫的影响[32]。因此,产生ABA 和IAA 的木霉可以促进寄主植物的生长和减轻非生物胁迫的不利影响,本研究结果表明,无论是在干旱胁迫还是非胁迫下,接种TCS007 都可以在不同时期显著增加蚕豆根、茎和叶中IAA 和ABA 的含量。因此,推测接种TCS007 可以促进蚕豆根部对水分和养分的吸收,从而提高蚕豆的株高和根重。ABA 是一种重要的植物激素,与气孔开闭运动的调节有关,当植物叶片中的ABA 达到一定含量时,其能调节气孔关闭,从而调控叶片的蒸腾速率[30]。蚕豆气孔导度的变化也可以从蚕豆叶片相对含水量和失水率的结果中得到印证。在干旱胁迫下,相较于CK,接种TCS007 在处理过程中均能显著增加蚕豆叶片的相对含水量。在干旱胁迫和非胁迫下各处理组的失水速率均随着时间的延长而显著增加,但相较于CK,接种TCS007 的处理组的失水速率均低于未接种的处理组。接种TCS007 能增加蚕豆ABA 含量,使之能够获得较高的气体交换效率,减轻干旱胁迫的威胁,从而促进蚕豆地下和地上部的发育。
综上所述,接种TCS007 能促进蚕豆的生长发育,显著增加蚕豆的株高、株重、根重、根体积和根系活力,且接种TCS007 可显著提高蚕豆的叶绿素含量、叶片总糖、总蛋白含量、水分利用效率、抗氧化酶活性和植物激素水平从而增强蚕豆对干旱胁迫的耐受性。由此可见,TCS007 具有促进蚕豆生长提高其抗旱性的作用,具有开发成生物木霉制剂的潜力,而这种作用是否具有普遍性和田间条件下的适用性还有待深入探究,以验证TCS007 在田间对蚕豆植株等其它作物靶标的作用。