土壤微生态系统中3,6-二氯咔唑对土壤酶活性的影响
马 云,胡官营,周彬彬
(浙江工业大学 环境学院,浙江 杭州 310032)
多卤代咔唑(polyhalogenated carbazoles,PHCZs)作为一种新型的持久性有机污染物越来越受到人们关注[1],已被证实存在于土壤、沉积物、空气和灰尘中[2],它们分布广,具有类二噁英的毒性[3]、生物蓄积和生物持久性。了解卤代咔唑的来源对于在环境中的迁移转化有着重要作用,Wang等[4]发现卤代咔唑来源于靛蓝染料和光电材料的生产。Fromme等[5]发现在同一样本中其质量浓度高于许多传统有机污染物,如多环芳烃和多溴联苯醚,因此它们在土壤中的行为值得我们关注。PHCZs在土壤中以高浓度的形式存在且相对稳定,目前,针对PHCZs对土壤酶性质的影响的研究较匮乏。土壤中微生物可快速响应环境压力,并对污染物敏感[7],已被广泛用于土壤健康和质量研究中[8]。笔者选择3,6-二氯咔唑作为代表PHCZs(因其高检出率和浓度),探究蚯蚓和大豆存在的土壤微生态系统中对土壤脱氢酶、蔗糖酶和脲酶活性的影响。
1 材料与方法
1.1 实验材料
实验土壤采自江苏省淮安市农田田园种植土,土样风干后,过20目筛备用,未检测到土壤中存在3,6-CCZ。
选用赤子爱胜蚓(Eiseniafetida)作为土壤模式动物,购于浙江省杭州市凤起花鸟市场。正式实验前,选取个体生长情况类似、环带明显的健康的蚯蚓置于干净的培养皿中,用保鲜膜封口,并用针在保鲜膜上扎数个小孔防止逃逸,然后放置于人工气候箱中清肠24 h。清肠结束后,用超纯水冲洗表面的排泄物,并挑选具有活力的个体备用。
选用大豆作为土壤模式植物,该大豆适合种植于黄淮平原、长江三角洲和江汉平原,春播生育期90~100 d,种子放于室温中并干燥避光保存备用,待实验开始时采用点播的方式种植。
1.2 实验方法与设计
土壤酶活性测定实验总共设置4个实验组(C,E,P,EP),每个实验组设置3个3,6-CCZ质量分数分别为0,0.1,1 μg/g,每组设置3个平行组。实验组C为空白对照组,主要研究不同浓度3,6-CCZ对土壤酶活性的影响;实验组E为只添加蚯蚓组,主要研究蚯蚓的添加对不同质量分数3,6-CCZ暴露下土壤酶活性的影响;实验组P为只种植大豆组,主要研究大豆的种植对不同质量分数3,6-CCZ暴露下土壤酶活性的影响;实验组EP为有蚯蚓有大豆的联合组,主要研究在蚯蚓和大豆同时存在对不同浓度3,6-CCZ暴露下土壤酶活性的影响。实验周期为60 d。种植花盆口径18 cm,高16 cm,将种植土置于人工气候箱中,温度设置(25±1)℃,湿度为(75±5)%,光照比16 h/8 h,需保持通风,每日需要添加适量的去离子水来保持土壤的湿度,将其土壤湿度控制在30%。
具体操作如下:准确称取0.0150 g的3,6-CCZ粉末,用30 mL丙酮定容至棕色容量瓶中,制成质量浓度为500 mg/L的母液,于4 ℃冰箱中保存备用。将风干的种植土进行过筛,称取2 kg,往里加3,6-CCZ溶液,使其土壤里的3,6-CCZ的质量分数为0,0.1,1 μg/g,用移液枪分别吸取上述配置好的母液4 mL和0.4 mL于称好的2 kg土壤中用机械搅拌器搅拌30 min。在0.1 μg/g实验组中,加入3.6 mL的丙酮,以保证实验组所加的体积相同。加入适量超纯水,继续搅拌,以确保3,6-CCZ与土壤有效混合,土壤湿度保持在30%。实验组C仅添加相同体积的丙酮;实验组E和EP分别加入上述处理好的40条蚯蚓;实验组P和EP每组中放入5颗饱满均匀的大豆种子,以0.3% H2O2消毒后,用超纯水再冲洗3次,以去除表面残留的H2O2,后以点播的方式种植大豆。待E组和EP组中蚯蚓完全钻入土壤后,置于人工气候箱中,温度设置25 ℃,光照比为16 h/8 h,保持通风。每日添加适量的去离子水以保持土壤湿度,在此期间要及时观察大豆种子的发芽情况,蚯蚓的生长情况,及时去除死亡蚯蚓防止产生霉菌。分别于第7,14,21,28,42,60天收集土壤样品-20 ℃保存,待测土壤酶活性。
1.3 土壤酶活性测定方法
土壤脱氢酶、蔗糖酶和脲酶活性测定采用比色法,使用紫外分光光度计测定。具体步骤参照文献[9],通常吸光度越大,土壤酶活性越大。
1.4 数据处理
统计分析使用SPSS(Version 23.0)进行处理,经过统计分析的数据使用Origin2018作图。
2 结果与讨论
2.1 3,6-CCZ对土壤脱氢酶活性的影响
土壤脱氢酶活性变化趋势如图1所示。图1中:*表示P<0.05;** 表示P<0.01。在第7天时,对照组C中,低质量分数实验组(0.1 μg/g)中土壤脱氢酶与空白实验(0 μg/g)相比,起到了促进作用,土壤酶活性显著上升了76.5%,而高质量分数实验组(1 μg/g)中土壤脱氢酶活性也起到促进作用,酶活性上升了29%,促进作用程度低于低质量分数实验组,相比较,高质量分数的实验组削弱了对脱氢酶的活性增强作用。蚯蚓组E中,高质量分数实验组中土壤脱氢酶活性与空白对照组中酶活性趋势比较类似,在实验前期第7~21天,酶活性是呈现上升趋势,在第21天时达到最大值,随着实验的进行,土壤脱氢酶活性虽然呈现了下降的趋势,但是在低质量分数实验组中到28 d酶活性达到了最大值,蚯蚓的添加和3,6-CCZ的暴露使土壤脱氢酶活性得到了显著刺激;植物组P和蚯蚓-植物联合组EP的土壤酶活性与对照组相比,脱氢酶活性在3,6-CCZ影响下呈下降趋势;随着实验的进行,在第60天时,各质量分数的处理组C,P,EP组的土壤脱氢酶活性相似,只有E组土壤脱氢酶活性仍显著高于其他处理组。在3,6-CCZ的暴露下,与空白对照相比,低质量分数组E组有显著性差异(P<0.05)且第14,21,28天显著性差异最大(P<0.01),P组在第14,42,60天有显著性差异(P<0.05)且60 d差异性最大(P<0.01),EP组也呈现了显著性差异(P<0.05)。综上,3,6-CCZ的暴露抑制了土壤脱氢酶的活性,随着实验进行,土壤脱氢酶活性先升高后降低,实验后期无明显差异,这与Shi等[10]发现的结果一致,这是由于土壤脱氢酶是一种胞内酶,仅存在于活细胞中,与微生物的数量和代谢活性有关。蚯蚓的添加在实验前期极大的促进了土壤脱氢酶活性,有效改善3,6-CCZ的暴露对土壤脱氢酶的抑制作用。这可能是由于蚯蚓作为土壤中生物量最大的无脊椎生物,可以通过挖洞行为和自身分泌物来调节土壤pH,对土壤的结构和肥力有着重要的作用,有助于土壤微生物的生长,从而有利于土壤脱氢酶活性的上升[11]。大豆的种植虽然并没有明显体现出促进或抑制作用,但在一定程度上体现出可缓解3,6-CCZ和蚯蚓对土壤脱氢酶的刺激,这是由于在大豆的生长发育过程中,大豆根系释放有机化合物可能对污染土壤进行修复作用,这些有机化合物可能是土壤微生物生命活动的主要来源,从而使土壤脱氢酶活性相对稳定[12]。
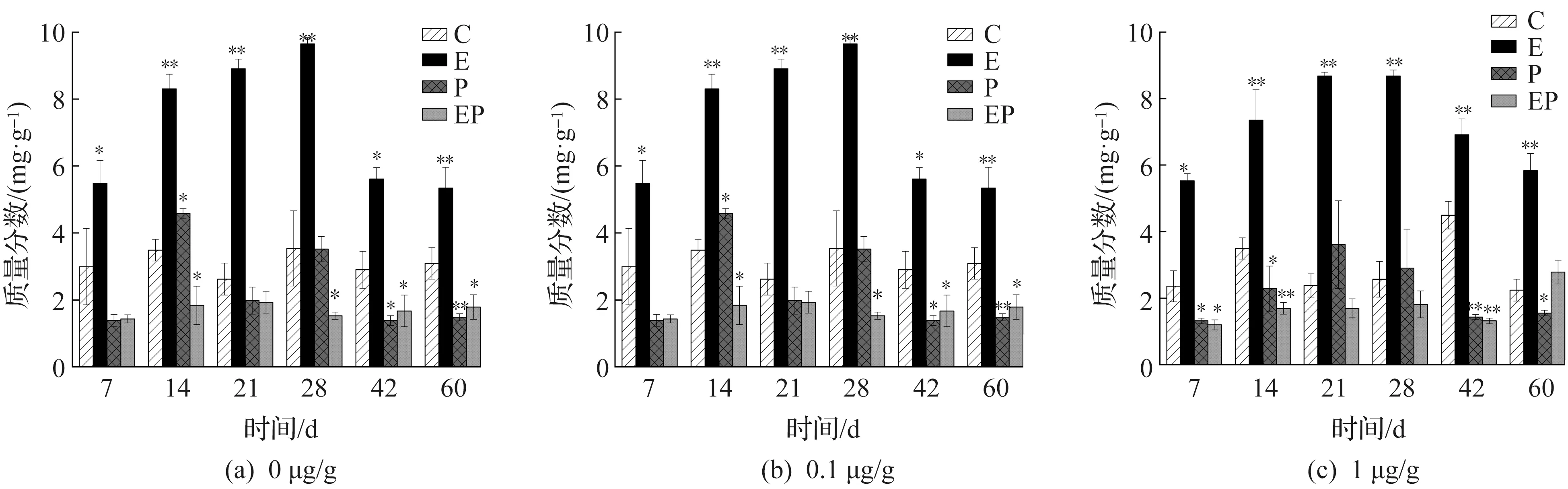
图1 不同质量分数3,6-CCZ对土壤脱氢酶活性的影响
2.2 3,6-CCZ对土壤脲酶活性的影响
土壤脲酶活性的变化趋势如图2所示。图2中:*表示P<0.05;** 表示P<0.01。在第7 d时,对照组C中,低质量分数实验组(0.1 μg/g)中的土壤脲酶活性与空白实验(0 μg/g)组相比,起到了促进作用,酶活性上升了7.4%,随着质量分数的增大,在高质量分数实验组(1 μg/g)中的脲酶活性起到促进作用,酶活性上升了39.4%,促进作用程度比低质量分数实验组高。蚯蚓组E中,低质量分数实验组中的土壤脲酶活性与高质量分数实验组和空白组实验组的表现不同,低质量分数实验组呈现了先下降后上升的趋势,其余两个实验组则表现出相反的趋势,先上升后下降,这表明蚯蚓的加入可能在实验前期会刺激土壤脲酶活性的变化,然而3,6-CCZ的暴露会抑制这种变化,在低质量分数实验组中比较明显。植物组P中,空白组与高质量分数实验组中土壤脲酶活性趋势基本依旧相似,实验前期第7~28天先上升,实验后期第28~60天表现出下降,且在第28天时土壤脲酶活性达到最高水平,而低质量分数实验组与E组中土壤脲酶活性趋势相似,与对照组表现出显著性差异(P<0.05)。联合组EP中,两组实验组都呈现出了先上升后下降的趋势,随着实验进行,实验结束时第60天,只有EP组中土壤脲酶活性相似,C,E,P组中土壤脲酶活性大小关系:低质量分数组>高质量分数组>空白对照组。随着3,6-CCZ暴露质量分数增加,实验组与空白组有显著性差异(P<0.05),在低质量分数实验组中,与对照组相比,E组和P组在第7天差异性最大(P<0.01),而EP组则在第60天时达到差异性最大(P<0.01);在高质量分数实验组中,与对照组相比,E组差异性最大体现在实验后期(42~60 d),而P组和EP组在第7天就有显著性差异且为最大差异(P<0.01)。Li等[13]发现,脲酶是一种胞外酶,虽然可与土壤胶体结合形成土酶或者腐殖质酶复合物,进一步保护脲酶活性,但是可以发现低质量分数的3,6-CCZ暴露会促进土壤脲酶活性。土壤酶活性代表着微生物群落的总体特征[14],蚯蚓的添加和大豆的种植能够使土壤微生物群落显著增加。随着实验进行,蚯蚓的加入可以影响到土壤脲酶活性,这是因为蚯蚓可以通过与土壤微生物的作用对污染的土壤进行修复[15],大豆的种植虽然并未明显影响土壤脲酶活性,但是在一定程度上降低了3,6-CCZ对土壤脲酶活性的刺激。

图2 不同质量分数3,6-CCZ对土壤脲酶活性的影响
2.3 3,6-CCZ对土壤蔗糖酶活性的影响
土壤蔗糖酶活性的变化趋势如图3所示。图3中:*表示P<0.05;** 表示P<0.01。在第7天时,对照组C中,低质量分数实验组(0.1 μg/g)中的土壤蔗糖酶活性与空白实验(0 μg/g)相比,起到了促进作用,酶活性上升了约50%,随着3,6-CCZ暴露的质量分数增大,在高质量分数实验组(1 μg/g)中土壤蔗糖酶起到了抑制作用,酶活性下降了2.7%。从整体实验周期来看,3,6-CCZ暴露的两组实验组中的酶活性变化趋势相似,都是先上升后下降。在空白实验组中,E组中土壤蔗糖酶活性持续上升,得到了显著的刺激,在第28天达到最高水平,与对照组C相比具有显著性差异(P<0.05)。在低质量分数实验组中,E组中土壤蔗糖酶活性显著高于其他处理组,与对照组在第7~28天显著性就达到最大(P<0.01),随后显著性越来越小,P组在第7天和第14天中,显著性差异明显(P<0.05),且土壤蔗糖酶活性与E组变化趋势相同,到第60天时,与对照组没有显著性差异;EP组在第7天凸显出显著性差异(P<0.05),且整个实验过程中,土壤蔗糖酶活性变化不大,实验结束时,各个处理组之间酶活性基本一致。在高质量分数实验组中,只有E组表现出显著性差异(P<0.05),在第28天达到最高水平,且酶活性变化趋势与低质量分数实验组相同,而其余处理组均与空白组相似,呈现出上升趋势。Shen等[16]用菲处理水稻,发现实验前期土壤蔗糖酶活性有刺激作用,随着实验进行又恢复到控制水平,与笔者研究结果一致。在Lipinska等[17]的研究中,PAHs对土壤酶活性表现出刺激作用。综上,蚯蚓的添加可以明显促进土壤蔗糖酶活性的上升,随着实验进行,蚯蚓对土壤蔗糖酶活性的刺激显著减弱,可能是蚯蚓已经适应该土壤环境。大豆的种植虽然在一定程度上促进土壤蔗糖酶活性上升,但是随着3,6-CCZ暴露质量分数增加,大豆的生长并不能促进土壤酶活性,这是由于大豆虽然具有固氮作用[18],能有效改善土壤微生物活性,促进土壤蔗糖酶的活性,但是3,6-CCZ的暴露明显会抑制大豆的固氮作用,从而抑制土壤酶活性。

图3 不同质量分数3,6-CCZ对土壤蔗糖酶活性的影响
3 结 论
土壤微生态系统中3,6-CCZ的存在会对土壤酶活性产生一定的影响,其虽然会对土壤酶活性有增强作用,但是随着质量分数增加,会削弱对土壤酶活性的增强作用,这主要是由于3,6-CCZ的暴露对土壤微生物的影响较大。实验前期,蚯蚓的添加会显著提高土壤中脱氢酶、脲酶和蔗糖酶的活性。大豆的种植对土壤酶的活性虽然没有表现出显著的促进或抑制作用,但是在一定程度上降低了3,6-CCZ对土壤脲酶活性的刺激作用。在低质量分数情况下,大豆的生长虽然提高了土壤蔗糖酶的活性,但是随着质量分数的增加,则会产生削弱作用。蚯蚓和大豆同时存在虽然不能缓解3,6-CCZ对土壤脱氢酶和脲酶的抑制作用,但是却能有效削弱蚯蚓和3,6-CCZ对土壤酶活性增强作用,从而维持土壤生态系统的稳定。

