腹腔镜下腹壁肌后修补术治疗腹壁疝疗效分析
王 涛,王平江,徐 栋
1.淄博市中心医院普通外科,山东 淄博 255036;2.淄博市市立医院普外一科,山东 淄博 255400
腹壁是由包裹腹腔内脏器的腹壁肌肉纤维组织构成,而所谓的腹壁疝是腹腔内脏器或腹膜前脂肪组织通过腹壁的缺损或者薄弱部位向外突出所致。根据发病机理和病因可分为原发性腹壁疝和继发性腹壁疝,其中原发性腹壁疝包括脐疝、白线疝、半月线疝、腰疝等;继发性腹壁疝可分为腹壁切口疝、外伤性腹壁疝、造口旁疝等。
目前针对腹壁疝的手术治疗,存在以下几种。最经典的手术方式为开放肌后(sublay)补片修补术,即所谓的river-stoppa repair 术式[1];目前应用最广的腹腔镜补片修补术主要为腹腔内补片植入术(IPOM)[2]。随着微创观念的深入,进一步提出了微小切口开放sublay 补片修补术(MILOS)[3]。然而,经典的开放式sublay 补片修补术存在手术切口感染风险,一旦感染有诱发补片感染导致手术失败可能,同时大切口存在术后疼痛、创伤大及美容效果差等问题[4-5]。采用IPOM 术式,虽然保留了微创的优势,但其需用高值防粘连补片及钛钉等固定装置,既增加了患者的医疗费用,同时也带来了腹腔肠管粘连、梗阻、漏、术后疼痛等风险[5-6]。即使采用MILOS 术式,根据国外相关文献报道,手术平均切口长度也在5.2 cm[7]。而我国相关数据显示,其手术切口长度在2.76~7.02 cm 之间[8],仍然无法真正实现微创理念,且手术操作步骤操作复杂,甚至需应用腹腔镜辅助操作,进而演变为杂交手术。腹腔镜下腹壁肌后修补术(ESR),是一个比较宽泛的腹壁疝手术概念,根据手术径路分为全腹膜外和经腹腔径路,可以把近几年出现的众多手术方式包含在内。本研究采用腹腔镜下经腹膜外径路或经腹腔径路或二者联合应用,创建一个大的腹膜外空间,进而放置补片,加强腹壁强度,取得了良好的治疗效果。现将结果报告如下。
1 对象与方法
1.1 研究对象
选取2017 年11 月—2019 年10 月淄博市中心医院、淄博市市立医院收治的26 例腹壁疝患者,接受ESR 手术治疗。术前采用64 排腹部CT 检查进一步诊断及评估疝缺损长径及疝内容物。本组26例患者,其中男性为9例,女性为17 例;平均年龄(62.5±12.3)岁;脐疝5 例,白线疝6例,脐疝合并白线疝1 例,腰疝1 例,切口疝13 例,其中切口疝患者既往手术史包括行胃肠手术5 例,肝胆手术5例,妇科手术3例;疝缺损长径(2.73±1.15)cm ;ASA分级(1.15±0.37);手术时间(125.6±33.24)min;住院时间(5.92±1.87)d;术后VAS 评分(2.26±0.92)分;闭式负压引流时间(6.22±3.67)d;手术部位感染1 例,早期疼痛3 例,早期腹胀2 例;随访时间(4.42±2.08)个月,术后无长期并发症。
1.2 方法
按照欧洲疝学会切口疝分类(2008年版)[9],将腹壁疝划分为中线区(M)及侧方区(L)腹壁疝。(1)根据疝所在中线区的位置,范围上至剑突,下至耻骨,两侧为腹直肌鞘外侧缘。分为:①M1 区(即剑突下),自剑突下3 cm;②M2 区(即上腹部),自剑突下3 cm 至脐部上方3 cm;③M3区(即脐部),自脐上3 cm至脐下3 cm;④M4区(即脐下),自脐下3 cm 至耻骨联合上方3 cm;⑤M5 区(即耻骨上),自耻骨联合向上3 cm。(2)根据疝所在侧区位置,范围上为肋弓,下为腹股沟区,内为腹直肌鞘外缘,外为腰区。分为:①L1 区(肋缘下),自肋弓缘至脐水平上3 cm;②L2 区(肋腹部)为脐水平上下3 cm 腹直肌外侧至腋前线;③L3 区(髂部),自脐水平下3 cm 至腹股沟区;④L4 区(腰部),为腋前线外侧背部区域。现将我院收治26 例患者,根据部位分为M2 区4 例,M3 区10 例,M4 区1 例,M1+M2 区2 例,M2+M3 区1 例,M3+M4 区4 例,L3 区3 例,L4 区1 例。手术器械:10 mm 的30°2D腹腔镜,常规腹腔镜手术器械。根据疝缺损位置不同,选择不同的观察孔和操作孔。正确的操作孔对手术的安全是十分重要的。操作孔的设计应以疝缺损部位为中心的假想圆弧上,所有的操作孔距离疝缺损部位10 cm 以上,见图1、2。

图1 观察孔布局

图2 操作孔布局
2 手术步骤
ESR 手术操作可分经腹腔径路术式和全膜外径路术式。前者手术操作与腹腔镜疝修补术(TAPP)类似,进入腹腔后还纳疝内容物,然后切开疝缺损周边腹膜,游离腹膜瓣,充分建立腹膜前间隙,将补片置入此间隙后,缝合关闭腹膜。手术操作步骤如下。(1)建立腹壁肌后间隙:于观察孔处做10 mm切口,分离钳分离皮下脂肪层。置入两把甲状腺小拉钩牵拉皮肤,充分暴露腹直肌前鞘。尖刀片切开前鞘,长约10 mm,提起前鞘,分离钳将下方腹直肌向一侧方向分离,暴露腹直肌后鞘。置入甲状腺小拉钩牵拉建立直视下腹壁肌后间隙,经此间隙置入10 mm trocar。连接气腹机,成功建立气腹。置入腹腔镜,采用镜推法继续扩大肌后间隙。分别于预定操作孔处做5 mm 切口,穿刺置入5 mm trocar。经操作孔置入分离钳及电钩,分离时分离钳对抗牵拉,充分暴露,电钩进行精细分离,注意层次,防止暴力将腹膜撕破,影响操作。(2)游离间隙:根据疝位置不同,中线位腹壁疝自下向上头侧分离(类似于逆行TEP 术式),常见腹壁疝为脐疝、白线疝及上腹壁切口疝。进入间隙后沿腹直肌纤维走行方向分离,分离过程中注意辨认腹直肌后鞘,两侧的分离边界为半月线,分离至弓状线时要小心操作,此处解剖结构(腹膜、腹横筋膜、腹直肌后鞘)愈合较致密,稍有不慎易致腹膜撕破。腹膜破裂者可在间隙游离完成后予以可吸收线缝合关闭,小的破损(<1 cm)可用钛夹或hemo-lock 夹予以夹毕。于白线两侧打开后鞘,进入肌后间隙继续向上游离,注意保护两侧的血管神经束。后鞘打开者缝合张力小者也可在后续手术中予以2-0 倒刺线缝合关闭,如果缝合张力过大,可不必勉强缝合,以免术后腹胀发生。向上分离至剑突附近,肝圆韧带附着处,腹膜外脂肪增多增厚,该脂肪垫为上界重要解剖学标志。中线位腹壁疝自上向下足侧分离(类似于TEP 术式),常见下腹壁切口疝。分离过程中注意的解剖学标志为两侧腹壁下血管,分离时小心操作,防止出血影响术野。继续向下分离,进入耻骨膀胱间隙(Retzius 间隙),解剖暴露耻骨联合及耻骨梳韧带,注意避让死亡冠。耻骨联合为该间隙另一重要解剖学标志。继续向两侧分离则可进入Bogros 间隙和髂窝间隙,如需进一步分离注意不要损伤此处的股外侧皮神经和生殖股神经股支。对于侧区腹壁疝自健侧腹壁向患侧腹壁方向分离。越过半月线,可联合侧方腹横肌释放技术(TAR)[10],切断一部分腹横肌,继续向外侧分离至腋中线或腋后线直至后腹膜间隙,进而腹壁张力得以降低,产生更大游离空间。以利于疝缺损的关闭。见图3~图5。(3)疝囊处理:根据疝囊的大小可选择充分游离,如疝囊较大,可将其横断。原则上以不损伤疝内容物为目的,故并不强求完整游离。常见疝内容物为大网膜或腹膜外脂肪组织,少见为部分肠管。还纳疝内容物。疝囊破损者可予以2-0 倒刺线缝合关闭,注意勿损伤腹腔脏器。(4)关闭疝缺损:选用0 号PDS-II 缝线用带线穿刺器透壁缝合关闭,也可选择免打结的倒刺线缝合关闭,或根据疝缺损的数目及大小联合应用。注意关闭疝环时适当降低气腹压力到6~8 mmHg(1 mmHg=0.133 kPa),方便缝合打结及避免撕裂腹壁组织[11]。(5)补片置入及固定:将修补材料卷曲后经观察孔置入腹壁肌后间隙,予以调整后充分展平覆盖于关闭疝缺损下方,四周至少超过缺损5 cm。补片的固定方式有单纯医用胶水固定、单纯缝线悬吊固定、单纯钛钉固定、单纯自固定补片应用、钛钉与医用胶水或缝线悬吊的联合应用等,具体固定方式根据术中情况选择应用。(6)

图3 注意腹直肌后鞘,游离肌后间隙
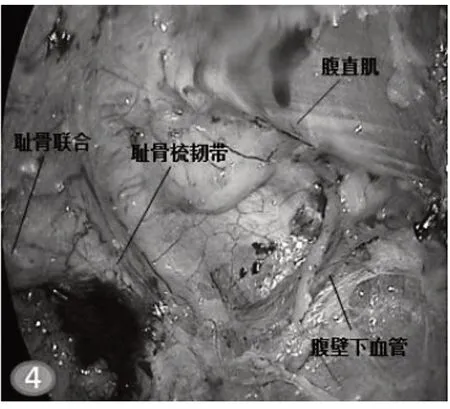
图4 注意血管,分离Retzius间隙
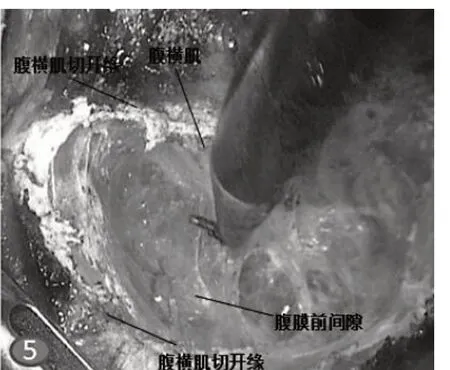
图5 腹横肌释放技术(TAR)
术野检查:检查术野是否干净,有无明显渗血,充分止血后,一般需常规放置密封式负压引流管。关闭气腹,放气退出镜头,缝合关闭切口,术毕。
患者术中相关操作情况:7 例联合TAR 技术;25 例疝囊处理采取游离方式,1例采取横断方式;15例腹膜打开;18 例腹直肌后鞘缝合;25 例疝缺损关闭,其中18 例钩针带线缝合,6 例单纯缝合,1 例钩针带线+缝合;24 例术中补片选择美国强生公司超普平片UltraproTM,1 例选择法国柯惠公司自固定修补材料ProGripTM;17 例补片固定方式采取医用胶水,1 例悬吊固定,4 例钛钉+医用胶水,1例钛钉+悬吊固定,1例自固定补片,2例钛钉固定。
3 结果
26例腹腔镜腹壁疝修补术均取得成功,无中转开放手术。手术时间为(125.6±33.24)min,术后第2 d开始进食,术后72 h 视觉模拟疼痛评分(VAS)为(2.26±0.92)分,住院时间为(5.92±1.87)d,术后18 例放置闭式负压引流管时间为(4.31±4.21)d。术后早期疼痛不适3例,早期出现腹胀不适2例,浅表手术部位切口感染1例,术区出现血清肿3例,均经非手术治疗后好转。术后随访患者(4.42±2.08)个月,无疝复发、出血、补片感染、肠瘘、慢性疼痛(VAS>3分,时间>3个月)等严重并发症。
4 讨论
腹壁疝是疝腹壁外科常见的临床疾病,最佳治疗的方式是通过手术治愈。随着无张力疝修补术及微创概念的产生,结合疝修补材料发展应用,目前腹腔镜无张力疝修补术逐步扩大推广。根据腹壁解剖层次不同,目前可将修补材料放置腹部不同层次,根据指南目前划分为:腹壁肌肉前、腹壁肌肉后和腹腔内[12]。而根据修补的层次不同,目前手术方式多种多样,但目前应用最为广泛的当属腹腔内放置补片修补[13]。但随着研究的发现,在腹壁肌后间隙放置补片,由于腹壁肌后血供丰富,更有利于周围组织长入补片,从而牢靠了补片的固定,增加了可靠的腹壁强度,同时良好的血供也可降低可补片感染的风险[14]。
开放肌后手术虽然可以应用补片来加强腹部强度,达到无张力疝修补的目的,但面临的风险也相应增加,如大切口创伤大,破坏了补片前方的腹壁强度,术后也有切口感染、术区疼痛,影响术后活动等问题。随着疝补片的发展,LeBlance 等[15]将防粘连补片应用到腹腔镜腹壁疝修补术,将补片固定于腹腔中,即IPOM 术式。但由于进入腹腔操作及使用高值防粘连补片,既增加了腹腔相关手术并发症,也增加了患者的医疗费用[16]。IPOM 术后患者再行腹腔脏器手术,发现防粘连补片与腹腔大网膜组织及脏器广泛粘连,使手术的难度及复杂程度增加。对于MILOS术式,仍为传统的开放手术,且其最佳适应证为中线位腹壁疝,对于侧方腹壁疝、边缘性腹壁疝等特殊类型腹壁疝目前应用较少[8]。
ESR 符合腹壁疝修补术修补基本原则:(1)关闭疝缺损。(2)置入补片加强腹壁修补,补片边缘至少超过疝缺损5 cm。但ESR术式更加灵活,具体术式根据患者的实际情况进行个体化选择及应用,可选择一种术式,也可联合应用,以保证最佳的治疗效果。
针对此次研究结果,现分享一下手术经验和体会:(1)早期手术处在摸索阶段,未常规放置密封式负压引流管,术后复查腹部CT 发现术区发生积液几率较高。后调整治疗方案,常规放置密封式负压引流管,取得良好的治疗效果,但也有1 例因患者需术前口服抗血小板聚集药导致引流管置管时间较长,延长了患者住院时间。(2)早期中线位腹壁疝,为了保证腹壁的完整性,将打开的腹直肌后鞘予以全部缝合关闭,这导致术后腹壁张力增大,术后发生了几例早期疼痛甚至腹胀的并发症。针对此类情况,借鉴了开放腹壁疝术中的组织分离技术(CST),腹直肌后鞘打开后可不予以缝合。如术中估计打开的腹直肌后鞘若强行缝合有增加腹壁张力的风险,不再予以强行缝合,此类患者术后未再出现早期疼痛及腹胀情况,随访亦未发现有疝复发情况。(3)在疝囊分离方面,如果疝囊与前腹壁粘连致密,完全分离较困难时,不予以强行分离,而是选择将疝囊打开,在直视下将疝内容物安全分离还纳腹腔,然后再缝合关闭疝囊,避免了强行分离损伤腹腔脏器的可能。(4)补片的固定方式有应用钛钉、悬吊固定及其联合的方式,后单纯应用医用胶水、自固定补片,可避免前者的固定应用,减少了术后的疼痛发生可能。(5)经对上腹部腹壁疝,如打开疝囊缺损较大,无法缝合关闭,将肝圆韧带和镰状韧带行部分游离切断,以转移组织瓣的形式与两侧疝囊缺损缝合,关闭残破腹膜。避免疝缺损过大无法缝合或强行缝合后腹膜组织张力过高,腹膜撕裂的可能。(6)如术前诊断为难复性或嵌顿性腹壁疝,手术方式是应用腹腔镜先进腹评估疝内容物及疝缺损,可先将疝内容物还纳腹腔,再缝合关闭腹膜,转行TES 手术。如此,可避免单纯全腹膜外手术对疝内容物评估不充分,导致疝内容物损伤可能。
根据此次研究,总结归纳了ERS术式相关优点:(1)腹腔镜操作,创伤小,符合微创理念。(2)游离范围广,向上达剑突下,向下可达耻骨联合后方,两侧至腋中线或腋后线直至后腹膜间隙,并可完成两侧的TAR技术,获得满意的游离空间。(3)补片置入腹壁肌后间隙,避免了与腹腔脏器的直接接触所引起的相关并发症,同时该间隙也有利于组织的长入及补片固定。(4)无需应用防粘连补片,手术费用大大降低。(5)根据缺损范围,可应用多张或大张补片,保证足够的修补范围,防止术后复发。
综上所述,ERS 手术在治疗腹壁疝方面适用范围广,完全符合微创理念,是对腹壁疝微创手术的进一步补充和拓展。但由于目前手术样本量较小,学习曲线较短,相关技术应用仍有待进一步探讨及细化,仍需更多的手术同仁共同努力发展,进一步细化该术式的规范化操作,达成有关共识,更好地造福患者。

