TANGO2全身敲除小鼠在生理条件下正常发育和繁殖
杨辰思,杨中州
南京大学医学院基础医学系,江苏 南京 210093
运输和高尔基体组织蛋白2 同系物(transport and Golgi organization protein 2 homolog,TANGO2)位于人类22 号染色体11.21 位点上,因此又名为C22orf25,其在小鼠中的直系同源物被称为T10。2006 年TANGO2 在果蝇细胞系全基因组RNA 介导的干扰筛选中被初次鉴定。2016 年通过外显子组测序,在3 例婴儿期发作的疾病患者中检测到了TANGO2双等位基因突变,3例患者都显现出脑萎缩和认知障碍的脑部疾病和心脏异常[1]。这一由TANGO2 双等位基因突变引起的疾病被称为TANGO2 相关疾病,是一种新发现的常染色体隐性的罕见疾病[2-5]。目前已报道的TANGO2相关疾病患者有70 余例,发病年龄范围差异较大,从婴儿期到成年期均可能首次发病[6-9]。TANGO2 的缺失还与DiGeorge综合征有关,该综合征是由22号染色体11.2.7 位点的1.5~3 Mb 杂合缺失引起的,是最常见的染色体微缺失疾病之一,涉及30多个基因的单等位基因缺失,其中包括TANGO2[10-11]。DiGeorge 综合征主要由从头非同源减数分裂重组事件引起,其典型特征包括发育迟缓、圆锥动脉干心脏缺陷和面部畸形[12-14]。
TANGO2蛋白在进化上高度保守且在生物体内普遍表达,但目前TANGO2 蛋白的细胞定位和具体功能仍然不清楚。生物信息学预测小鼠TANGO2的蛋白产物(T10)的氨基酸序列中可能存在线粒体靶向基序[15]。在转染GFP-融合蛋白的NIH-3T3 细胞中,T10与线粒体共定位[15]。然而,在表达GFP-融合蛋白的HeLa细胞中,TANGO2是否与线粒体标志物共定位,在两项不同的研究中观察到了相反的结果[16]。由于目前没有开发出适用于免疫荧光成像的TANGO2 抗体,所以还无法确定TANGO2 在细胞中的明确定位。
已有研究表明TANGO2 在高尔基体转运和线粒体功能中发挥双重作用。在果蝇S2 细胞中,TANGO2 蛋白缺失会导致高尔基体膜与内质网融合[1]。在TANGO2缺失患者的成纤维细胞中,没有观察到高尔基体融合或高尔基体体积减少的现象[5]。TANGO2突变患者的成纤维细胞的膜运输分析结果显示,内质网和高尔基体之间的货物运输有明显延迟,而且补充TANGO2 蛋白可以挽救这一过程[16]。另有研究表明,TANGO2 缺失患者成纤维细胞的蛋白质组学分析发现了线粒体脂肪酸氧化、质膜、内质网-高尔基体网络和分泌途径的显著变化[17]。据报道,TANGO2 缺失患者细胞中的超氧化物产生增加,而氧消耗速率减少[18]。TANGO2 缺失患者的成纤维细胞中也观察到了线粒体形态的变化[16]。但也有研究倾向于认为TANGO2 缺失患者中观察到的线粒体损伤是一种继发伤害[19]。
TANGO2的研究主要集中在人类患者和体外细胞实验上,目前还没有该基因在哺乳动物体内的相关研究,而且TANGO2 相关疾病的致病机制还不清楚。为了研究TANGO2 的生理功能及其缺失的致病原因,阐明其是否是导致DiGeorge 综合征的关键候选基因,本研究制备了TANGO2 敲除的小鼠模型,并首次对其表型进行研究,重点关注心脏和神经发育。
1 材料和方法
1.1 材料
TANGO2-/-小鼠从剑桥-苏大基因组资源中心(CAM-SU GRC)获得,属于C57BL/6N背景。通过在内含子Ⅱ中插入终止序列,使得TANGO2 的基因转录在外显子Ⅱ后终止,后面的外显子Ⅲ~Ⅸ不能进行正常转录,从而实现TANGO2的靶向破坏(图1)。
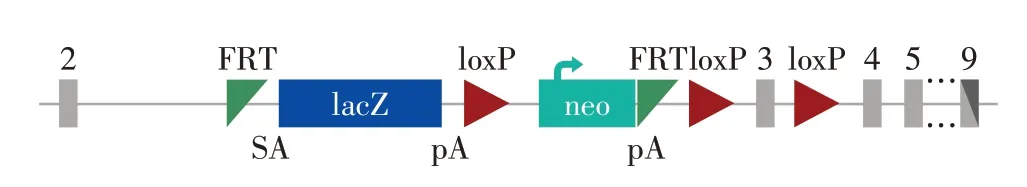
图1 小鼠TANGO2基因的敲除策略Figure 1 The strategy of targeted disruption of the mouse TANGO2 gene
小鼠按照《南京大学小鼠福利与伦理条例》分笼饲养,12 h/12 h 明暗交替,自由进食和饮水,环境温度25 ℃,湿度55%~60%。南京大学动物保护和使用委员会(IACUC)批准了本研究中使用的所有动物处理程序。
1.2 方法
1.2.1 基因型鉴定
使用从小鼠尾部提取的gDNA,通过PCR 分析小鼠的基因型。位于外显子Ⅱ的引物(TANGO2-F:5′-AAAGTACAGGTGCCCACAGATACCA-3′)与位于插入的转录终止序列下游的内含子Ⅱ的引物(TANGO2-WT-R:5′-GGAAAAGAAAGTTCAAGGGAAGCCA-3′)一起使用,该引物从野生型(WT)等位基因中扩增出487 bp的条带,而从敲除的等位基因中没有扩增出条带。TANGO2-F与位于插入的转录终止序列的引物(TANGO2-KO-R:5′-AACATAAAGTGACCCTCCCAACAGC-3′)一起用于从敲除的等位基因中扩增328 bp 的条带。PCR 程序为95 ℃3 min;95 ℃30 s,58 ℃退火30 s,72 ℃延伸30 s,35 个循环;最后72 ℃8 min。
1.2.2 荧光实时定量PCR反应分析
分离WT 和TANGO2-/-新生小鼠的心脏和大脑组织,在液氮中速冻,并在-80 ℃下储存。使用研磨机将样品在冰上匀浆,使用FastPure 细胞/组织总RNA提取试剂盒(RC112-01,Vazyme公司,美国)提取总RNA。使用HiScript Ⅲ逆转录酶试剂盒(R302-01,Vazyme公司,美国),将1 μg总RNA逆转录成cDNA。使用针对外显子V(TANGO2-Q-F:5′-GTCCTTGTCACTCAGCTCCT-3′)和VI(TANGO2-Q-R:5′-CATGCTCCGTTCAGTGAAGG-3′)的引物,使用优化的PCR 方案(95 ℃5 min 预变性;然后95 ℃30 s,58 ℃退火30 s,72 ℃延伸30 s,45 个循环)进行实时荧光定量PCR。使用β-actin作为内参引物(β-actin-F:5′-CCTCTATGCCAACACAGTGC-3′;β-actin-R:5′-CCTGCTTGCTGATCCACATC-3′)。PCR过程的SYBR荧光强度通过QuantStudioTM5 实时PCR 系统(Applied Biosystems公司,美国)进行检测。使用ΔΔCt分析方法计算mRNA相对含量。
1.2.3 苏木精-伊红(HE)染色
将新生和6 月龄的WT 和TANGO2-/-小鼠的心脏和大脑组织固定在4%多聚甲醛的PBS 溶液中,4 ℃过夜。PBS 洗涤3次后,将固定好的样品进行脱水处理,并包埋在石蜡中。在石蜡切片机上将组织切成8 μm厚的切片,并用苏木精和伊红染色。最后在体式镜(SZX10,Olympus公司,日本)上拍摄切片。
1.3 统计学方法
统计分析采用SPSS 23.0进行计算,统计图采用Origin 2018 软件制作。数据以均值±标准差()表示。使用成对t检验进行两组数据比较。P<0.05为差异有统计学意义。
2 结果
2.1 mRNA水平上证实TANGO2敲除小鼠构建成功
通过PCR实验检测小鼠的基因型,WT小鼠只有1条487 bp的条带,TANGO2-/-小鼠只有1条328 bp的条带,这两条条带在TANGO2+/-小鼠中都能够显现(图2)。
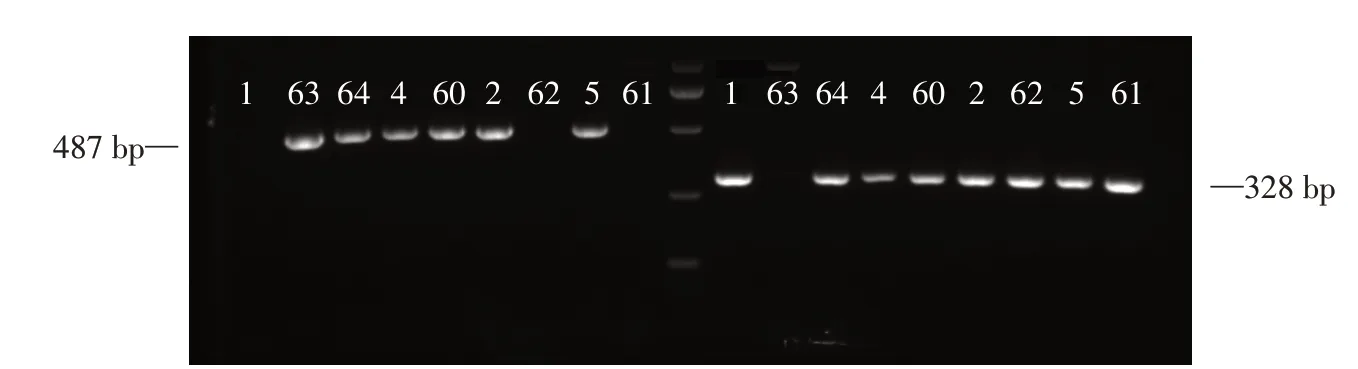
图2 小鼠基因型鉴定Figure 2 Mouse genotype identification
为了检验构建的TANGO2 敲除小鼠模型的敲除效率,进行了WT和TANGO2-/-小鼠心脏和大脑组织的实时荧光定量PCR。结果表明,TANGO2在WT小鼠的心脏和大脑中都有表达,而在同窝出生的TANGO2-/-小鼠的相应组织中没有观察到TANGO2 mRNA的表达。这证明了TANGO2敲除小鼠模型构建成功(图3)。
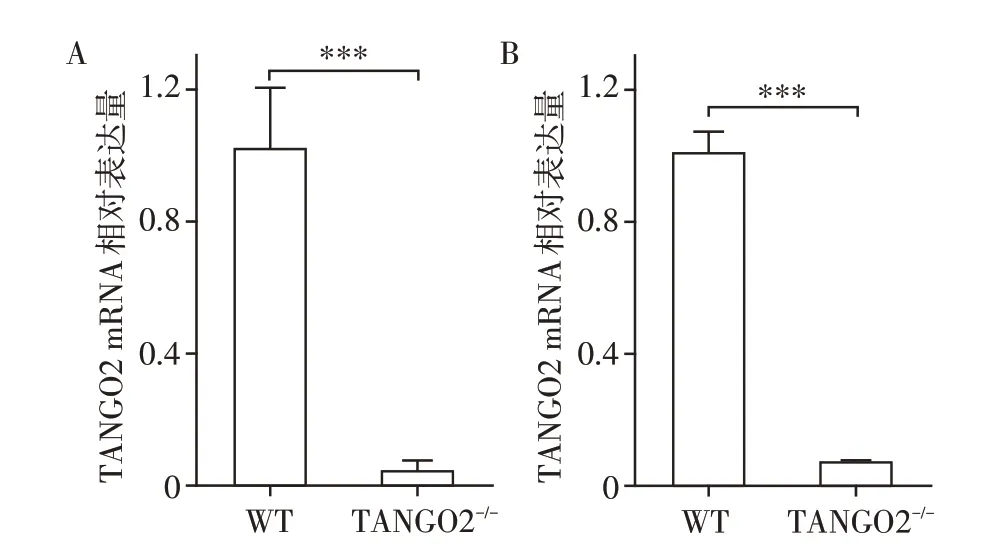
图3 WT和TANGO2-/-小鼠中TANGO2 mRNA的表达水平Figure 3 The mRNA expression levels of TANGO2 in WT and TANGO2-/-mice
2.2 TANGO2敲除小鼠无明显表型异常
TANGO2+/-小鼠能够正常生存和繁育后代,让适龄的TANGO2+/-雌、雄小鼠交配,以产生TANGO2-/-小鼠进行表型观察。结果显示TANGO2-/-小鼠能够以预期的孟德尔比例出生,WT、TANGO2+/-和TANGO2-/-出生小鼠比率分别为25%、51%和24%,且不存在明显的表型异常,说明敲除TANGO2 对小鼠胚胎发育没有明显影响。出生后的TANGO2-/-小鼠发育正常,未出现发育迟缓的现象,能够正常生活和繁殖,没有明显的表型异常或行为异常。TANGO2-/-小鼠的生存率与WT 小鼠相比没有表现出任何具有统计学意义的差异(图4)。
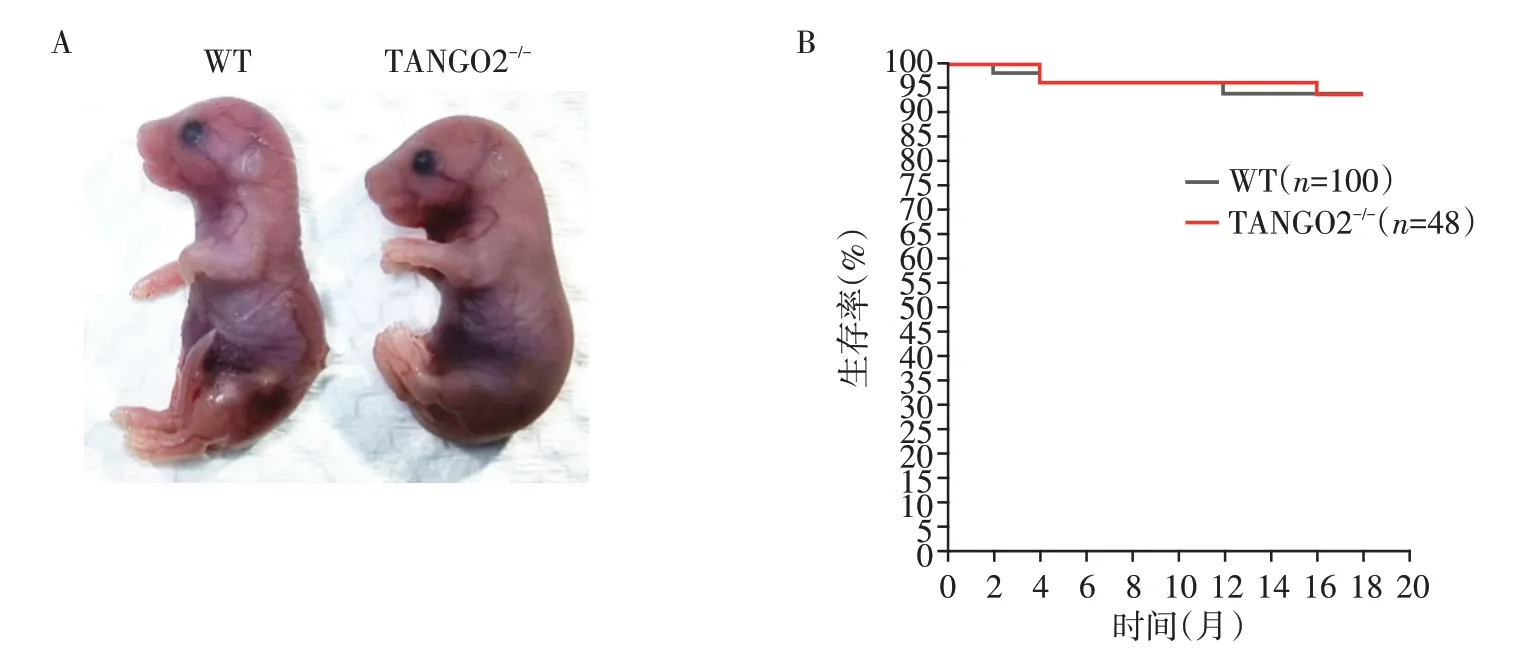
图4 WT和TANGO2-/-小鼠的总体表型Figure 4 Total phenotype of WT and TANGO2-/-mice
2.3 TANGO2敲除小鼠心脏和大脑表型正常
为了探究TANGO2-/-小鼠的心脏是否存在结构异常,取新生和成年6 月龄的WT 和TANGO2-/-小鼠的心脏进行表型观察。结果显示,新生和成年6 月龄的TANGO2-/-小鼠的心脏与WT 相比不存在明显的差异,TANGO2-/-小鼠的心脏结构正常,没有圆锥动脉干等异常结构(图5)。
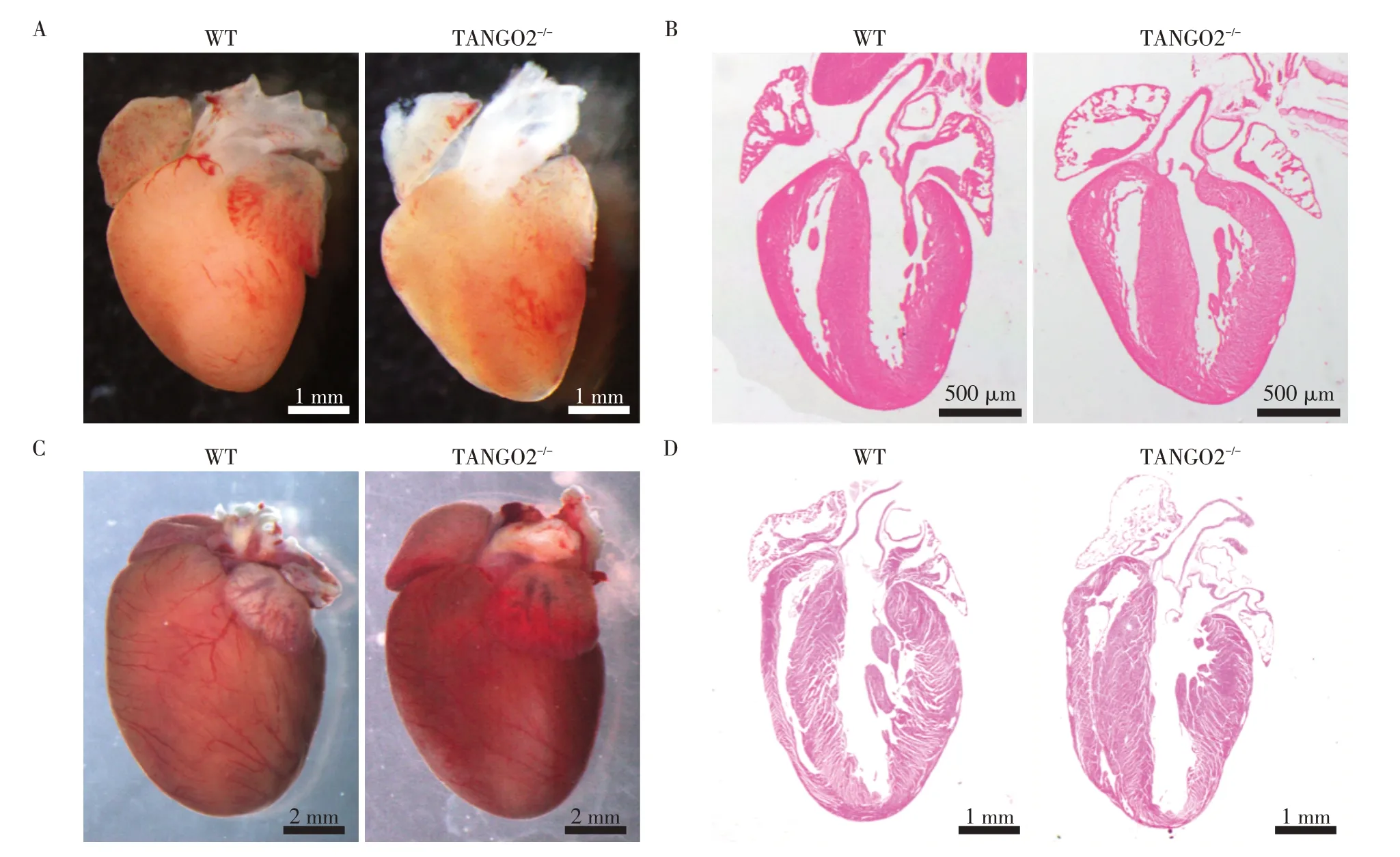
图5 WT和TANGO2-/-小鼠的心脏表型Figure 5 Cardiac phenotype of WT and TANGO2-/-mice
接着观察了新生和成年6月龄WT和TANGO2-/-小鼠的大脑。结果显示,与WT小鼠相比,TANGO2-/-小鼠没有出现脑萎缩,大脑的嗅球、前脑、中脑、小脑等结构都没有萎缩或结构异常的表型,脑室也没有出现扩张的现象,海马结构正常(图6)。
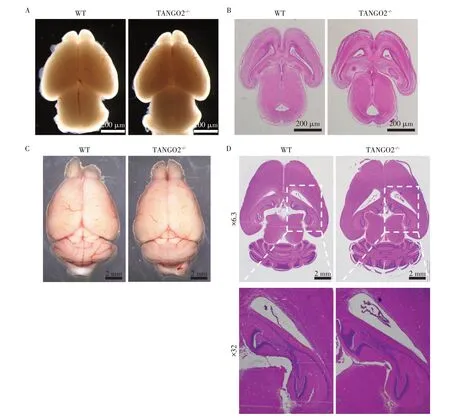
图6 WT和TANGO2-/-小鼠的大脑表型Figure 6 Brain phenotype of WT and TANGO2-/-mice
综上所述,TANGO2 敲除不会影响小鼠的心脏和大脑发育。
3 讨论
本研究未发现TANGO2 在正常生理条件下的小鼠体内的作用。此外,无法证明新生和成年6 月龄野生型和TANGO2 敲除小鼠之间的心脏或神经发育相关的任何差异。基于TANGO2 在心脏和大脑中的表达及其在人类中缺失会导致心脏缺陷和脑萎缩的表型,敲除小鼠明显缺乏与人类TANGO2相关疾病或DiGeorge 综合征相关的表型,可能归因于在敲除动物模型中可能存在代偿机制抵消该基因敲除的影响。在TANGO2 敲除小鼠中,可能存在线粒体功能或高尔基体转运涉及的蛋白质或机制替代了TANGO2 的缺失。基因敲除后缺乏表型变化通常是由于旁系同源基因对其功能的补充。除TANGO2之外,小鼠心脏和大脑中还表达TANGO1、TANGO4、TANGO5、TANGO6、TANGO7 和TANGO9等TANGO家族成员。TANGO1起到协助内质网货物运输的作用[20];TANGO5也定位于内质网上,已知其具有调节脂质运输的作用[21-22];TANGO4 和TANGO7发挥着调控细胞自噬的作用[23-24];而TANGO6 和TANGO9 的具体作用仍不清楚。基于此,推测小鼠中TANGO2 的功能可能被TANGO 家族的其他成员替代。而且本研究仅在正常生理条件下评估了TANGO2 在小鼠中的作用,不能排除TANGO2 在小鼠体内发挥作用是条件依赖性的。人类病例报道,部分TANGO2 相关疾病患者的初次发病是由麻醉或饥饿等触发因素诱导的[20]。
前人研究中,DiGeorge 综合征缺失区域中的一些其他基因在小鼠模型中的纯和敲除会导致小鼠的心脏和神经出现明显异常。例如,心脏特异性的硫氧还蛋白还原酶2(thioredoxin reductase 2,Txnrd2)缺失小鼠患有扩张型心肌病[25]。T-盒转录因子1(Tbox transcription factor 1,Tbx1)纯和敲除小鼠具有心脏圆锥动脉干、面部结构异常等表型[26]。RAN结合蛋白1(RAN binding protein 1,Ranbp1)纯和敲除小鼠表现为严重的小头畸形,甚至胚胎前脑缺失[27]。关于TANGO2的研究大多数是在体外细胞实验上进行的,本研究首次在小鼠中研究了TANGO2在生物体内的功能。但由于TANGO2敲除小鼠没有明显的表型异常,本研究对TANGO2的研究集中在组织和器官水平上,没有进一步深入细胞和细胞器水平。
总之,本研究构建了TANGO2 全身敲除小鼠,并且首次报告了敲除小鼠能正常存活和繁殖,与野生型同窝仔相比没有显著差异,并且缺乏人类中TANGO2相关疾病或DiGeorge综合征的表型。

