Drp1缺失通过ABCB10激活线粒体未折叠蛋白反应
毋柯蓉,郭兴
南京医科大学基础医学院神经生物学系,江苏 南京 211166
线粒体未折叠蛋白反应(mitochondrial unfolded protein response,mtUPR)是指当未折叠和错误折叠的蛋白质继续积累时,线粒体逆转信号到细胞核以保持线粒体蛋白稳态的反应。蛋白质稳态对细胞至关重要。在线粒体中,mtUPR 感知并响应于异常蛋白负荷,控制400 多个基因的表达。其中,CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homologous protein,CHOP)是mtUPR的一个关键转录因子,它与线粒体应激反应(mitochondrial stress responses,MSR)元件结合,CHOP 的表达与二聚体的形成可以与相关基因的启动子相结合。在哺乳动物中,CHOP 可以激活热休克蛋白60(heat shock protein,Hsp60)和Lon肽酶1(Lon peptidase 1,LONP1)的表达[1-2]。mtUPR 所诱导的下游基因表达改变可促进蛋白质的准确折叠,限制蛋白质转运到线粒体,并阻碍线粒体蛋白翻译以降低线粒体蛋白负荷,影响线粒体代谢和动力学,以利于细胞存活[1]。研究证明,蛋白质失衡是神经变性的基础,蛋白稳态异常与多种神经退行性疾病有关,包括阿尔茨海默病(Alzheimer’s disease,AD)、帕金森病(Parkinson’s disease,PD)、亨廷顿舞蹈症(Huntington’s disease,HD)和家族性肌萎缩侧索硬化症(family-amyotrophic lateral sclerosis,f-ALS)[3]。
线粒体作为细胞的能量工厂,参与信号传导及一系列重要的细胞过程,如通过氧化磷酸化(oxidative phosphorylation,OXPHOS)产生维持正常细胞功能所需的ATP、脂肪酸氧化、钙稳态、磷脂合成等,是细胞存活或死亡的关键因素[4]。线粒体作为高度动态细胞器,其分裂与融合过程由动力学相关蛋白中的GTP酶结构域调节保持动态平衡,控制着线粒体的数量、形状和大小[5]。
在哺乳动物细胞中,线粒体的融合由位于线粒体外膜的MFN1、MFN2 和位于线粒体内膜的OPA1(编码基因突变与显性视神经萎缩有关)调节[6-7]。线粒体的分裂主要由线粒体外膜蛋白MFF、MID49、MID51 和FIS1 招募动力相关蛋白1(dynamin related protein 1,Drp1)从细胞质转移到线粒体,与线粒体外膜动力学分裂蛋白结合,自组装成螺旋结构,包裹和收缩线粒体小管以促进裂变[8-10]。Drp1在线粒体的分裂中起核心作用,其活性受到严格调节。研究证明,Drp1 存在各种翻译后修饰(protein translational modification,PTM),包括磷酸化、小泛素化(small ubiquitin-like modifier,SUMO)、泛素化、S-亚硝基化等。以Drp1为核心的线粒体分裂是线粒体运输到突触、线粒体质量控制和大脑发育所必需的[11]。
在神经退行性疾病的细胞模型中,线粒体通常会响应错误折叠蛋白的表达而断裂[12-14]。一种特异性的小分子多肽P110,可以在病理条件下选择性阻断Drp1-FIS1间的相互作用,而不干扰Drp1与其他线粒体接头蛋白之间的相互作用[15]。化合物Mdivi-1 被广泛报道可抑制Drp1 依赖的线粒体裂变、延长线粒体并减轻脑损伤。Mdivi-1通过阻断Drp1自组装和抑制Drp1 组装结构募集到线粒体来减弱细胞凋亡过程中的线粒体分裂[16]。虽然线粒体断裂的致病性和继发性影响尚未可知,但抑制线粒体分裂延缓改善了多种神经退行性疾病模型中的疾病相关表型[17-18]。
前期研究发现,在HD的细胞和动物模型中,线粒体内膜蛋白ATP 结合盒B 亚家族成员10(ATP binding cassette subfamily B member 10,ABCB10)是线粒体应激时mtUPR 激活所必需的关键蛋白。ABCB10 的基因缺失会导致mtUPR 失调,进而导致线粒体功能障碍和细胞死亡[19]。本研究通过下调线粒体分裂相关蛋白Drp1 的表达探究线粒体分裂异常激活mtUPR的分子机制,旨在为治疗神经退行性疾病提供新的思路。
1 材料和方法
1.1 材料
小鼠胚胎成纤维细胞(mouse embryonic fibroblast,MEF)、HEK293T 细胞购于美国模式培养物集存库(ATCC)机构。Drp1 敲除的Drp1-KO 和野生型Drp1-WT的MEF细胞系由约翰霍普金斯大学Hiromi Sesaki 博士赠送。DMEM 细胞培养基(Hyclone 公司,美国),胎牛血清(ExCell Bio公司,乌拉圭),青霉素-链霉素、胰蛋白酶(上海生工公司),蛋白酶抑制剂(苏州新赛美公司);BCA 蛋白浓度检测试剂盒、乳酸脱氢酶细胞毒性检测试剂盒(上海碧云天公司);抗Drp1 抗体(BD Biosciences 公司,美国),抗CHOP、LONP1 抗体(Proteintech 公司,美国),抗ABCB10、Hsp60抗体(Santa Cruz公司,美国);3-硝基丙酸(3-nitropropionic acid,3-NP)、Drp1抑制剂Mdivi1(Sigma-Aldrich 公司,美国),Drp1 抑制剂P110 及对照蛋白穿膜肽反式转录激活因子(trans-activate of transcription,TAT)(南京金斯瑞公司),DMSO(Biofroxx 公司,德国);AceQ qPCR SYBR Green Master Mix、FastPure Cell/Tissue Total RNA Isolation Kit V2、HiScript ⅢRT SuperMix for qPCR(+gDNA wiper)(南京诺唯赞公司),转染试剂GenEscortTMI(南京慧基生物公司),线粒体超氧化物(mitochondrial superoxide,mitoSOX)指示剂溴化乙锭衍生物、线粒体膜电位(mitochondrial membrane potential,MMP)指示剂四甲基罗丹明甲酯(Invitrogen Life Science公司,美国)。
1.2 方法
1.2.1 细胞培养
MEF 和HEK293T 细胞均培养于含有10%胎牛血清和1%青霉素-链霉素的DMEM完全培养基,置于37 ℃、5%CO2的培养箱孵育。
1.2.2 慢病毒沉默体系构建敲低稳转细胞系
病毒包装:待10 cm 细胞培养皿中的HEK293T细胞融合度大致为50%时更换细胞培养液。pLKO.1-shDrp1/pLKO.1-shABCB10/pLKO.1 5.0 μg、pMDL g/p RRE 2.5 μg、pRSV-Rev 1.25 μg、pCMVVSVG 1.5 μg与20 μL转染试剂于200 μL不含血清与抗生素的DMEM中混合均匀,室温孵育15 min后加入HEK293T细胞中摇匀。24 h后弃旧培液,加入10 mL完全培养基,48 h 后再次加入10 mL 完全培养基。72 h 后将20 mL 培养液用0.45 μm 滤膜过滤细胞碎片后,加入5 mL 5×PEG8000 于4 ℃混悬过夜浓缩病毒,次日4 ℃12 000 r/min 离心30 min,PBS 混悬沉淀分装。
病毒感染以及稳转系筛选:6 孔板MEF 细胞融合度为50%时加入病毒和聚凝胺(10 μg/mL)感染48 h后,加入含2 μg/mL 嘌呤霉素的DMEM 完全培养基筛选至未感染细胞全部死亡后进行正常传代。
1.2.3 药物及小分子多肽处理
不同浓度(0、2.5、5.0、10.0 mmol/L)3-NP 处理Drp1-KO、Drp1 敲低(sh-Drp1)以及对照细胞24 h。1 μmol/L 的小分子多肽TAT 和P110 分别加入MEF细胞处理24 h。40 nmol/L 的DMSO 和Drp1 抑制剂Mdivi-1分别加入MEF细胞处理16 h。
1.2.4 Western blot实验
提取处理后的细胞总蛋白,加入蛋白酶抑制剂后进行蛋白定量,取30 μg 蛋白进行Western blot 实验。用制备好的5%浓缩胶和10%分离胶进行80 V恒压电泳15 min后,调电压至160 V;待蛋白分子分离,360 mA恒流100 min电转,5%脱脂牛奶封闭NC膜1 h。一抗(CHOP 1:1000,ABCB10 1∶500,Drp1 1∶1 000,LONP1 1∶1 000,Hsp60 1∶1 000)4 ℃孵育过夜,TBST洗膜10 min×3,二抗(HRP标记1∶5 000)2 h,TBST 洗膜10 min×3。SageBrightness ECL 化学发光液进行检测。
1.2.5 qRT-PCR
试剂盒提取Drp1 敲低和其对照稳转系、以及DMSO和Mdivi-1分别处理的MEF细胞的RNA,将其逆转录为cDNA,稀释10 倍后待用。将SYBR Green 10 μL,cDNA 4 μL,上、下游引物(母液10 μmol/L)各0.2 μL(表1),ddH2O 5.6 μL混合进行qRT-PCR实验。
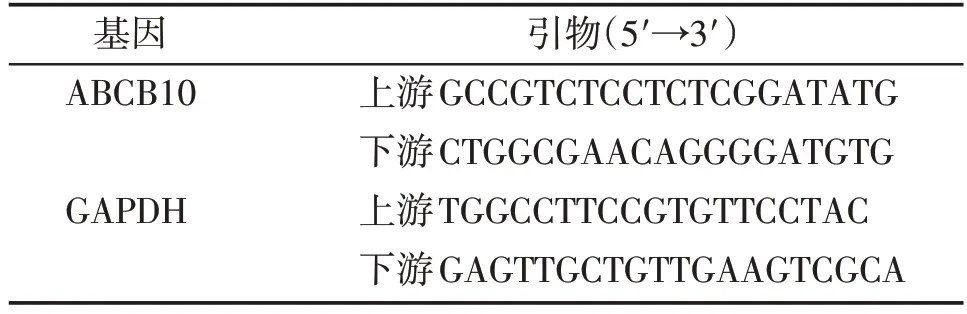
表1 实时定量PCR相关引物Table 1 Relative primers of real-time quantitative PCR
1.2.6 乳酸脱氢酶(lactate dehydrogenase,LDH)细胞毒性检测
待96孔板中细胞融合度大致为80%时,多孔板离心机400g离心5 min,取上清120 μL到新的96孔板中。加入60 μL LDH工作液,混匀,室温避光孵育30 min,490 nm测定吸光度值。
1.2.7 线粒体活性氧和MMP检测
待6 孔板细胞融合度大致为80%时,弃掉培养液,PBS 清洗1遍,胰酶消化后用培养液终止。3 000 r/min 离心3 min,PBS 清洗后再次离心。每组按照染料母液与培养液1∶1 000的比例加入200 μL染料,混匀,37 ℃孵育30 min。PBS 清洗3次,混悬后通过流式细胞仪检测。
1.3 统计学方法
以上实验结果分析均采用GraphPad Prism 8.3.0。两组间比较使用student’sttest,单因素多组间比较使用one-way ANOVA,双因素多组间比较使用two-way ANOVA。所有数据均以均数±标准差()表示。P<0.05为差异有统计学意义。
2 结果
2.1 敲除或敲低Drp1可激活mtUPR
不同浓度(0、2.5、5.0、10.0 mmol/L)3-NP 处理WT 组、Drp1-KO、pLKO 组和sh-Drp1 组细胞24 h。Western blot 结果显示,与对照相比,mtUPR 激活的转录因子CHOP 的蛋白表达水平显著上升(P<0.05,图1),Drp1-KO 和sh-Drp1 分别与WT 和pLKO各浓度对照组相比,CHOP蛋白的表达水平上升(图1)。提示Drp1表达水平下降可显著增强3-NP诱导的mtUPR。
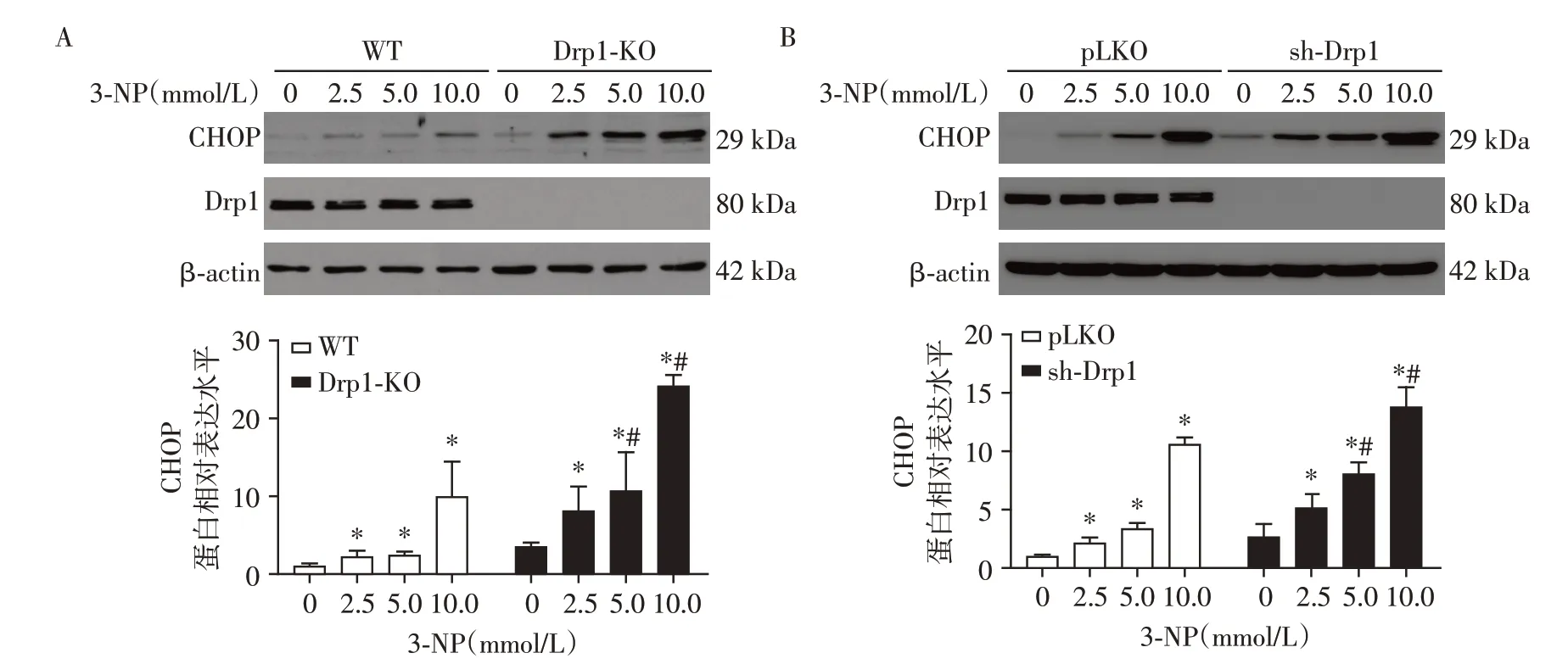
图1 在MEF细胞中敲除或敲低Drp1后CHOP蛋白的表达情况Figure 1 Expression of CHOP protein after Drp1 knocking out/knocking down in MEF cells
2.2 Drp1抑制剂小分子多肽处理可激活mtUPR
不同浓度(0、2.5、5.0、10.0 mmol/L)3-NP 处理DMSO 组、Mdivi1 组、TAT 组和P110 组细胞24 h。Western blot结果显示,与对照相比,CHOP蛋白的表达水平显著上升(P<0.05,图2),Mdivi-1 和P110 处理均显著增强3-NP诱导的mtUPR。
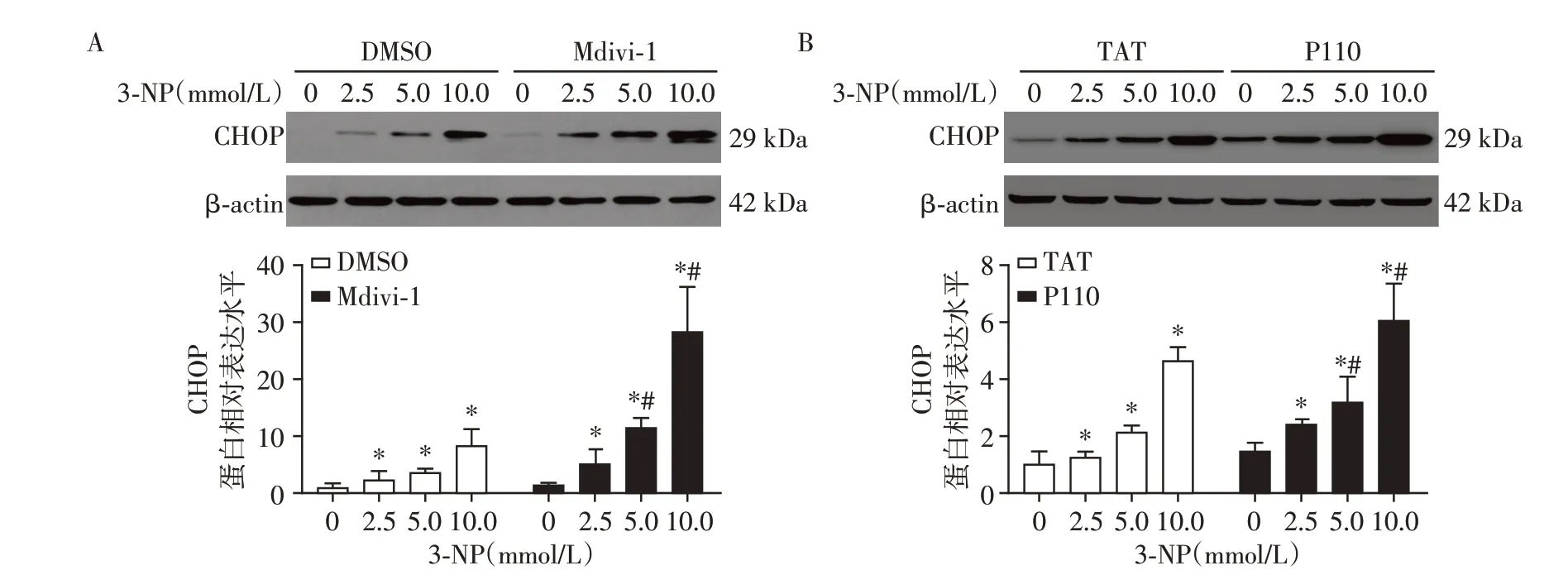
图2 在MEF细胞用Drp1抑制剂处理后CHOP蛋白的表达情况Figure 2 Expression of CHOP protein after Drp1 inhibitors treatment in MEF cells
2.3 敲低或抑制Drp1对mtUPR相关蛋白的影响
为进一步探讨抑制Drp1 表达与mtUPR 的相关性,检测反映mtUPR 活化的线粒体伴侣蛋白Hsp60和线粒体蛋白酶LONP1 蛋白表达水平的变化。Western blot结果显示,sh-Drp1组、P110组及Mdivi-1组细胞中,Hsp60和LONP1蛋白表达水平显著上升(P均<0.05,图3)。提示Drp1表达下降可激活mtUPR。
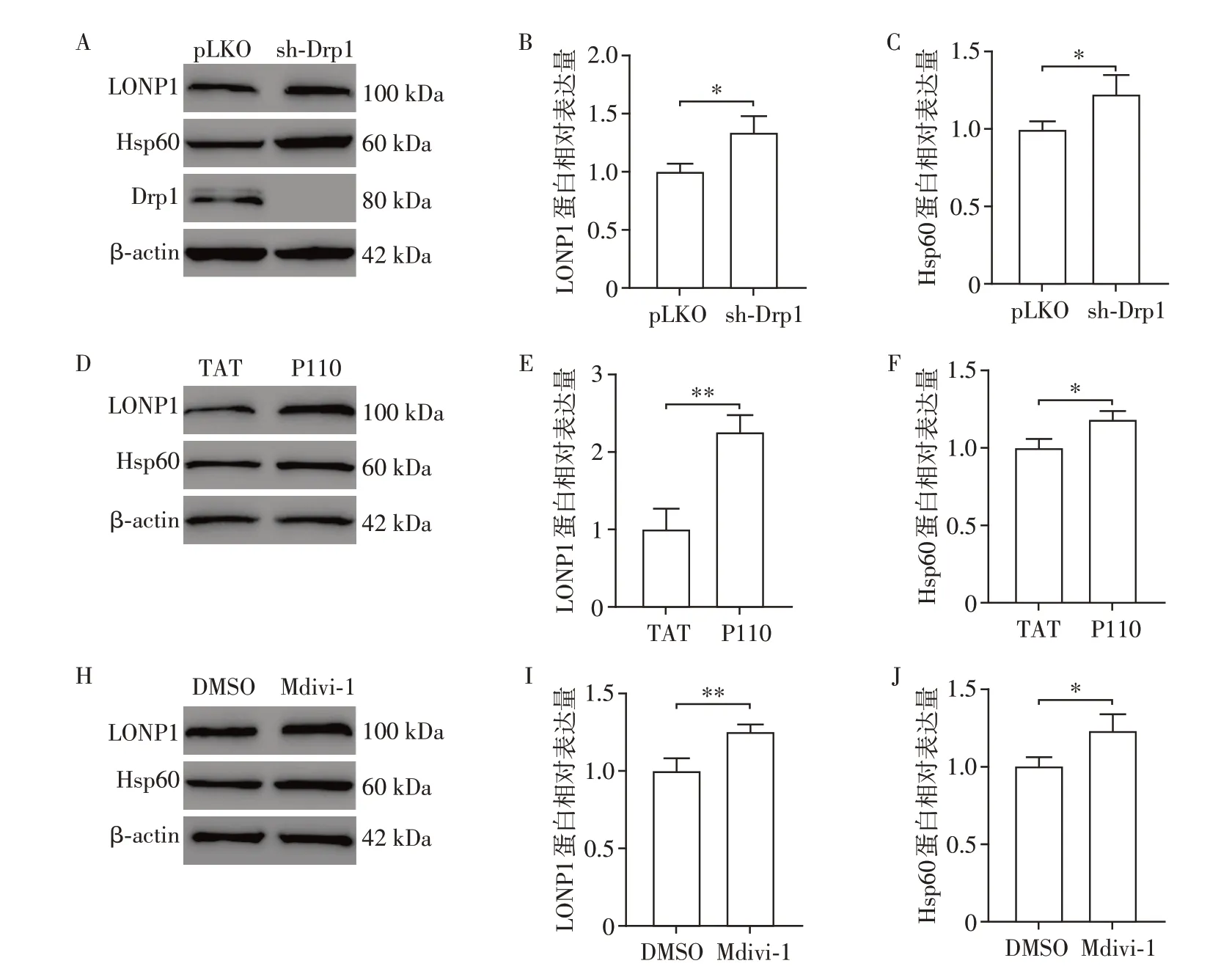
图3 敲低或抑制Drp1对mtUPR相关蛋白的影响Figure 3 Effects of knocking down or inhibiting Drp1 on mtUPR-related proteins
2.4 敲除、敲低或抑制Drp1对ABCB10蛋白表达水平的影响
本实验室前期研究表明,线粒体内膜蛋白ABCB10 是HD 细胞和动物模型中mtUPR 激活CHOP 所必需的蛋白[19]。猜测Drp1 可能通过调控ABCB10进而激活mtUPR。Western blot结果显示,敲除Drp1(Drp1-KO组)、敲低Drp1(sh-Drp1组)以及抑制Drp1(小分子多肽Mdivi1和P110处理)后,与对照组相比,ABCB10 蛋白水平显著升高(P均<0.01,图4)。提示ABCB10参与Drp1缺失激活mtUPR的过程。
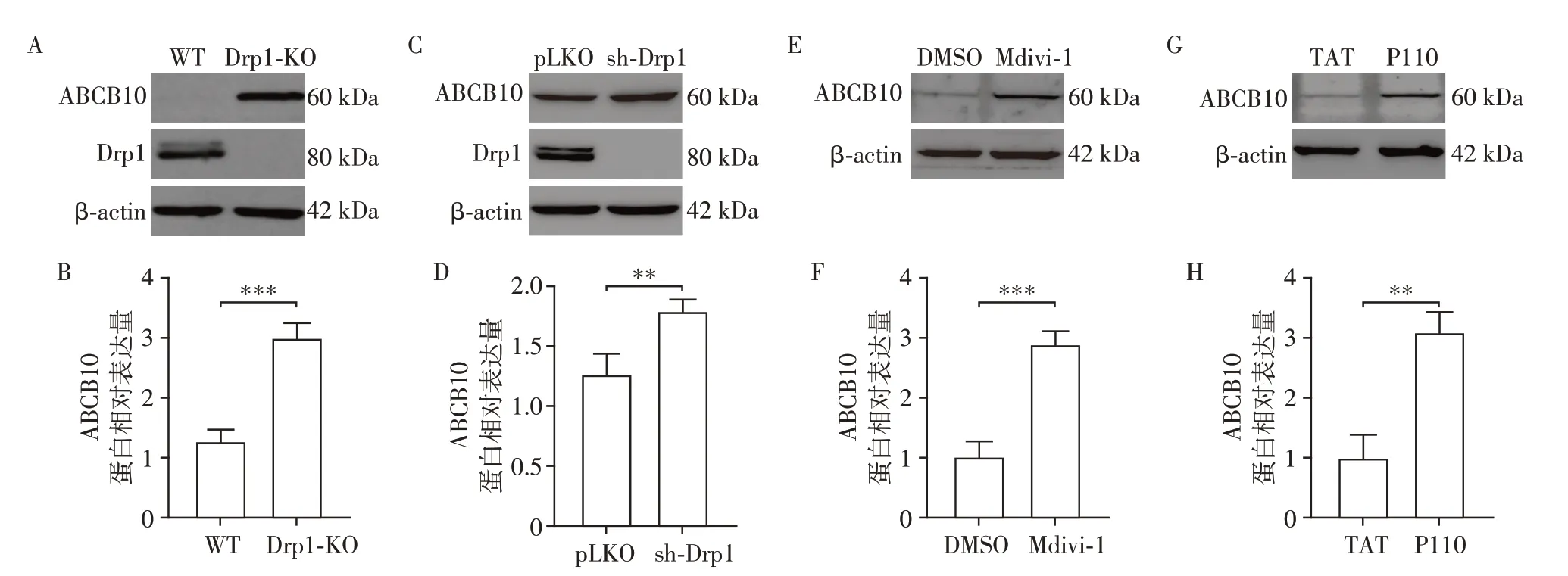
图4 敲除、敲低或抑制Drp1对ABCB10蛋白表达水平的影响Figure 4 The effect of knocking out,knocking down or inhibiting Drp1 on the expression level of ABCB10 protein
2.5 敲低Drp1 或Mdivi1 处理 对ABCB10 mRNA 水平的影响
为检测ABCB10 蛋白水平的升高是否与其mRNA水平的变化有关,qRT-PCR 检测pLKO 和sh-Drp1 组以及DMSO 对照和Mdivi1 处理组mRNA水平,以确定Drp1 是否影响ABCB10 的mRNA 水平。与对照组相比,sh-Drp1 和Mdivi1 组的ABCB10的mRNA水平显著上升(P均<0.01,图5)。
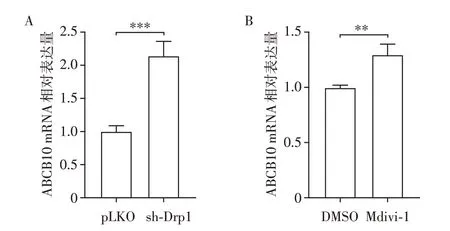
图5 敲低Drp1 或Mdivi-1 处理对ABCB10 mRNA 水平的影响Figure 5 Effect of Drp1 knockdown or Mdivi-1 on ABCB10 mRNA levels
2.6 Drp1和ABCB10双敲对mtUPR的影响
为进一步验证Drp1 是否通过ABCB10 调节mtUPR,对MEF 细胞进行Drp1 和ABCB10 双敲处理(D-sh 组)。结果显示,sh-Drp1 组CHOP 蛋白较pLKO 组显著上升;sh-ABCB10、D-sh 组CHOP 蛋白水平较sh-Drp1 组显著下调(图6)。表明Drp1 下调依赖ABCB10引起mtUPR。
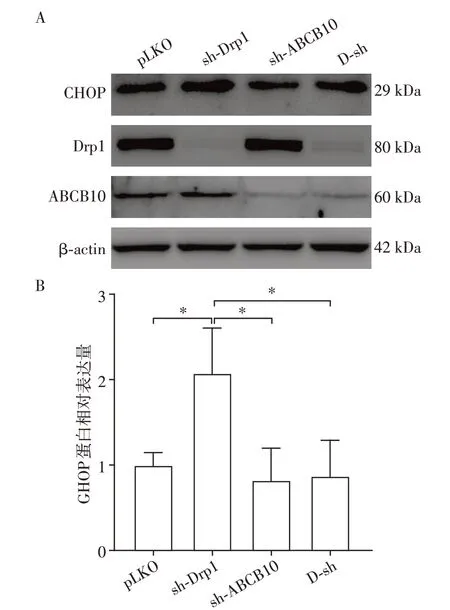
图6 Drp1和ABCB10双敲对mtUPR的影响Figure 6 The effect of Drp1 and ABCB10 double knocking down on mtUPR
2.7 Drp1 和ABCB10 双敲对细胞存活和线粒体功能的影响
为观察Drp1 和ABCB10 双敲处理后MEF 细胞存活和线粒体功能的影响,检测培养液中LDH 含量,并用mitoSOX 指示剂和TMRM 指示剂染色检测相应功能指标。结果显示,sh-Drp1 组细胞LDH 释放量较pLKO组增加,mitoSOX含量升高,MMP降低。D-sh组与sh-Drp1相比,细胞LDH释放量降低,mito-SOX含量降低,MMP升高,且3项指标与pLKO组差异均无统计学意义(图7)。结果提示sh-Drp1 可引起线粒体功能受损及细胞死亡增加,D-sh组可以挽救sh-Drp1引起的线粒体功能障碍及细胞死亡。
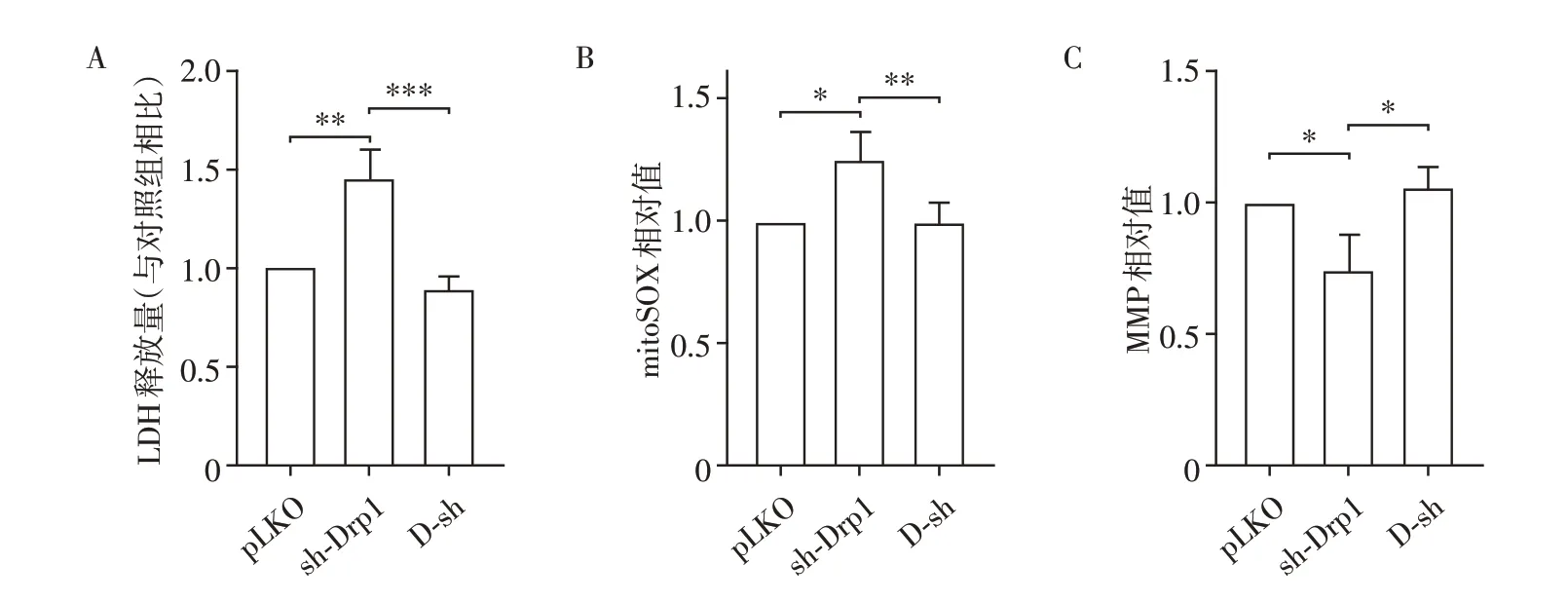
图7 Drp1和ABCB10双敲对细胞存活和线粒体功能的影响Figure 7 The effect of Drp1 and ABCB10 double knocking down on cell survival and mitochondrial function
3 讨论
mtUPR 通过感知线粒体蛋白质的状态,依赖伴侣蛋白促进未折叠蛋白质折叠,增强错误折叠蛋白质降解,防止蛋白质聚集,是线粒体-核通讯的重要方式。为研究线粒体断裂抑制是否会引起mtUPR,本研究通过敲除或敲低Drp1 或使用Drp1 抑制剂Mdivi-1和P110处理下调线粒体分裂关键蛋白Drp1的表达,结果表明,Drp1缺失激活CHOP蛋白的表达增加,暗示线粒体分裂蛋白Drp1表达下调引起线粒体应激,激活一系mtUPR信号事件,包括CHOP上调和Hsp60、LONP1激活,从而减少过度的线粒体蛋白毒性应激。研究表明,3-NP 引起线粒体不可逆损伤,加剧线粒体自噬,并促进细胞凋亡[20]。当Drp1缺失时,促凋亡蛋白CHOP表达量与3-NP处理对照组相比显著上升,说明细胞凋亡加剧,可能存在线粒体自噬与mtUPR 共同调节蛋白质稳态。线粒体质量控制包括线粒体自噬和mtUPR,两者对维持线粒体蛋白质平衡和细胞生理功能非常重要。细胞一方面通过mtUPR维持线粒体蛋白质稳态,另一方面通过自噬-溶酶体途径清除受损线粒体,利用线粒体自噬产物再生正常的线粒体,共同保证线粒体生理功能[21]。已有研究证明,线粒体自噬和mtUPR通过增强线粒体蛋白质平衡和减少β-淀粉样蛋白在大脑中的沉积来延缓AD的进展[1]。研究表明,ABCB10是维持线粒体伴侣和蛋白酶表达所必需的,在控制mtUPR中发挥了关键作用[22-23]。本实验室前期研究发现,在HD疾病细胞和动物模型中,线粒体外膜蛋白ABCB10是线粒体应激诱导的转录因子CHOP 激活所必需的[19]。本研究探讨了Drp1 表达下调是否通过ABCB10 引起mtUPR,检测敲除或敲低Drp1 以及Drp1 抑制剂Mdivi1 和P110 处理的MEF 细胞中ABCB10的表达,并对Drp1和ABCB10进行双敲,检测CHOP 表达是否受影响。结果表明,Drp1 表达通过ABCB10影响mtUPR。这个结果将线粒体动力学与mtUPR 联系起来,而线粒体动力学异常,尤其是Drp1蛋白异常,是神经退行性疾病的常见表型。
神经退行性疾病是一种衰老相关的疾病,其特征在于相关神经元进行性、选择性丢失,典型的神经退行性疾病包括AD、PD、f-ALS和HD等[24]。研究表明,线粒体功能障碍是神经退行性疾病的主要病理机制之一[25-27]。神经元具有很高的能量需求和有限的再生能力,因此破坏线粒体的完整性会对神经元功能产生不利影响,特别是线粒体融合和分裂过程动态失衡、生物发生异常或氧化磷酸化效率低均可能导致神经元树突和轴突缩短、神经递质周转下调以及炎症反应,最终导致神经元丢失[1,12,28-29]。
在神经退行性疾病中,线粒体通常响应于错误折叠蛋白质引起的mtUPR,抑制线粒体分裂可改善疾病相关表型[12-14,17-18]。在HD疾病模型中,Drp1线粒体易位增加,线粒体裂变蛋白Drp1的选择性抑制剂P110处理HD小鼠纹状体细胞系和HD患者来源的iPS 细胞系,可以改善线粒体功能,提高细胞活力。用P110治疗HD转基因小鼠可减少线粒体功能障碍、运动障碍和死亡率[18]。另外,在HD细胞模型中Drp1 招募HSF1 易位到线粒体,通过小分子化合物DH1 干扰Drp1/HSF1 的结合,可以抑制线粒体断裂,改善线粒体功能[25]。本研究通过检测Drp1 和ABCB10双敲细胞(D-sh)的细胞存活率以及线粒体功能,发现D-sh 组细胞存活率较sh-Drp1 组升高,mitoSOX 水平下降,MMP 升高。结合先前的数据分析,本研究中Drp1 缺失是在生理水平的改变,与疾病模型相比,可能对细胞存活和线粒体功能有不同影响。此外,CHOP是一种促凋亡蛋白,Drp1缺失激活CHOP 可能通过其他途径引起线粒体功能障碍,导致细胞死亡[30]。ABCB10 是CHOP 激活所必需的蛋白,当ABCB10缺失后,CHOP降低,引起细胞功能改善,细胞存活率增加。mtUPR 相关蛋白Hsp60、LONP1的变化暗示Drp1缺失激活mtUPR,但可能存在一条新的途径引起细胞死亡。本研究为线粒体动力学相关蛋白与mtUPR 之间的分子机制研究提供了一条新思路。
综上所述,Drp1 表达下调通过ABCB10 激活mtUPR,引起mtUPR 蛋白CHOP、LONP1 和Hsp60 的上调。研究为神经退行性疾病治疗靶点研究提供了新思路,但抑制线粒体分裂使其作为神经变性治疗手段的潜力需要在相关疾病的细胞和动物模型中进一步探索。

