羟氯喹抑制MEK/ERK/ROS通路减少中性粒细胞胞外诱捕网形成改善葡聚糖硫酸钠诱导的小鼠结肠炎
江婧月,张红杰
南京医科大学第一附属医院消化内科,江苏 南京 210029
溃疡性结肠炎(ulcerative colitis,UC)是胃肠道慢性非特异性炎症性疾病[1]。近年来,UC的发病率呈逐年上升趋势[2]。目前UC 发病机制仍未完全明确,研究提示免疫失调、菌群紊乱、肠屏障破坏、遗传易感性等与UC发病相关[3-5],肠道免疫失调在UC的发病中尤为重要[6]。在固有免疫细胞中,中性粒细胞是炎症反应的第一应答者,研究发现活动期UC患者损伤的肠黏膜中有大量中性粒细胞浸润[7]。
中性粒细胞促进炎症形成的关键机制是中性粒细胞胞外诱捕网(neutrophil extracellular trap,NET)的释放[8-9]。NET是由解聚的染色质及髓过氧化物酶(myeloperoxidase,MPO)、中性粒细胞弹性蛋白酶(neutrophil elastase,NE)组成[10],其诱导多种促炎细胞因子分泌,如肿瘤坏死因子(tumor necrosis factor,TNF)-α、白介素(interleukin,IL)-1β等,参与自身免疫性疾病的发生。研究发现活动期UC患者肠道组织及外周血中NET水平明显升高,提示NET参与UC炎症的形成[11],但NET在肠道炎症形成中的机制仍未明确。
研究发现自噬及活性氧(reactive oxygen species,ROS)参与NET 形成[12],ROS 生成是NET 形成的必要条件[13],而既往研究表明MEK/ERK 信号通路激活后可诱导ROS 的释放[14]。羟氯喹(hydroxychloroquine,HCQ)是4-氨基喹啉衍生物类药物,具有抗炎、免疫调节作用,其作为自噬抑制剂,可抑制ROS释放,已被用于包括胰腺癌在内的肿瘤治疗[15-16]。也用于自身免疫性疾病的治疗[17]。既往研究提示,HCQ通过Toll样受体9抑制肝缺血再灌注模型小鼠肝脏组织中NET形成[18]。
前期研究发现HCQ 可减低葡聚糖硫酸钠(dextran sulfate sodium salt,DSS)诱导的结肠炎,HCQ 能否抑制肠道组织中NET 形成而减轻UC 肠道炎症,仍不清楚。本研究构建UC 肠炎模型,通过动物和细胞实验探讨HCQ 是否可以通过抑制NET 形成减轻结肠炎症及其机制。
1 材料和方法
1.1 材料
1.1.1 健康志愿者
本研究纳入健康体检者,排除胃肠道疾病,无高血压、冠心病、糖尿病及自身免疫性疾病等,健康志愿者10例,采集3 mL外周血,分离中性粒细胞。本研究经南京医科大学第一附属医院伦理委员会审批通过(伦理号2021SR192),所有参与者已签署知情同意书。
1.1.2 实验动物
本研究使用清洁级雄性C57BL/6鼠,购自北京维通利华实验动物技术有限公司,在南京医科大学实验动物基地饲养。研究经南京医科大学实验动物福利伦理委员会批准(批文编号:IACUC-2106043)。MEK、p-MEK、ERK、p-ERK 抗体(Cell Signaling Technology 公司,美国),ECL 显影液(Thermo Fisher 公司,美国),ROS 检测试剂盒(上海碧云天科技公司),Sytox Green 染色液、Hoechst33342 染色液(Thermo Fisher 公司,美国),4%多聚甲醛(武汉赛维尔生物公司)。
1.2 方法
1.2.1 DSS肠炎模型及动物分组
雄性C57BL/6 小鼠(6~8 周龄,体重18~22 g),SPF 环境中适应1 周后随机分3 组:对照组(n=6)、DSS 组(n=6)、DSS+HCQ 组(n=6)。对照组:全程自由饮水,每天给予1次200 μL纯水灌胃;DSS模型组:自由饮用3%DSS溶液,同时每天给予1次200 μL纯水灌胃;DSS+HCQ 处理组:自由饮用3%DSS 溶液,同时每天给予1 次200 μL HCQ(60 mg/kg)灌胃。
1.2.2 疾病活动指数(disease activity index,DAI)和标本采集
每日观察小鼠精神状态,记录各组小鼠体重,记录粪便性状并进行隐血试验,根据表1 进行DAI评分[19]。造模结束后颈椎脱臼法处死小鼠,留取肠组织标本,固定、包埋、切片、HE 染色、显微镜下观察结肠黏膜损伤结构及炎症细胞浸润,根据表2 进行组织病理评分。

表1 DAI评分Table 1 Score of DAI

表2 组织病理评分Table 2 Score of histopatology
1.2.3 免疫荧光
石蜡切片经脱蜡、水化、抗原修复后,滴加10%山羊血清37 ℃下孵育1 h;滴加瓜氨酸化组蛋白H3(citrullinated histone H3,citH3)和中性粒细胞弹性蛋白酶(neutrophil elastase,NE)一抗工作液(1∶100)4 ℃过夜孵育;第2 天使用1×PBS 润洗切片3次,每次5 min;滴加免疫荧光二抗(Anti-Rabbit lgG-Alexa Fluor488、Anti-Mouse lgG-Alexa Fluor594,1∶200)工作液;37 ℃孵育1 h;滴加DAPI,室温下孵育15 min;滤纸吸去切片表面液体,滴加荧光抗淬灭剂,荧光显微镜下观察。
1.2.4 外周血中性粒细胞提取
EDTA 抗凝管收集健康志愿者外周血3 mL,将外周血加入含5 mL中性粒细胞分离液的离心管后离心,吸取多核细胞以及分离液,转移至另一个15 mL离心管,加入PBS,400 r/min 离心10 min 收集细胞;弃上清,加2 mL 红细胞裂解液,3 min 后加PBS,340 r/min 离心8 min;弃上清、用含有10% FBS 的RPMI1640培养基重悬细胞。
1.2.5 定量检测NET释放量
将中性粒细胞以2×104个/孔的密度铺至96 孔板中,培养体积为100 μL。将细胞分为3 组:对照组、LPS 组、LPS+HCQ 组。在LPS 刺激前,先加入HCQ预处理1 h;每孔加入1 μL浓度为20 μmol/L的Sytox Green 以及1 μL 浓度为1 mg/mL 的Hoechst 33342。培养箱中培养3 h、使用荧光酶标仪(通道为350 nm/461 nm 以及488 nm/525 nm)定量分析,以Sytox Green 荧光强度/Hoechst 33342 荧光强度计算出的比值进行比较。
1.2.6 免疫荧光检测NET释放情况
96 孔板中每孔加入50 μL 多聚赖氨酸溶液(0.1 mg/mL)包被。细胞分为3组:对照组、LPS刺激组、LPS+HCQ处理组;LPS刺激前,加入HCQ预处理1 h;每孔加入1 μL浓度为20 μmol/L的Sytox Green以及1 μL浓度为1 mg/mL的Hoechst 33342,充分混匀、培养箱中培养3 h、每孔加入33.3 μL 4%多聚甲醛、4 ℃过夜,使用细胞成像仪检测。
1.2.7 活性氧检测
将中性粒细胞浓度调整至1×106个/mL,每1 mL溶液加入0.5 μL 2,7-二氯荧光素二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA),37 ℃孵育15 min;孵育结束后使用PBS清洗2次,调整细胞浓度为2×105个/mL,铺至96孔板,每孔100 μL,分别加入药物处理;使用荧光酶标仪测定荧光强度(通道为488 nm/525 nm),每隔10 min测量1次。
1.2.8 Western blot实验
配置10%SDS-PAGE凝胶,100 V恒压电泳。裁剪PVDF膜,在甲醇溶液中浸泡30 s激活,倒入预冷的转膜液,冰上250 mA 恒流转膜1 h;将膜置于TBST 溶液中漂洗5 min、转移至5%脱脂牛奶封闭液中、室温下摇床孵育1 h;加入一抗(浓度1∶1 000)4 ℃过夜孵育;TBST 中漂洗3次,每次10 min;将条带置于二抗中(浓度1∶10 000),室温下缓慢摇动孵育2 h;TBST漂洗3次,每次10 min;将显影液均匀淋于条带上,使用天能凝胶成像系统进行显影。
1.3 统计学方法
本研究数据采用SPSS 22.0 以及GraphPad Prism 9 进行分析。符合正态分布的数据资料以均数±标准差()表示,两组连续性变量数据比较采用独立样本t检验,3组及3组以上连续性变量的比较采用单因素方差分析(One-way ANOVA),其中两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 HCQ减轻DSS结肠炎模型鼠的肠道炎症
与DSS诱导的结肠炎模型鼠相比,给予HCQ灌胃后结肠炎小鼠体重下降有减缓趋势(图1A)。DAI 评分:与DSS 组相比,予以HCQ后,结肠炎小鼠DAI评分明显降低(图1B)。小鼠结肠大体及长度:与DSS 组相比,DSS+HCQ 组小鼠肠腔稀便、黏膜充血水肿较DSS组减轻,且结肠缩短程度减轻(图1C、D)。结肠组织HE 染色病理评估:与DSS 组相比,DSS+HCQ组小鼠结肠上皮及隐窝的破坏明显减轻,腺体结构部分恢复,且固有层及黏膜下层炎性细胞的浸润明显减少(图1E),组织病理学评分也明显降低(图1F)。
2.2 HCQ 抑制DSS 结肠炎模型鼠肠道组织中NET形成
免疫荧光标记NE 与citH3 检测结肠组织NET的形成情况。结果显示,相比正常对照组,DSS模型组小鼠结肠组织中NET水平升高,HCQ处理后可明显抑制结肠炎小鼠结肠组织中NET水平(图2)。
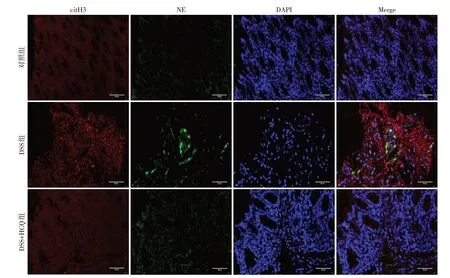
图2 HCQ抑制DSS肠炎模型鼠肠道组织中NET形成(×400)Figure 2 HCQ inhibits the formation of NET in colon tissues of DSS mice(×400)
2.3 HCQ抑制体外NET形成
健康人外周血中分离出中性粒细胞,分为3组:对照组、LPS 组和LPS+HCQ 组。Hoechst 33342 及Sytox Green 染色后在荧光显微镜下观察,与对照组相比,LPS组可见部分细胞核碎裂弥散,呈纤维网状结构,而给予HCQ 处理,NET 数量减少(图3A)。通过荧光酶标仪测定Hoechst 33342 及Sytox Green 染色后的荧光强度,定量分析NET 水平,结果显示HCQ处理后可减少LPS诱导的NET形成,与荧光显微镜观察结果一致(图3B)。
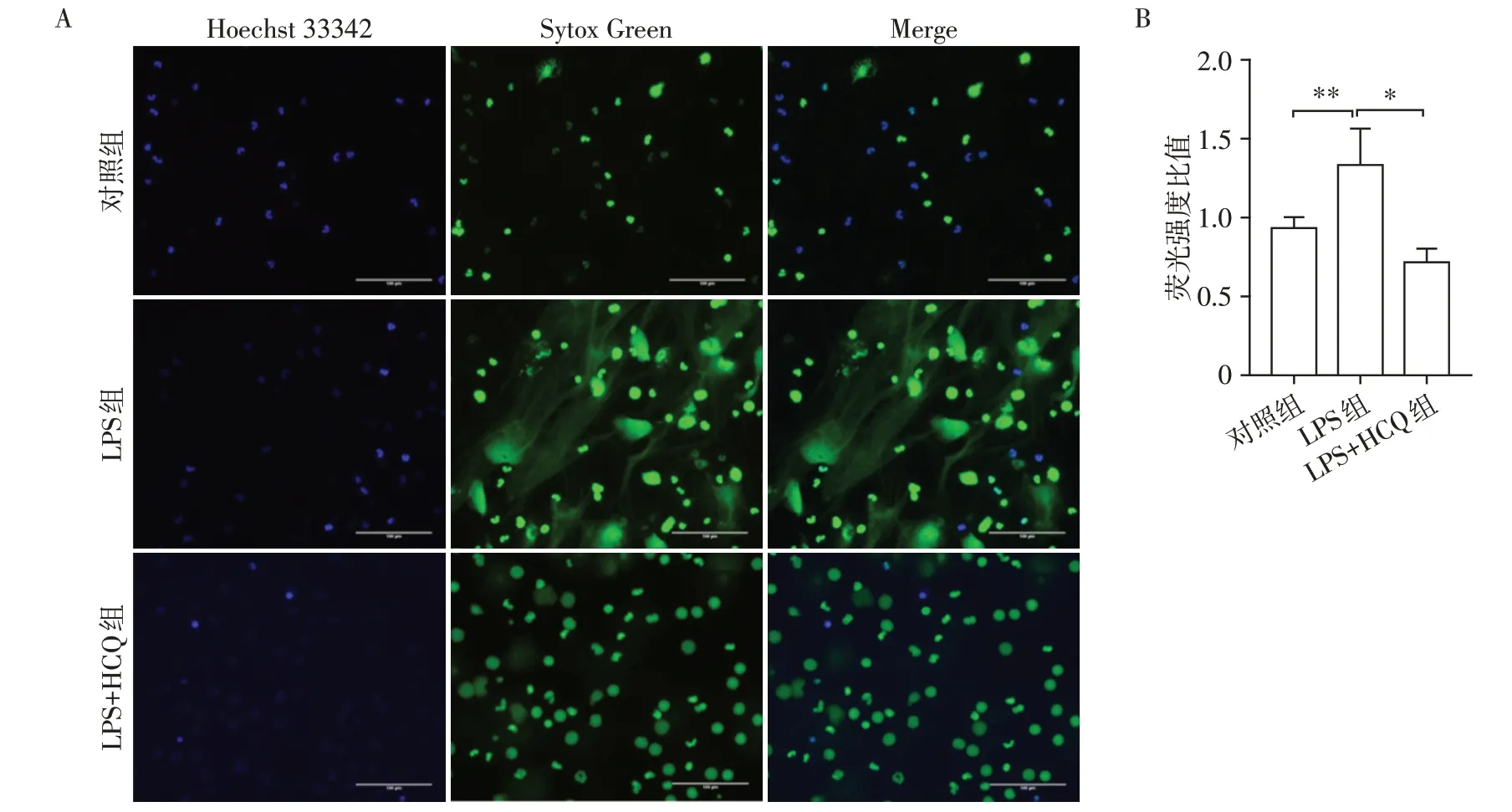
图3 HCQ抑制体外NET形成Figure 3 HCQ inhibits NET formation in vitro
2.4 HCQ抑制中性粒细胞ROS释放
检测各组细胞的ROS 水平,DCFH-DA 荧光探针孵育后的细胞经过相应处理,荧光酶标仪测定荧光强度,随着LPS 刺激时间的增加,LPS 组ROS释放增加,而LPS+HCQ 组ROS 释放水平,相比与LPS 组有明显降低(图4),表明HCQ 可抑制ROS生成。
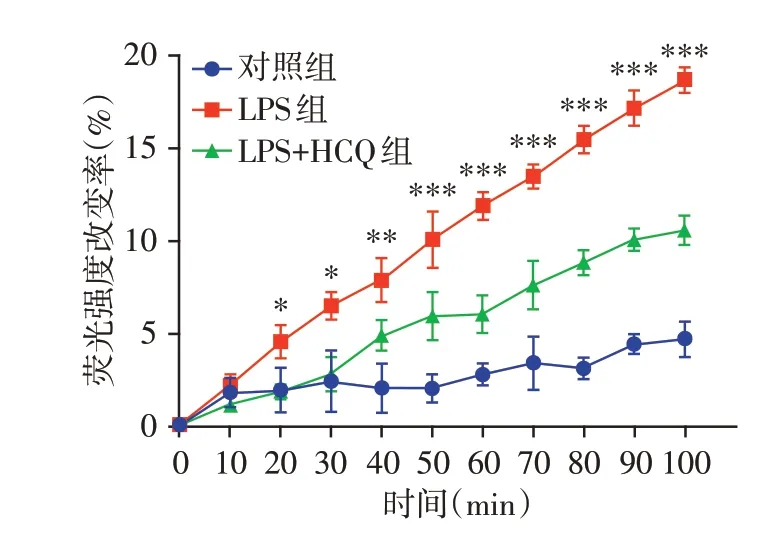
图4 HCQ抑制中性粒细胞ROS释放Figure 4 HCQ reduces ROS release from neutrophils
2.5 HCQ通过MEK/ERK/ROS通路抑制NET释放
通过Western blot 检测各组细胞p-ERK、ERK、p-MEK、MEK 蛋白的水平,结果显示,LPS 刺激后MEK、ERK 蛋白磷酸化水平上调,而HCQ 处理后可显著抑制MEK、ERK 磷酸化(图5A)。在HCQ 预处理后的中性粒细胞培养基中加入MEK/ERK 通路激动剂C16-PAF,并给予LPS 刺激NET 形成,结果显示:予以C16-PAF 处理后可逆转HCQ 对MEK/ERK通路的抑制作用,ERK及MEK磷酸化水平明显升高(图5B),同时检测激活MEK/ERK 信号通路后中性粒细胞ROS的释放情况,结果显示,与LPS+HCQ组相比,LPS+HCQ+C16-PAF组ROS释放明显增多(图5C),提示C16-PAF 逆转了HCQ 对中性粒细胞ROS释放的抑制作用。最后,荧光显微镜和荧光酶标仪测定对照组、LPS组、LPS+HCQ组及LPS+HCQ+C16-PAF组的NET水平,结果显示,与LPS+HCQ组相比,加入C16-PAF后NET形成增多(图6),以上结果表明C16-PAF 活化MEK/ERK 后NET形成增多,加入HCQ 可抑制NET 形成。以上提示HCQ 是通过下调MEK/ERK 信号通路磷酸化,减少ROS 释放,从而抑制NET形成。

图5 C16-PAF逆转HCQ 对MEK/ERK信号通路的抑制作用并促进ROS释放Figure 5 C16-PAF reverses the inhibition of HCQ on MEK/ERK signaling pathway and promotes ROS release
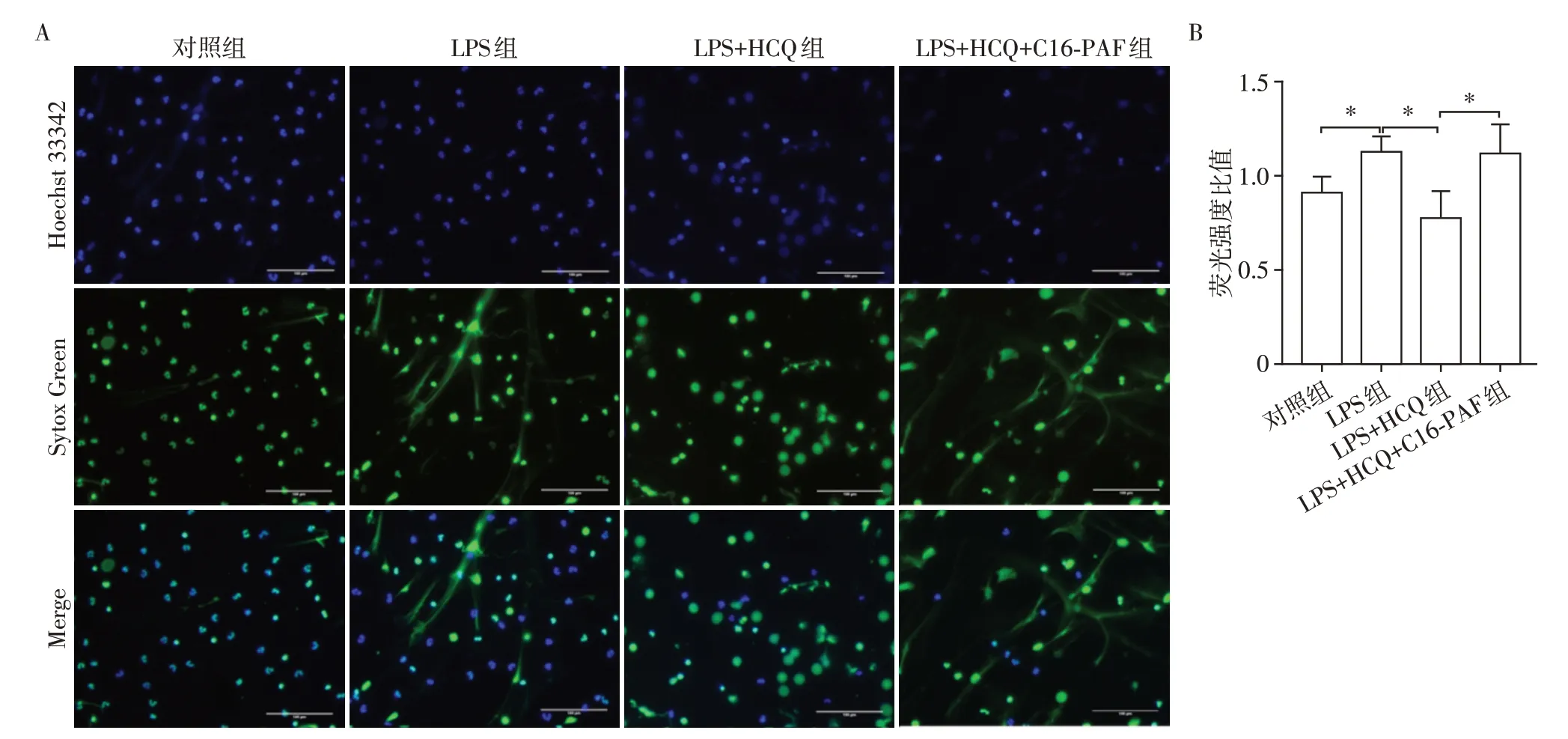
图6 C16-PAF增加HCQ处理后NET形成Figure 6 C16-PAF increases the formation of NET after HCQ treatment
3 讨论
UC是一种免疫功能异常、反复发作的进展性疾病。研究指出,组织局部的中性粒细胞过度募集和激活伴随着延迟消退会导致炎症持续激活和黏膜损伤反复发生[11],提示调控中性粒细胞功能可能对炎症性肠病(inflammatory bowel disease,IBD)的治疗有重要意义。
近年来,NET 在各类疾病中发挥的作用成为研究热点,NET 是中性粒细胞通过释放染色质及MPO、NE形成的纤维网状结构[10]。NET在系统性红斑狼疮、类风湿性关节炎等免疫疾病中起着重要作用。Dinallo等[11]发现,与克罗恩病患者和健康对照相比,UC患者结肠组织中NET 相关蛋白高表达,从UC 患者外周血中分离出的中性粒细胞对LPS 和TNF-α的反应增强,表现为NET 形成增加。另有研究提示NET 可导致肠道炎症[20]。本研究也表明,DSS造模小鼠肠道组织中NET水平明显增高。以上提示NET 参与了UC 的发病过程,抑制NET 形成可能成为IBD治疗的新靶点。
目前NET 形成的机制尚不清楚。主流观点认为,ROS与NET形成密不可分[13,21]。NADPH氧化酶产生的ROS 刺激MPO,随后MPO 触发NE 的激活和易位。NE 由嗜天青颗粒到达细胞核,在细胞核内NE水解组蛋白破坏染色质的组装,并随着解聚的染色质一同释放形成纤维网状结构[22]。研究ROS 相关信号通路,发现MEK/ERK、PI3K/Akt、IL-1 受体相关激酶(interleukin-1 receptor associated kinases,IRAK)、PKC 等信号途径参与了ROS 释放,影响了NET的形成[23-25]。
HCQ临床已应用于系统性红斑狼疮、类风湿性关节炎等自身免疫疾病治疗。其药理作用包括抑制溶酶体活性及自噬、阻断内质网中Ca2+释放、阻止活性烟酰胺腺嘌呤二核苷酸磷酸氧化酶2(NAPDHoxidase 2,NOX2)组装减少ROS 释放[26-27]。HCQ 通过抑制Toll 样受体4 激活,减少巨噬细胞产生炎性细胞因子和ROS[28]。另有研究发现,在肝脏缺血再灌注小鼠模型中,HCQ通过阻断Toll样受体9,抑制NET形成,并减少炎症因子TNF-α、IL-1β释放[18]。因此推测HCQ可以调整肠道免疫功能紊乱状态,进而减轻肠道炎症。
本研究发现,HCQ 可减轻DSS诱导的结肠炎模型鼠肠道炎症,并可减少DSS模型鼠肠道NET 的形成。在用LPS 刺激中性粒细胞模拟炎症中,加入HCQ 可减少NET 形成。提示HCQ 减低肠道炎症可能与抑制NET形成有关。
进一步对HCQ减少NET的机制开展研究,发现HCQ 可抑制MEK/ERK 信号通路激活,减少ROS 释放,与既往研究结果一致[29]。在HCQ处理后的中性粒细胞中加入MEK 特异性激活剂C16-PAF,发现MEK/ERK 通路被激活,ROS 释放增加,NET 形成较HCQ 处理组显著增加,提示HCQ 通过MEK/ERK/ROS途径减少NET形成。
既往对HCQ 的免疫及抗炎作用研究主要集中在巨噬细胞、树突状细胞及淋巴细胞,对中性粒细胞的研究较少。本研究通过DSS结肠炎模型鼠及细胞LPS炎症模型证实了HCQ可减轻结肠炎症,并抑制NET 的形成。细胞实验证实HCQ 可通过抑制ROS 减少NET 形成,该作用可能与HCQ 抑制MEK/ERK通路磷酸化有关。基于以上实验结果,HCQ调节免疫细胞、抗炎的作用被进一步证实,未来有望通过HCQ靶向调控中性粒细胞释放NET的功能,为IBD的治疗提供新方法。
本研究仍存在一定的局限性,未能在体外实验中深入探究HCQ 在中性粒细胞中作用的靶点及MEK/ERK 通路的上游受体。本研究也未能在结肠炎小鼠模型中证实抑制NET 形成可以直接改善小鼠结肠炎表现,后续将通过实验进一步证实。

