生菜瞬时转化条件优化
林杰鑫 张续业 严凌楠 许惠滨
摘 要:利用真空渗透法将改造过的包含绿色荧光蛋白(GFP)基因的pRHVnGFP载体转入生菜组织中,研究生菜的瞬时转化体系。通过对比不同的农杆菌菌株EHA105、LBA4404和GV3103,在相同条件下的转化效率,以及相同的农杆菌菌株在不同的侵染条件下的转化效率,最终确定以农杆菌LBA4404侵染生菜,菌液浓度OD600为0.5,不添加乙酰丁香酮,抽真空并保持压力状态60 s(重复3次),作为侵染条件,可以获得最高的转化效率。
关键词:绿色荧光蛋白;生菜;瞬时转化体系;农杆菌;转化效率
中图分类号:S 636.2 文献标志码:A 文章编号:0253-2301(2023)03-0040-05
DOI: 10.13651/j.cnki.fjnykj.2023.03.007
Abstract: The modified pRHVnGFP vector containing the green fluorescent protein (GFP) gene was transformed into the lettuce tissue by using the vacuum infiltration method to study the transient transformation system of lettuce. By comparing the conversion efficiency of different Agrobacterium strains EHA105, LBA4404 and GV3103 under the same conditions, and the conversion efficiency of the same Agrobacterium strain under different infection conditions, the infection conditions were finally determined as follows: the lettuce was infected with Agrobacterium LBA4404, the concentration of bacterial suspension OD600 was 0.5, acetosyringone was not added, and the pressure state was maintained for 60 s (repeated 3 times) after vacuuming. Under these conditions, the highest conversion efficiency could be achieved.
Key words: Green fluorescent protein; Lettuce; Transient transformation system; Agrobacterium; Conversion efficiency
植物生物反應器是利用植物体或植物细胞表达外源基因,从而生产具有药用价值或行使重要功能的蛋白质、抗体、多肽、脂类等的一种新型生物反应器[1]。相比于传统的利用发酵罐作为生物反应器进行生产,将植物生物反应器打造成植物工厂来进行生产,具有成本低、周期短且不易感染动物源病毒的优点[2]。20世纪90年代以来,我国愈加重视植物生物反应器的研究,从“九五”计划时选择“利用转基因植物生产口服疫苗和生物可降解塑料”等4个研究课题作为探索性项目予以资助,到“十二五”期间,国家863计划在现代农业技术领域设置了“动植物生物反应器”主题项目对该领域进行持续支持[3]。现如今已利用植物生物反应器成功生产各种抗原蛋白[4]。而在国外,植物生物反应器更是研究热门,2022年2月24日加拿大在全球范围内首次批准了其本土研制的植物源新冠疫苗,引起了国内外研究者的轰动,再次证明了植物生物反应器前景广阔[5]。
鉴于植物作为药物蛋白质表达和生产系统的重要性,其相关研究已开展近30年,其中,多叶植物如烟草、拟南芥、生菜等,具有高生物量、可溶性蛋白含量高,生产过程无须经历开花阶段的特点使其在生产口服性疫苗方面适合作为反应器的宿主[6]。然而,即使植物生物反应器生产外源蛋白具有天然的生产优势,仍需占有整个生产成本超80%的下游加工成本[7]。已报道在瞬时表达系统的应用中,目前利用烟草作为宿主表达外源蛋白的周期在7 d左右,但因为烟草本身的性质,其下游蛋白提纯费用高且效率低;而生菜中含有与烟草相比更少的尼古丁等有毒化学物质,所以在生产外源蛋白并提纯应用中生菜更加具有可行性[8]。本研究将以绿色荧光蛋白(GFP)基因作为报告基因,利用农杆菌渗透法对比不同农杆菌以及相同农杆菌不同侵染条件下生菜的瞬时转化效率,进而优化生菜瞬时转化条件,为后续生菜作为宿主在生物反应器中的应用奠定了技术基础。
1 材料与方法
1.1 供试材料
1.1.1 植物材料 以生菜作为受体材料,生菜来自福建省农业科学院植物保护研究所福清基地。
1.1.2 菌种及质粒 大肠杆菌 DH5α,农杆菌EHA105、LBA4404和GV3103以及稳定表达载体pRHVnGFP 均由闽江学院地理与海洋学院海洋与农业生物技术实验室保存。
1.2 试剂
限制性核酸内切酶Pst I和EcoR V,T4 DNA Ligase均购自上海TakaRa公司;SanPrep柱式质粒DNA小量抽提试剂盒购自生工生物工程(上海)有限公司;农杆菌生长培养基LB、YEB(酵母提取物肉汤、5 g·L-1蔗糖、5 g·L-1胰蛋白胨、6 g·L-1酵母提取物、0.24 g·L-1 MgSO4,pH 7.2)以及渗透培养基(10 mol·L-1 MES,10 mol·L-1 MgSO4)均购自厦门泰京生物科技有限公司。
1.3 试验方法
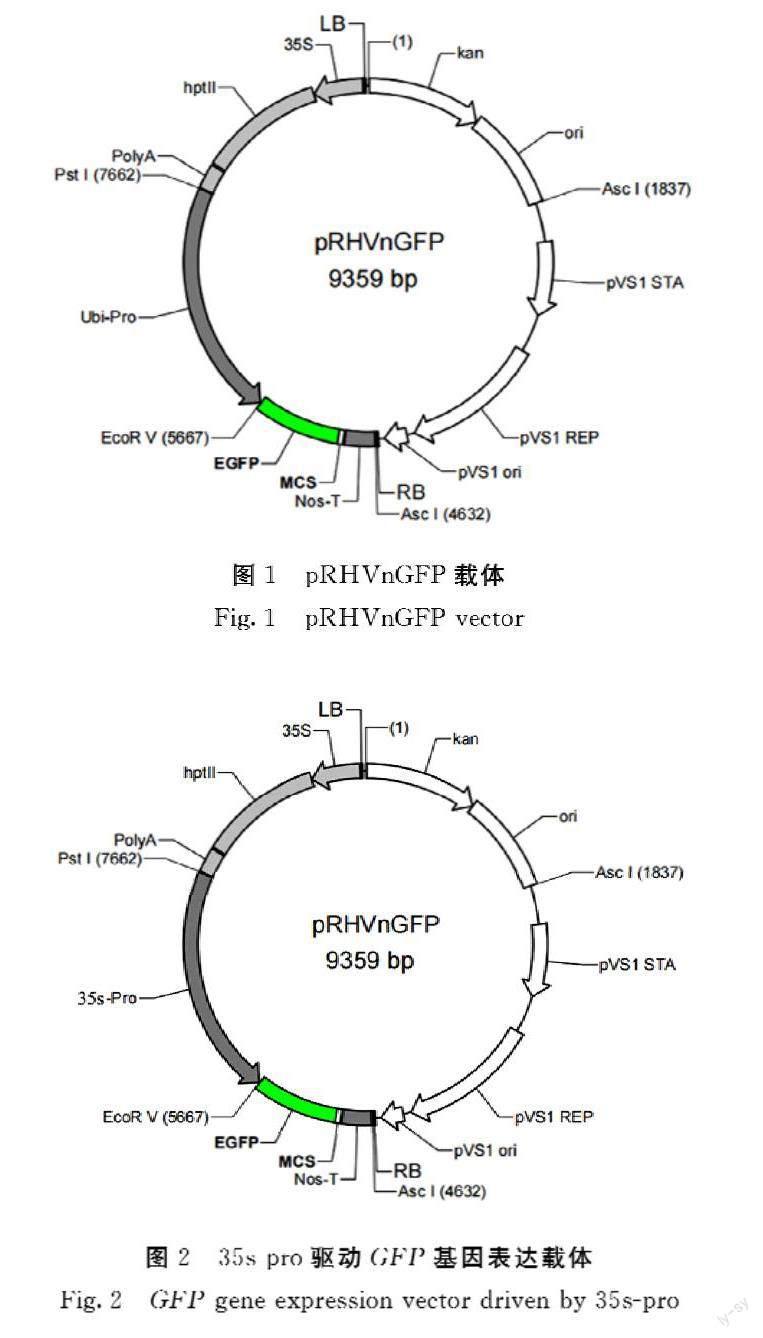
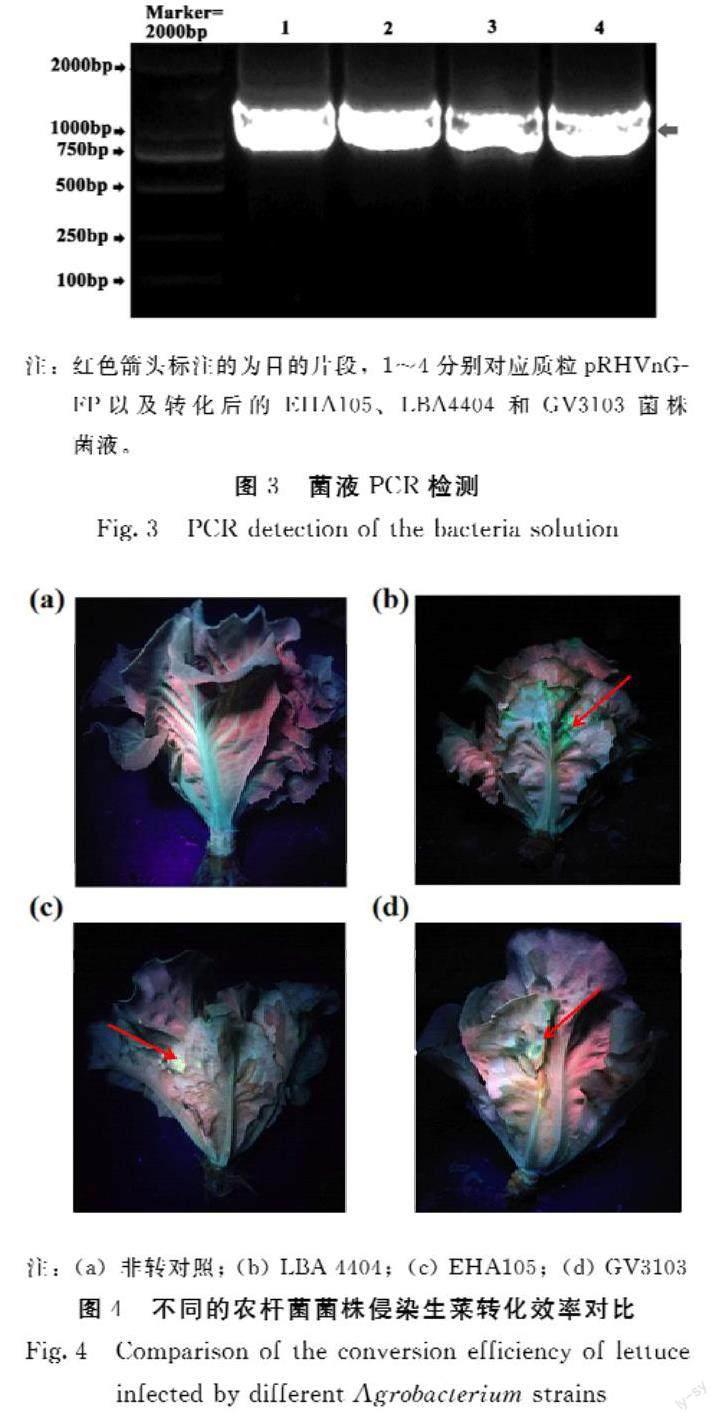
1.3.1 载体构建 以稳定表达载体pRHVnGFP为基础载体,利用限制性核酸内切酶Pst I和EcoR V对pRHVnGFP载体进行双酶切,利用同源重组的方法,将Ubipro启动子替换为35spro启动子。同源重组引物为pRHVcGFP35SF (agatcccccgaattactgcagGCGTATTGGCTAGAGCAGCTTG) 和pRHVcGFP35SR(atcccactggatctggatatcAGAGATAGATTTGTAGAGAGAGACTGGTG); 同源末端扩增引物为pRHVnGFP35sF (agatcccccgaattactgcagGCGTATTGGCTAGAGCAGCTTG)和pRHVnGFP35sR(gcccttgctcaccatgatatcAGAGATAGATTTGTAGAGAGAGACTGGTG)。在T4 DNA Ligase的作用下16℃连接过夜,将连接产物转化大肠杆菌DH5α,在添加50 mg·L-1卡那霉素的LB培养基上筛选,挑取单菌落进行菌液PCR检测;提取质粒,用Pst I/EcoR V酶双酶切对重组质粒进行酶切鉴定。将鉴定正确的阳性菌株送往生工生物工程(上海)有限公司测序以验证启动子是否正确。
1.3.2 农杆菌转化 采用冻融法将重组质粒分别转化至农杆菌EHA105、LBA4404和GV3103菌株,培养于含有50 mg·L-1利福平和50 mg·L-1卡那霉素的LB固体培养基上,并挑取单菌落进行PCR检测。
1.3.3 不同农杆菌菌株转化效率对比 分别挑取重组质粒转化农杆菌EHA105、LBA4404和GV3103菌株的单克隆接种到0.5 L添加抗生素的YEB液体培养基(50 mg·L-1利福平和50 mg·L-1卡那霉素)。將接种的培养物在摇床(220 r·min-1)中以28℃孵育48 h。通过添加YEB培养基测量OD600值并调节至3.5~4.5。然后收集培养液,离心(4500 r·min-1)10 min。将农杆菌细胞重悬在渗透培养基中培养至OD600为0.5。
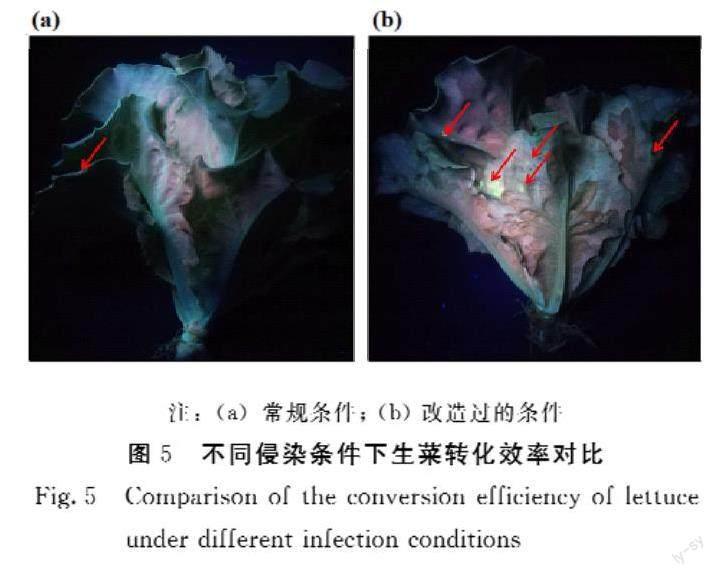
将制备好的农杆菌培养悬浮液置于2 L烧杯,置于干燥器中。用刀将前10%的生菜切除,将其倒置(核心向上)并轻轻地旋转于细菌悬浮液中,并干燥器密封。将真空泵(Welch Vacuum,Niles,IL,USA)打开以抽空,保持压力状态30~60 s。然后打开该系统以释放压力,使渗透液渗入组织内的空间。该过程重复2~3次,直到清晰可见渗透液在生菜组织中有明显扩散。然后将生菜组织从渗透液中轻轻取出,并用蒸馏水连续冲洗3次,转移到塑料膜覆盖的容器中。将处理的样品在黑暗中保持4 d,利用 LUYOR3415RC手持荧光灯对eYGFP的表达量进行初步观察分析并拍照记录。
1.3.4 农杆菌侵染条件优化 在确定农杆菌菌株EHA105、LBA4404和GV3103的转化效率以后,以转化效率最高的农杆菌菌株侵染生菜,优化农杆菌侵染条件,通过手持荧光灯对 eYGFP的表达量进行观察分析并拍照记录,最终确定最佳的农杆菌侵染条件。
2 结果与分析
2.1 GFP基因的瞬时表达载体构建
利用限制性核酸内切酶Pst I和EcoR V对质粒pRHVnGFP进行双酶切,回收酶切产物,与经相同酶切后的35spro启动子连接,将稳定表达载体pRHVnGFP(图1)的启动子Ubipro替换为35spro启动子,成功构建1个GFP基因的瞬时表达载体(图2)。
2.2 农杆菌转化
利用35spro F/35spro R引物分别对转化农杆菌EHA105、LBA4404和GV3103感受态细胞的载体质粒pRHVnGFP进行菌液PCR检测(图3),结果表明载体质粒已成功转化3种农杆菌感受态细胞中,可用于后续生菜瞬时转化。
2.3 不同农杆菌转化效率的比较
由图4可知,经激发光照射在已转化的生菜叶片区域可观察到eYGFP 绿色荧光信号(图 4b~d中红色箭头所示),红色为自发荧光。通过对比发现,在相同的菌液浓度、真空渗透压和渗透时间条件下,不同的农杆菌菌株LBA4404、EHA105和GV3103的转化效率不同,其中,经农杆菌LBA4404侵染后生菜叶片上检测到的eYGFP 绿色荧光信号最强(图4b),EHA105次之,GV3103最低。
2.4 农杆菌侵染条件优化
由图5可知,优化农杆菌LBA 4404真空渗透体系,以OD600为0.5的农杆菌菌液,不添加乙酰丁香酮,抽真空并保持压力状态60 s(重复3次),作为侵染条件,这样可以获得较高的转化效率(图5b)。观察经激发光照射在已转化的生菜叶片区域的eYGFP 绿色荧光信号(红色箭头所示),结果发现大量的eYGFP 绿色荧光信号,红色为自发荧光。而常规侵染条件下观察到的eYGFP 绿色荧光信号则较弱(图5a)。
3 结论与讨论
植物生物反应器在表达系统的分类上可分为稳定表达系统和瞬时表达系统。稳定表达系统将外源基因导入植物细胞中并完成整合,使其在生长过程中稳定表达,周期长,且需要严格管理种植环境,但是对目标蛋白的表达稳定。瞬时表达系统则是在外源基因导入宿主细胞后独立于宿主细胞基因组进行转录翻译,完成外源蛋白的表达与积累,具有周期短、产量高和操作简单的优势[9]。植物生物反应器中两种表达系统的目的都是完成对宿主细胞进行外源基因的导入,其中,稳定表达系统在完成表达载体的构建并进行稳定基因转化之后,需在高要求条件下对转化作物进行培育后才可收获,成本高,周期长,对生产环境要求高易造成生物污染。而在瞬时表达系统中,可直接对已经培育好的对应农作物或其离体叶片或愈伤组织进行病毒感染或农杆菌浸染完成转化,在几小时或几天内完成目的蛋白的生产和积累,该过程完全在密闭容器中进行,最大限度杜绝了生物安全问题,并且只要完成表达载体的建库即可做到相关蛋白的随时有需求随时可生产,且通过菌种的筛选以及培养浓度、侵染环境和侵染时间的调控还可提高瞬时转化的效率[10]。研究还表明优化转化条件时针对外源基因表达选择适合的启动子和增强子也可促进宿主植物中外源基因的表达,提高外源产物的产量[11]。
生菜为菊科莴苣属的一个变种,不需要加工即可在人体或动物体内的消化道中被有效吸收,且一年四季皆可收获,培育条件简单、生长周期短等特点奠定了其作为宿主在植物生物反应器中应用的巨大前景,其培育技术及遗传转化技术的成熟将大大降低其生产药用蛋白的成本[12]。番茄、生菜和一些水果可生食,避免在加热过程中使蛋白质变性的特点已被广泛用于生产食用疫苗的研究和开发当中[13-14]。当含有外源药用蛋白的生菜以食用的方式使用时,可以极大程度减轻患者的精神压力和经济压力。目前生菜已经成为一种非常高效,可重復,廉价的瞬时表达系统,可成功表达乙型肝炎amiRNA,小鼠食用后肝损伤得到了明显逆转[15]。未来生菜还将用于生产单克隆抗体和其他具有重要药用价值的蛋白质。
本研究以GFP基因为报告基因构建一个植物瞬时表达载体,并利用农杆菌真空渗透法转化生菜构建生菜瞬时表达系统,通过对比不同的农杆菌菌株EHA105、LBA4404和GV3103的转化效率,发现LBA4404最适合,转化效率最高。在此基础上,不断优化侵染条件,分别对比了3种农杆菌菌液浓度(OD600分别为0.2、0.5和0.8),添加和不添加乙酰丁香酮,以及不同的真空渗透压和渗透时间等条件下GFP 蛋白的表达情况,最终确定以OD600为0.5的农杆菌LBA 4404,不添加乙酰丁香酮,抽真空并保持压力状态60 s(重复3次),作为侵染条件,可以获得较高的转化效率。完成生菜高效瞬时转化体系条件优化,能够以生菜作为生物反应器高效快速及时地表达外源蛋白,满足生产需求。
参考文献:
[1]杨晶,杜林娜,王法微,等.新型植物生物反应器研究进展[J].生物产业技术,2018(5):104-109.
[2]王治,王跃驹.生物反应器植物工厂[J].生命世界,2019,360(10):46-47.
[3]“十二五”863计划现代农业技术领域“动植物生物反应器”主题项目各课题通过验收[J].中国农业科技导报,2017,19(6):139.
[4]杨贺.利用植物生物反应器生产药用蛋白的研究[J].吉林农业,2016(21):81.
[5]HUGUES F B, GARY K.Plantmade vaccines and therapeutics[J].Science,2021,373:740-741.
[6]HUEBBERS J W,BUYEL J F.On the verge of the marketPlant factories for the automated and standardized production of biopharmaceuticals[J].Biotechnology Advances,2021,46:107681.
[7]党伟华,李佳,王爱萍.重组蛋白在植物中表达及纯化的研究进展[C]//中国免疫学会.第十二届全国免疫学学术大会摘要汇编,2017:1.
[8]王跃驹,李文.生菜作为宿主在表达蛋白和/或多肽中的应用.CN201710458311.6[P].2017-10-10.
[9]许惠滨,王福祥.植物生物反应器表达系统研究进展[J].福建农业科技,2021,52(9):76-81.
[10]邹奇,潘炜松,邱健,等.植物生物反应器优化策略与最新应用[J].中国生物工程杂志,2023,1-27.
[11]CAI Y M,KALLAM K,TIDD H,et al.Rational design of minimal synthetic promoters for plants[J].Nucleic acids research,2020,48(21):11845-11856.
[12]罗雯,张同林,艾佐佐,等.意大利生菜转化体系建立及EV71抗原基因表达初探[J].生命科学研究,2018,22(3):208-214.
[13]钱虹妹.农杆菌介导的一种新型鲑鱼降钙素(msCT)转化生菜的研究[D].南京:南京农业大学,2004.
[14]李静.人干扰素β在生菜中的表达、鉴定和生物活性研究[D].泰安:山东农业大学,2007.
[15]ZHANG S,SANG X,HOU D,et al.Plantderived RNAi therapeutics:A strategic inhibitor of HBsAg[J].Biomaterials,2019,210:83-93.
(责任编辑:柯文辉)

