Notch1P1641S突变通过PI3K/Akt通路促进口腔鳞癌增殖
杨月美,宋晓萌,吴煜农
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)起源于口腔、咽部和喉部的黏膜上皮,是头颈部最常见的恶性肿瘤。作为人类第六大常见癌症,5年生存率<50%[1]。其中口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)简称口腔鳞癌,约占HNSCC的50%以上,常见的致病因素包括吸烟、饮酒、咀嚼槟榔等不良习惯[2]。目前OSCC的治疗主要以手术治疗为主,需要寻找新的治疗靶点。Notch蛋白作为高度保守的细胞表面配体,其正常功能是维持细胞增殖、分化所必需的。作为Notch家族成员之一,相较于Notch2~4受体而言,Notch1突变率更高。T细胞急性淋巴细胞白血病(T-cell acute lymphoblastic leukaemia,T-ALL)的特征是Notch1的激活突变,约有50%的T-ALL患者存在Notch1的突变[3-5]。实体肿瘤中,来自高加索患者的13种HNSCC细胞系中检测到6处核苷酸突变;四分之一的突变位于异二聚化结构区域(HD区域氨基酸1570—1734区域)[6]。我国51例口腔癌患者中检测到156处核苷酸突变,在22例患者中发现42处非同义突变,其中8例患者发现12处突变位于HD区域,5例患者的突变位于HD区域的1641位点氨基酸。3例患者的3处氨基酸突变位于1133位点氨基酸。研究中发现相较于Notch1未突变者,Notch1突变患者的总生存期和无病生存率明显缩短[7]。1133位点突变可促进OSCC细胞的增殖及侵袭。为此,本实验拟探究在OSCC中,1641位点的脯氨酸突变为丝氨酸后的分子机制。
1 材料与方法
1.1 细胞与试剂耗材
人口腔鳞状细胞癌细胞系CAL27(购自美国ATCC生物标准品资源中心),人舌鳞癌细胞系HSC3(南京医科大学附属口腔医院袁华课题组惠赠),DMEM/F-12培养基、胎牛血清(CellMax,中国),胰蛋白酶、青/链霉素双抗(碧云天,中国),对照组空载质粒PEGFP-N1、野生型质粒PEGFP-Notch-WT(Notch1WT)和突变型质粒PEGFP-Notch1-P1641S(Notch1P1641S)(捷瑞公司,中国),RNA提取相关试剂(Trizol等)(诺唯赞公司,中国),CCK-8试剂盒(APExBIO,美国),Transwell小室、PVDF膜(Millipore,美国),一抗:NICD(abcam,英国),pEGFR、EGFR、PI3K、PDK1、pAkt、Akt、pmTOR、mTOR、pErk1/2、Erk1/2(CST,美国),Ki67、β-actin(proteintech,中国),p70S6(Santa,美国)。
1.2 细胞培养及细胞转染
将CAL27及HSC3细胞以1×105个/孔接种于六孔板中,待细胞密度长至约70%时,按照ExFect Transfection Reagent说明书转染质粒。实验共分为3组:空白对照组转染PEGFP-N1(N1-N1)、野生型实验组转染PEGFP-Notch-WT(N1-WT)、基因突变组转染PEGFP-Notch1-P1641S(N1-P1641S),转染质粒6~8 h后更换新鲜完全培养液,2 d后提取细胞RNA,应用qPCR检测Notch1转录组表达量。3 d后提取细胞内的蛋白检测转染效率。
1.3 实时定量PCR实验
转染质粒2 d后,将处于对数生长期的口腔鳞癌细胞使用Trizol试剂进行总RNA分离,利用5×Prime Script RT Master Mix合成cDNA,使用SYBR Premix Ex TaqTMⅡ试剂盒进行实时定量qPCR。以GAPDH作为内参基因,采用2-ΔΔCT基因进行实时定量。引物序列如下。GAPDH,F:5′-GAGAAGTATG-ACAACAGCCTCAA-3′,R:GCCATCACGCCACAGTTT-3′;PI3K,F:5′-CCACGACCATCATCAGGTGAA-3′,R:5′-CCTCACGGAGGCATTCTAAAGT-3′;Notch1,F:5′-TATTTGGACTTTGCGACAAGACT-3′,R:5′-TCGAA-CGTACTGGTCTGGATAG-3′。
1.4 CCK-8增殖实验
转染后72 h的细胞计数后按照每孔2×103个的密度置于96孔板中,每个实验组重复3次,待细胞贴壁后,检测第0天初始细胞增殖效率。按照说明书,将CCK-8溶液用新鲜培养液稀释成10%的浓度,孵育2 h后,在450 nm波长浓度下检测吸光度。连续测量4 d,绘制曲线。
1.5 EdU标记增殖细胞
转染质粒后的舌鳞癌细胞经细胞计数,1×104个细胞培养至24孔板中,过夜培养且恢复至正常形态后,按说明书配制EdU工作液加入至孔内,继续培养2 h,弃培养液后,细胞经过固定、洗涤、通透,加入反应液后,洗涤、核染,显微镜下观察并分析细胞染色。
1.6 集落形成实验
转染72 h后的细胞,经过计数,将2×103个的细胞置于中皿中,每3 d换1次液,培养2周后观察每个细胞团块大小,每个细胞团块中细胞数量>50个终止培养,4%多聚甲醛固定30 min,结晶紫染色15 min,流水轻轻冲洗,干燥后使用扫描仪拍摄。
1.7 划痕实验
转染72 h的细胞,重新铺板置于24孔板中,以200 μL的黄色枪头在孔板底部正中进行划痕,各组间保持力度一致,PBS清洗两遍,显微镜观察。若实验组与N1-N1组初始宽度相同,则摄取图片,待一组细胞闭合时再次摄取图片。划痕闭合率=(初始宽度-终末宽度)/初始宽度×100%。
1.8 Transwell细胞侵袭实验
将Matrigel基质胶与无血清培养基按1∶6的比例配制稀释液,取50 μL稀释液加入Transwell上室中,转入37 ℃培养箱中4 h待基质胶凝固,转染质粒后的CAL27、HSC3细胞经过计数,取含5×104个细胞的无血清培养基单细胞悬液150 μL加入Transwell上室。24孔板加入800 μL含10%胎牛血清的完全培养基,置37 ℃培养箱内培养36 h后取出Transwell小室,甲醛固定30 min,结晶紫染色15 min,镜下观察下室细胞,使用Image J分析细胞数量。
1.9 蛋白提取及蛋白印迹实验
按照说明书,将转染质粒的六孔板置于冰上,RIPA蛋白裂解液与磷酸酶抑制剂(碧云天)加入六孔板的每个孔中,静置15 min,吸取细胞与蛋白裂解液的混合溶液,离心取上清液,加入四分之一体积的SDS-PAGE上样缓冲液,100 ℃加热15 min。取适量的上样量于提前制备的蛋白凝胶中,90 V恒压电泳,300 mA恒流转膜,5%脱脂奶粉封闭2 h,封入相应的一抗中,4 ℃过夜,蛋白条带置于二抗(抗鼠+抗兔)中,室温孵育2 h,TBST清洗3遍,使用ECL发光液试剂盒(天能)成像显色。使用Image J软件分别对目标条带及β-actin条带灰度值进行量化,通过标准化计算得到最终量化结果。
1.10 动物实验
15只5周龄BALB/c裸鼠购自南京医科大学动物实验中心,适应性培养1周后用于后续实验。15只裸鼠随机分为3组,每组5只,分别为空白对照组:N1-N1组,野生型组:N1-WT组,基因突变组:N1-P1641S组。将转染Notch1N1、Notch1WT、Notch1P1641S三种质粒的HSC3细胞,制备成50 μL,细胞量约为5×106个,与50 μL的基质胶等体积混合均匀后分别注射至3组裸鼠背部。经过24 d,处死小鼠,取背部肿瘤拍照称重,测量肿瘤长度a、宽度b,计算体积V,V=(a×b2)/2并进行免疫组化。
1.11 免疫组化
取小鼠背部肿物,经4%多聚甲醛浸泡,流水冲洗过夜,脱水包埋后为石蜡包块。石蜡切片机切片,梯度脱蜡、水化,抗原修复后一抗过夜,PBS洗3遍后封二抗,室温下孵育30 min,PBS洗3遍,按照说明书经DAB显色,苏木素染色,梯度脱水,干燥后中性树胶封片留存。
1.12 统计学分析
数据使用Graphpad Prism 8.0版本进行分析,多组比较采用one-way ANOVA单因素方差分析,组间比较采用Dunnett检验。P<0.05代表差异有统计学意义。
2 结 果
2.1 细胞转染效率验证
CAL27和HSC3细胞转染Notch1N1、Notch1WT、Notch1P1641S三种质粒,采用PCR在转录水平验证转染效率,在CAL27细胞中,野生型组和基因突变组Notch1基因RNA的表达水平分别是空白对照组(2 089.14±134.42)、(4 365.28±385.02)倍。在HSC3细胞中,野生型组和基因突变组Notch1基因RNA的表达水平分别是空白对照组(1 873.25±218.29)和(4 527.19±297.16)倍,如图1所示,使用Graphpad Prism 8.0 软件Dunnett检验方法分析结果显示,两种细胞中转染Notch1WT、Notch1P1641S质粒后Notch1基因转录水平与对照组相比转染效率具有统计学差异(P<0.01)。
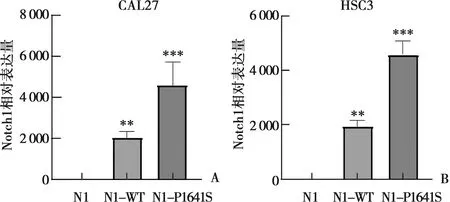
A:CAL27细胞Notch1基因mRNA水平;B:HSC3细胞Notch1基因mRNA水平;与N1组相比,Dunnett检验,**:P<0.01;***:P<0.001
2.2 表型实验
2.2.1 细胞增殖实验
CCK-8实验结果如图2显示,转染质粒后的舌鳞癌肿瘤细胞连续培养4 d,每天同一时间点使用CCK-8检测试剂检测细胞的OD值,CAL27与HSC3细胞在培养第4天时,与空白对照组相比,基因突变组细胞的吸光度提高,差异具有统计学意义(P<0.01),提示其细胞增殖能力提高。
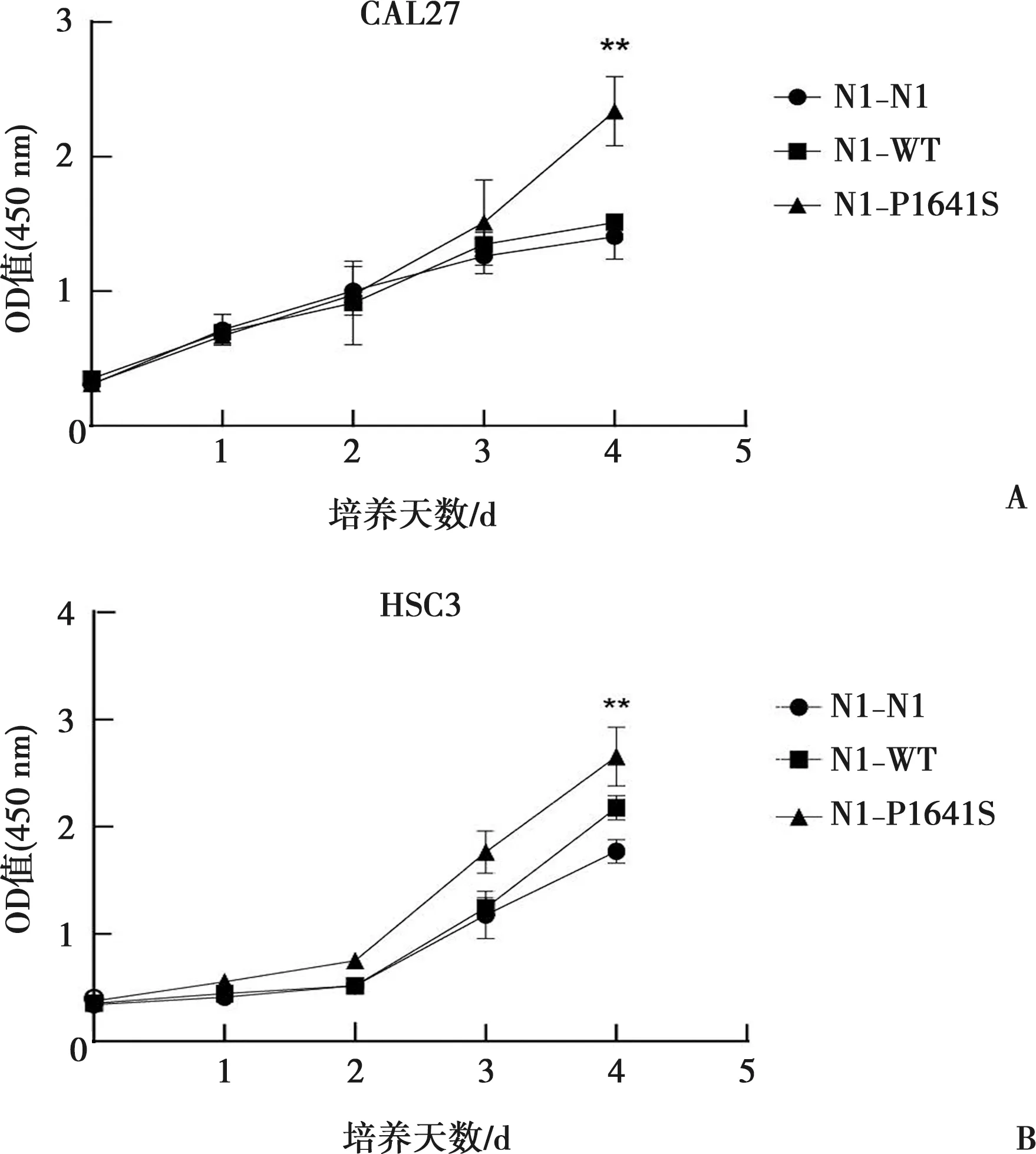
A:CAL27细胞增殖曲线;B:HSC3细胞增殖曲线;**:细胞培养至第4天时,与N1-N1组相比,Dunnett检验,P<0.01
EdU荧光实验如图3显示,转染Notch1N1、Notch1WT、Notch1P1641S三种质粒,在保证细胞数量基本相同的情况下,突变组舌鳞癌细胞的EdU染色阳性细胞数量更多,表明基因突变组细胞的增殖能力增强。
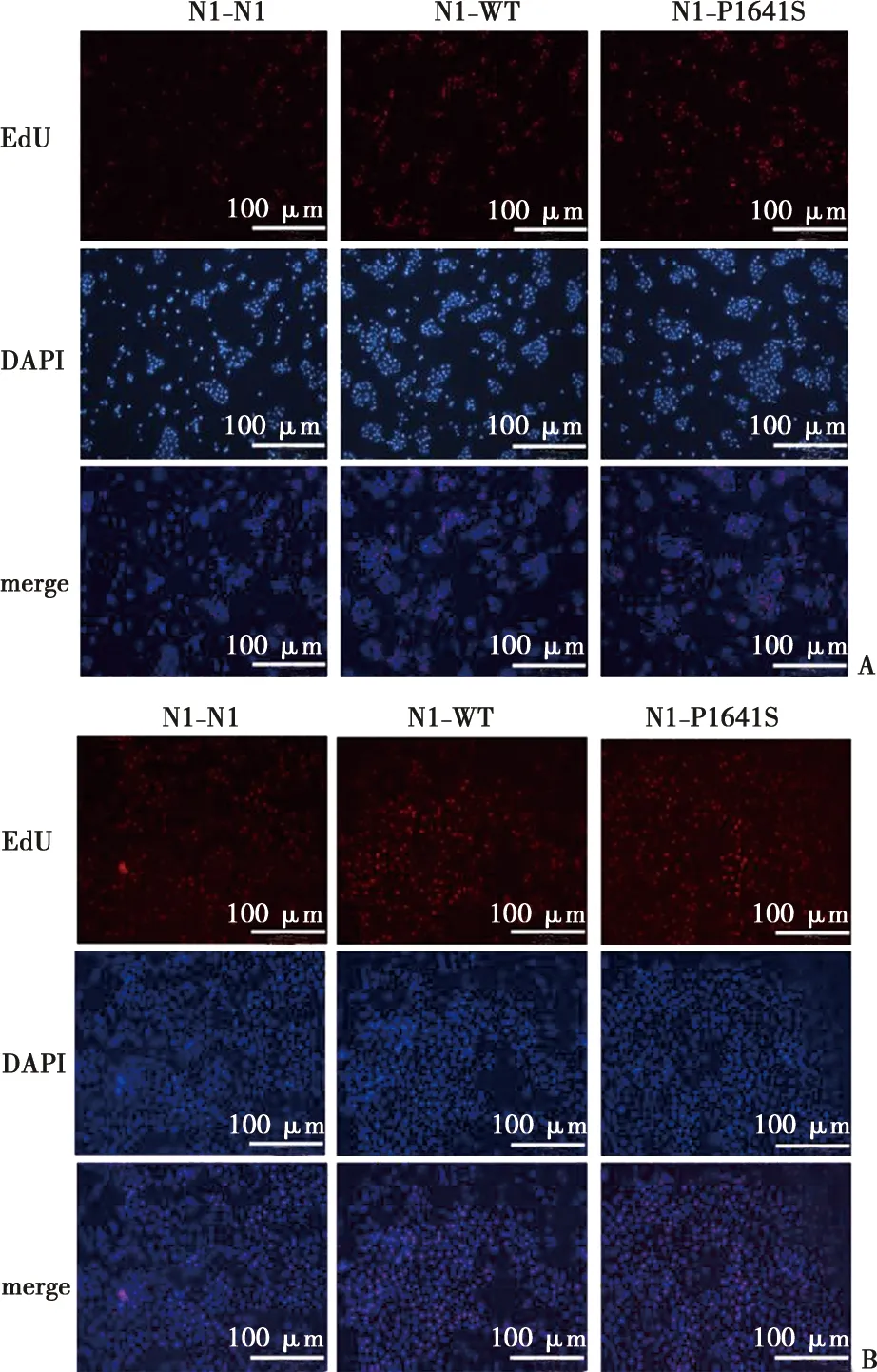
A:CAL27细胞EdU染色后的镜下图; B:HSC3细胞EdU染色后的镜下图;比例尺=100 μm( ×100)
平板克隆形成实验结果如图4显示,初始细胞数量相同的情况下,培养相同时间,基因突变组肿瘤细胞由单个细胞形成的细胞团更多,表明在相同时间内,基因突变组肿瘤细胞的分裂能力增强,细胞增殖能力增强。
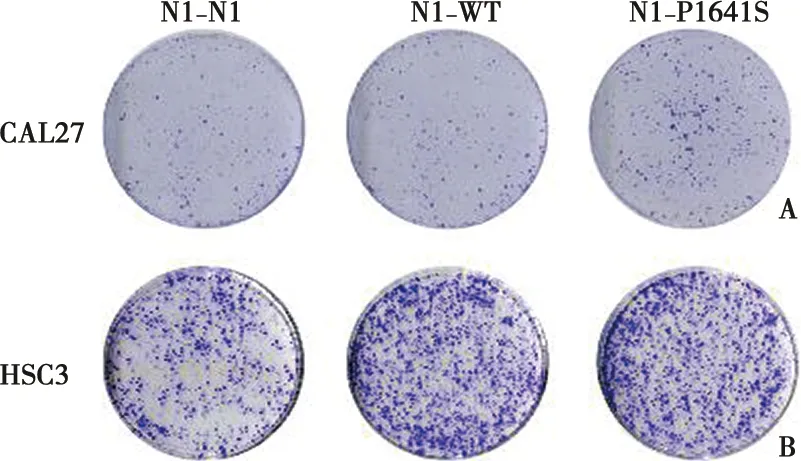
A:CAL27细胞培养14 d平板克隆形成结晶紫染色后扫描图; B:HSC3细胞培养14 d平板克隆形成结晶紫染色后扫描图
2.2.2 细胞迁移侵袭能力检测
划痕实验结果如图5显示,CAL27细胞转染Notch1N1、Notch1WT、Notch1P1641S三种质粒后细胞划痕闭合率百分比分别为(75.37±0.42)%、(86.93±0.56)%、(92.31±0.39)%;与对照组相比,野生型组和基因突变组肿瘤细胞的迁移能力增强(P<0.001);HSC3细胞转染质粒后划痕闭合百分比分别为(65.32±0.54)%、(78.81±0.37)%、(91.43±0.23)%, 与对照组相比, 野生型组与基因突变组肿瘤细胞的迁移能力均增强(P<0.001)。
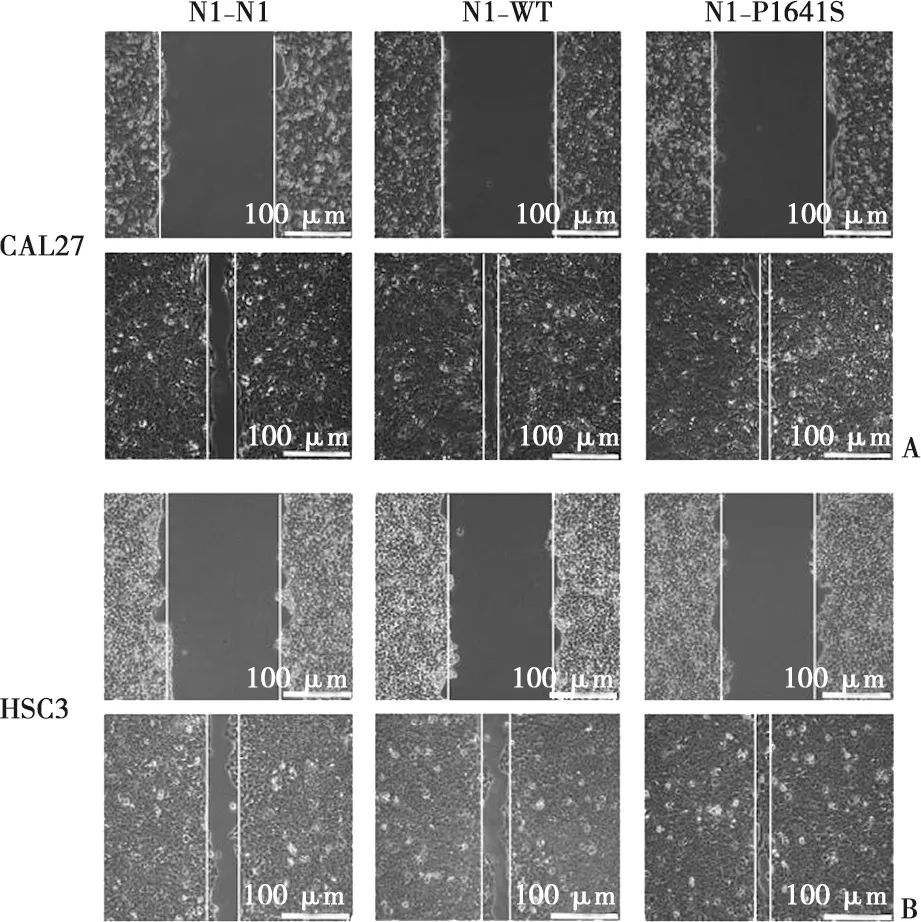
A:CAL27细胞迁移18 h镜下图;B:HSC3细胞迁移24 h镜下图;比例尺=100 μm( ×100)
Transwell细胞侵袭实验结果如图6显示,通过比较相同时间单位面积内下室细胞的数量观察细胞的侵袭能力。CAL27细胞转染三种质粒后每个视野中下室细胞的数量分别为(283.48±21.37)个、(496.42±20.81)个、(636.26±54.62)个;与对照组相比,野生型组和基因突变组肿瘤细胞的侵袭迁移能力均增强(P<0.001)。HSC3细胞转染三种质粒后每个视野中下室细胞数量分别为(155.43±29.36)个、(213.29±16.52)个、(526.31±34.04)个。与对照组相比,野生型组肿瘤细胞的侵袭迁移能力未见明显增强(P=0.07),基因突变组细胞的侵袭迁移能力增强(P<0.001)。
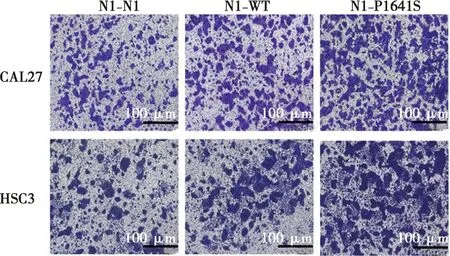
CAL27、HSC3细胞侵袭实验结晶紫染色后镜下图;比例尺=100 μm( ×100)
以上结果表明,Notch1P1641S突变后,细胞的增殖、迁移及侵袭能力均增强。
2.3 Notch1突变后激活PI3K/Akt信号通路
转染72 h后,CAL27及HSC3细胞提取蛋白。经Westen blot蛋白分析发现,图7所示,与空白对照组相比,转染Notch1WT质粒后,细胞内的NICD表达量升高,但转染Notch1P1641S质粒的肿瘤细胞内NICD的表达量并未升高,考虑Notch1P1641S质粒并未激活经典的Notch1信号通路。与转染Notch1N1质粒相比,转染Notch1P1641S质粒后pErk1/2、pmTOR、pAkt、PDK1及pEGFR蛋白表达量升高,表明Notch1P1641S基因突变后在一定程度上激活了PI3K/Akt信号通路。
2.4 动物实验
HSC3细胞Notch1N1、Notch1WT、Notch1P1641S三种质粒注射到裸鼠背部皮下,观察24 d后,取下小鼠背部肿瘤组织,实验结果显示,三组小鼠成瘤体积分别为(80.41±2.46)mm3、(139.74±14.29)mm3、(291.53±31.28)mm3,与对照组相比,N1-P1641S组小鼠皮下成瘤体积更大(P<0.01)(图8)。Ki67作为细胞增殖的核抗原,已成为检测细胞增殖的常用指标。免疫组化结果显示,DAB显色相同时间内突变组小鼠肿瘤组织切片内Ki67染色阳性细胞数量增多表明细胞的增殖能力增强。pAkt染色结果显示,相较于N1-N1组及N1-WT组小鼠肿瘤相比,N1-P1641S组小鼠肿瘤的pAkt表达更强,提示激活PI3K/Akt信号通路在一定程度上可以促进肿瘤生长(图9)。
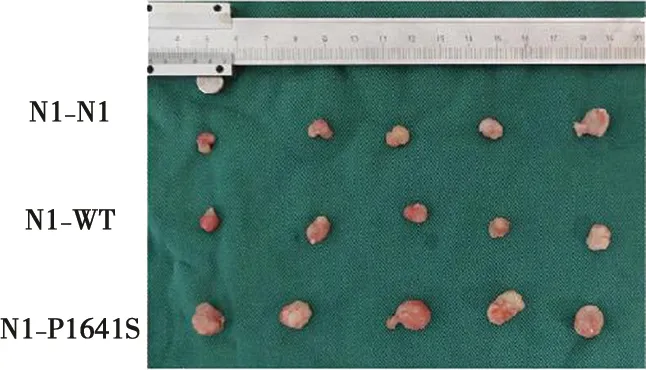
图8 转染突变质粒对裸鼠皮下移植瘤生长的影响

图9 HSC3 细胞移植瘤免疫组化染色
3 讨 论
Notch1作为跨膜受体,在细胞的增殖分化过程中发挥着重要作用,当Notch1与相应受体结合被激活后,Notch1经过相应的剪切,释放NICD,NICD转移到细胞核中并激活下游靶点[8]。在T-ALL中,Notch1激活突变导致下游的HES1及Myc等下游蛋白的表达显著减少[9-11]。在实体肿瘤中,Notch1的角色一直存在争议,一方面,Notch1信号表现出多种致癌作用,如诱导耐药[12]、抑制细胞凋亡、诱导上皮间充质转化[13-14]、诱导血管生成等促癌表型;另一方面,Notch1又可以作为肿瘤抑制因子。在Notch1基因条件敲除小鼠中,可以观察到基底层增生及基底细胞癌样病变[15]。
本实验中,转染Notch1质粒,在转染效率差异有统计学意义的情况下,通过表型实验发现突变后细胞的增殖、迁移、侵袭能力增强。蛋白水平检测发现突变后细胞中PI3K/Akt信号通路表达增强。体内动物实验发现,突变细胞的成瘤体积增大,Ki67及pAkt的表达增强。Akt作为PI3K/Akt信号通路的中心节点,在口腔癌中被频繁激活[16-17]。在T-ALL中,Notch1信号通路与PI3K/Akt信号通路之间的关系被广泛研究,Notch1信号下游分子HES1的激活抑制了磷酸酶与张力蛋白同源物PTEN的表达,导致PI3K的激活[18]。本实验中,Notch1P1641S转染后NICD的表达并未增多,说明并未激活经典的Notch1信号通路,而是通过PI3K/Akt信号通路发挥作用。因此,我们做出推测:Notch1的促癌作用与此次突变的位点有关。在T-ALL中HD结构域突变与Notch1信号通路异常关系密切,突变后的Notch1信号异常导致S1切割效率降低,细胞表面表达减少[19]。先前研究发现Notch1在实体瘤中是细胞膜靶向的跨膜受体,我们猜测突变后的Notch1蛋白未表达在细胞膜上,这可能解释裸鼠成瘤后野生型组内角化珠表达明显增多。另一种原因可能与突变后氨基酸的种类有关,在相同的实验条件下,脯氨酸突变为亮氨酸并未表现出相同的生物学表型[20],为此我们猜想这一表型是由于脯氨酸突变为丝氨酸形成的。在宏观层面上,早期的研究发现,饮食中缺乏丝氨酸可以降低血浆中丝氨酸的含量,从而减少某些类型肿瘤的生长。微观层面分析,肿瘤的快速增殖需要大量的丝氨酸,丝氨酸在线粒体中的分解代谢提供了大部分的一碳单位,作为原料进一步为肿瘤进展提供原料[21]。虽然这种丝氨酸突变形成的一系列生物学表型是否为Notch1-HD区域所特有的,我们不得而知,但可以肯定的是,丝氨酸在维持细胞功能方面发挥着重要作用。
综上所述,Notch1P1641S的突变与舌鳞状细胞癌的增殖、侵袭、迁移有关,可为头颈鳞癌的治疗提供靶点,但Notch1-HD区域的突变是否产生同样的生物学作用有待进一步探究。

