葡萄糖调节蛋白78对顺铂治疗舌鳞癌细胞增殖、迁移和侵袭的影响
邱 波,王冠楠,谷艳娇,黄克强,苏荣健,胡 静
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)是口腔癌中最常见的恶性肿瘤之一,其发病率在世界癌症中排名第七[1-2]。舌鳞癌治疗仍以手术切除原发病灶及颈部淋巴结清除术为主,并在手术前或手术后配合化疗,以抑制肿瘤的生长以及远处转移。顺铂(cisplatin,DDP)是TSCC治疗常用的化疗药物,而化疗过程中耐药细胞的出现可导致TSCC的复发和转移[3-4]。舌鳞癌的复发和转移是影响患者5年生存率的重要因素,因此深入研究舌鳞癌复发和转移的分子机制,寻找新的治疗靶点对舌鳞癌患者的预后具有重要意义。葡萄糖调节蛋白78(glucose regulated protein78,GRP78)是一种多功能蛋白质,参与细胞分化、细胞生存、肿瘤血管形成、肿瘤发生进展、肿瘤细胞免疫逃避、肿瘤化疗的耐药性等许多重要的细胞活动。本课题组的前期实验证实GRP78可通过活化Src激酶来提高肝癌细胞的侵袭转移能力[5]。顾雪等[6]的研究证实GRP78通过MEK/ERK信号通路参与了卵巢癌细胞的侵袭转移过程。而GRP78在舌鳞癌中对肿瘤的生长和转移的影响少有报道,本研究首先通过蛋白质免疫印迹实验检测舌鳞癌细胞及舌鳞癌DDP耐药细胞中GRP78的表达水平,然后利用RNA干扰技术敲减舌鳞癌DDP耐药细胞GRP78表达,进一步研究GRP78对舌鳞癌细胞生长和侵袭转移的影响。
1 材料与方法
1.1 细胞和主要实验材料
舌鳞癌细胞株CAL27及舌鳞癌DDP耐药细胞株CAL27DR由山东大学李敏启教授赠送;DMEM培养基购自美国Hyclone公司,胎牛血清购自美国CLARK公司;GRP78、FAK、p-FAK、E-cad、N-cad、p-ERK、ERK、p-AKT、AKT、β-actin一抗购自美国Cell Signaling公司;DDP购自美国Sigma公司;Transwell小室购自美国Corning公司;BCA蛋白定量试剂盒购自中国碧云天公司;转染试剂购自中国百恩维生物科技有限公司,siGRP78质粒购自中国吉凯基因公司。
1.2 细胞转染
取对数生长期CAL27DR细胞,胰酶消化后将细胞接种于六孔培养板,待细胞密度生长至60%~70%后进行转染。转染前将细胞用不含抗生素的完全培养基过夜培养,分为对照组和siGRP78组,分别将空载体质粒和siGRP78质粒转染到细胞中,按照PEI转染试剂说明书进行操作,然后将细胞放回培养箱继续培养48 h用于后续实验。
1.3 MTT实验检测细胞增殖情况
胰酶消化细胞制成单细胞悬液,以每孔5 000个细胞接种于96孔板,每孔体积200 μL,24 h后0、1.0、2.5、5.0、7.5、10.0、15.0 μmol/L DDP分别处理CAL27和CAL27DR细胞,0、2.5、5.0、10.0 μmol/L DDP分别处理对照和siGRP78CAL27DR细胞,48 h后每孔加MTT溶液(5 mg/mL)20 μL,继续孵育4 h,终止培养,小心吸弃孔内培养上清液,每孔加150 μL DMSO,振荡10 min,使结晶物充分融解,选择490 nm波长,在酶联免疫监测仪上测定各孔光吸收值并记录结果。
1.4 EdU实验检测细胞增殖情况
胰酶消化对照和siGRP78细胞制成单细胞悬液以2×104个/孔的数量接种于共聚焦培养皿,0、2.5、5.0、10.0 μmol/L DDP处理细胞,48 h后按照EdU试剂盒操作说明进行实验,共聚焦显微镜拍照分析。
1.5 划痕实验检测细胞迁移能力
胰酶消化细胞后以1×105个/孔的数量接入6孔板,培养24 h后DMSO和DDP(5 μmol/L)分别处理对照和siGRP78细胞48 h,待细胞密度达到90%以上后,用200 μL枪头垂直于孔板底制造划痕,确保各孔划痕宽度一致,继续培养24 h,倒置显微镜观察创面愈合情况并拍照。
1.6 Transwell实验监测细胞侵袭能力
DMSO和DDP(5 μmol/L)分别处理对照和siGRP78细胞48 h,胰酶消化细胞,用无血清培养基调整细胞悬液浓度为5×105个/mL,50 mg/L Matrigel 1∶8稀释液包被Transwell小室底部膜的上室面,24孔板的下室加入600 μL含10%血清的培养基,上室加入100 μL制备好的细胞悬液,继续培养24 h,取出Transwell小室,弃去孔中培养液,然后用棉签擦去表面未侵入细胞,甲醇固定10 min,0.3%结晶紫染色30 min,将小室风干,倒置显微镜观察细胞侵袭情况,随机选择三个视野计数穿膜的细胞数量,并求其平均值。
1.7 免疫荧光实验
胰酶消化对照和siGRP78细胞制成单细胞悬液以1×104个/孔的数量接种于共聚焦培养皿,0、2.5、5.0、10.0 μmol/L DDP处理细胞,48 h后4%多聚甲醛固定15 min,PBS洗涤3次,0.5% TritonX-100处理10 min,BSA封闭30 min,Cortactin一抗4 ℃孵育过夜,PBS洗涤3次,DAPI染色5 min,激光扫描共聚焦显微镜观察拍照。
1.8 Western blot检测蛋白表达情况
收集CAL27和CAL27DR细胞,DMSO和DDP(5 μmol/L)分别处理对照和siGRP78细胞,48 h后收集细胞,RIPA buffer 200裂解细胞,BCA蛋白定量试剂盒进行蛋白定量,10% SDS-PAGE分离胶电泳,1% BSA封闭1 h,一抗4 ℃孵育过夜、洗膜、HRP标记的二抗孵育1 h,化学发光显色液显色,测定黏着斑激酶(focal adhsion kinase,FAK)、p-FAK、E-cad、N-cad、p-ERK、ERK、p-AKT、AKT、GRP78的表达。并使用Image J 10411软件进行量化。
1.9 统计学分析
应用SPSS 18.0软件对实验结果进行统计学分析,多组间比较采用单因素方差分析,两组数据进行比较采用t检验,P<0.05代表差异具有统计学意义。
2 结 果
2.1 舌鳞癌DDP耐药细胞增殖能力升高
应用DDP(0、1.0、2.5、5.0、7.5、10.0、15.0 μmol/L)处理CAL27和CAL27DR细胞,48 h后采用MTT法检测细胞活力。结果显示:随着DDP浓度的升高,两种细胞的增殖能力均逐渐降低,CAL27细胞的半数抑制浓度约为2.5 μmol/L,而CAL27DR细胞的半数抑制浓度约为7.5 μmol/L,与CAL27细胞相比,CAL27DR细胞增殖能力显著升高(图1)。
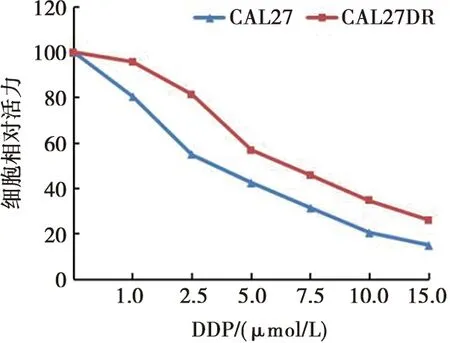
图1 舌鳞癌顺铂耐药细胞增殖能力升高
2.2 GRP78在舌鳞癌DDP耐药细胞表达水平升高
应用Western blot实验检测CAL27和CAL27DR细胞GRP78蛋白的表达情况,结果显示:在CAL27和CAL27DR细胞中GRP78蛋白相对表达值分别为(0.88±0.02)、(1.19±0.03),两组比较差异具有统计学意义(图2)。
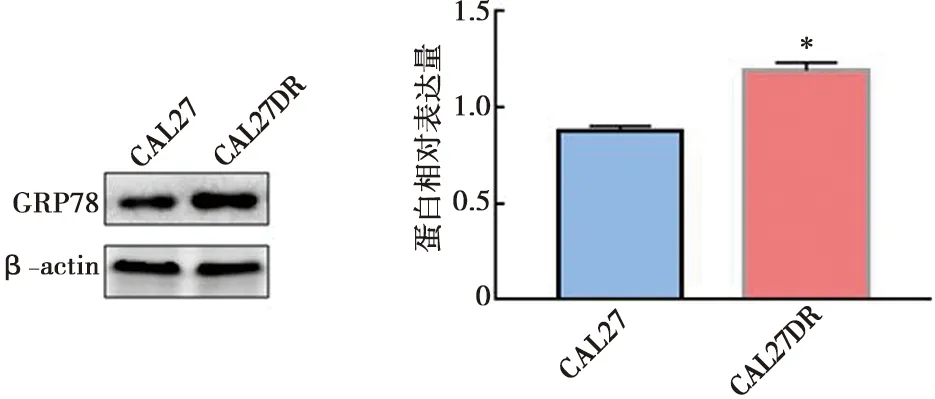
*:CAL27DR与CAL27细胞比较,t检验,P<0.05,GRP78表达水平显著升高
2.3 GRP78对舌鳞癌细胞增殖能力的影响
GRP78在DDP耐药细胞中表达水平显著升高,为了验证GRP78是否参与调控了舌鳞癌细胞对DDP的敏感性,我们利用RNA干扰技术在CAL27DR细胞中降低GRP78的表达水平(图3),然后应用DDP(0、2.5、5.0、10.0 μmol/L)处理细胞,48 h后应用MTT实验检测细胞增殖能力,结果显示(图4A):对照组细胞增殖率分别为(100.00±0.00)%、(86.18±2.99)%、(66.01±7.40)%、(33.15±2.19)%,细胞的半数抑制浓度约为7.5 μmol/L,siGRP78组细胞增殖率分别为(100.00±0.00)%、(65.35±2.40)%、(48.40±2.95)%、(23.52±2.62)%,细胞的半数抑制浓度约为5 μmol/L,与对照组相比,siGRP78组细胞增殖能力显著降低(P<0.05),EdU实验结果(图4B)与MTT实验结果相一致。这些结果表明GRP78表达水平升高可能是舌鳞癌细胞对DDP敏感性降低的原因。
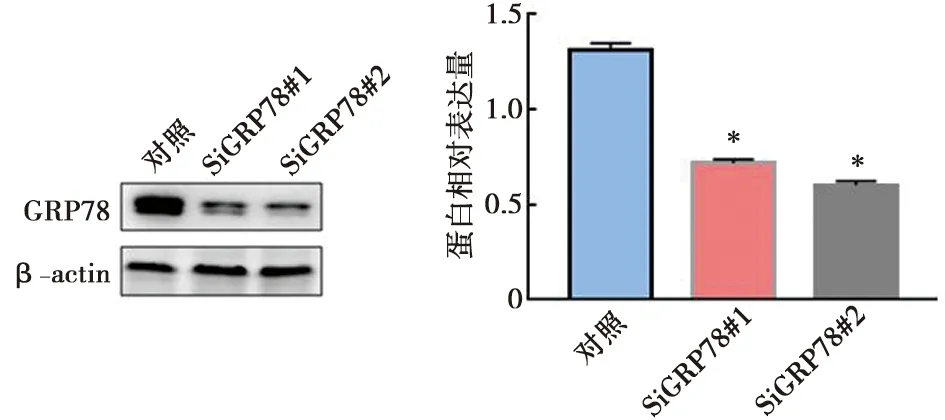
*:siGRP78与对照细胞比较,采用t检验, P<0.05
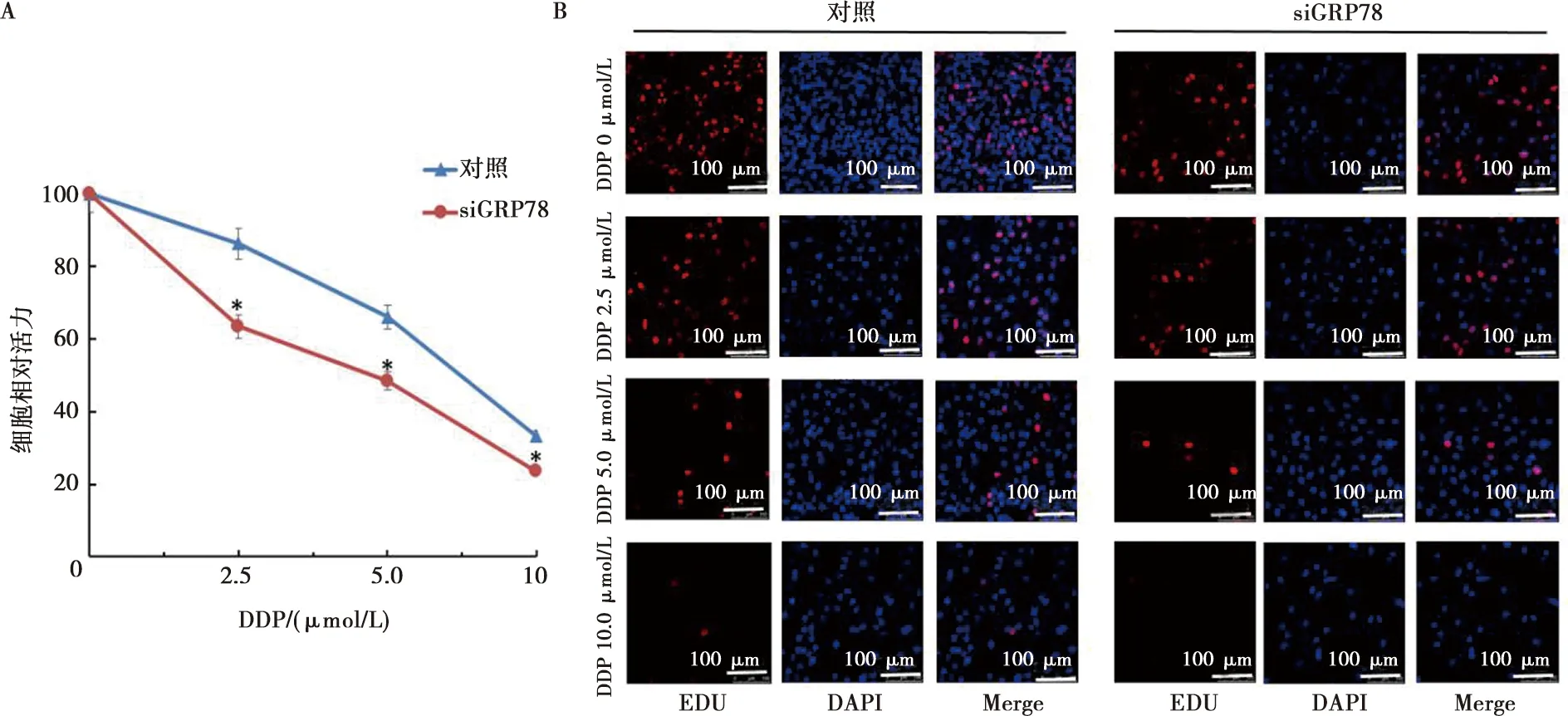
A:MTT实验检测细胞生存率;B:EdU实验检测细胞增殖情况( ×200);*:siGRP78与对照细胞比较,采用t检验,P<0.05
2.4 GRP78对舌鳞癌细胞迁移能力的影响
细胞划痕实验结果(图5)显示DMSO处理后对照组细胞迁移距离(41.83±4.20)μm,siGRP78组细胞迁移距离(22.67±2.82)μm,与对照组相比,siGRP78组细胞迁移距离显著降低(P<0.05);DDP处理后对照组细胞迁移距离(33.13±2.93)μm,siGRP78组细胞迁移距离(11.82±0.40)μm,与对照组相比,siGRP78组细胞迁移距离显著降低(P<0.05)。以上结果表明GRP78促进舌鳞癌细胞的侵袭转移能力。
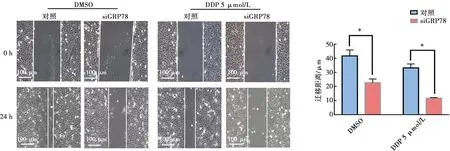
*:siGRP78与对照比较,采用t检验,P<0.05
2.5 GRP78对舌鳞癌细胞侵袭能力的影响
Transwell实验结果(图6)显示DMSO处理后对照组细胞侵袭数(404±15)个,siGRP78组细胞侵袭数(227±13)个,与对照组相比,siGRP78组细胞侵袭数量显著降低(P<0.05);DDP处理后对照组细胞侵袭数(137±8)个,siGRP78组细胞侵袭数(61±7)个,与对照组相比,siGRP78组细胞侵袭数量显著降低(P<0.05)。
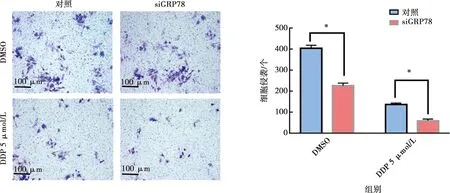
*:siGRP78与对照比较,t检验,P<0.05
2.6 GRP78对舌鳞癌细胞侵袭伪足形成的影响
为了探讨GRP78促进舌鳞癌侵袭转移的机制,我们应用免疫荧光实验检测与细胞伪足形成有关蛋白Cortactin的表达情况。实验结果显示(图7):与对照组相比,siGRP78组Cortactin的荧光强度显著降低,这提示GRP78可参与调控舌鳞癌细胞侵袭性伪足的形成。
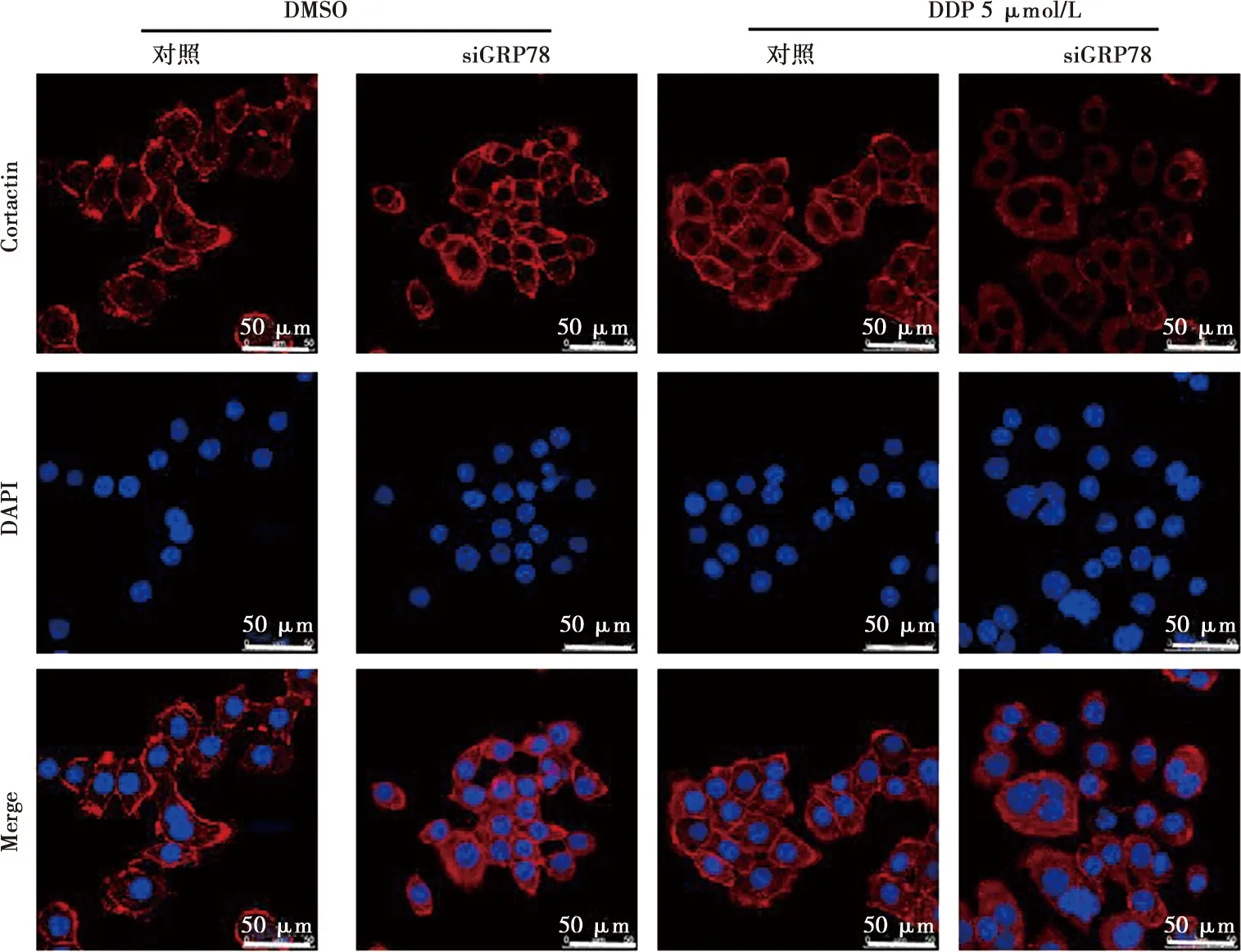
图7 GRP78对CAL27DR细胞Cortactin蛋白表达的影响( ×400)
2.7 GRP78对细胞增殖及侵袭转移相关信号通路激酶的影响
为了进一步探索GRP78对细胞增殖及侵袭和转移影响的机制,我们应用Western blot实验检测细胞增殖及侵袭转移相关激酶的表达情况,结果显示:与对照组相比,siGRP78组ERK、AKT蛋白表达水平无明显变化,而p-ERK、p-AKT蛋白表达水平明显降低(P<0.05)(图8A),FAK蛋白表达水平无明显变化,但p-FAK蛋白表达水平显著降低(P<0.05),与EMT发生相关蛋白N-cad表达水平显著降低(P<0.05),E-cad表达水平显著升高(P<0.05)(图8B)。这些结果表明GRP78可能通过ERK及AKT信号通路调控细胞的增殖能力,并通过FAK激酶调控细胞的侵袭转移能力。
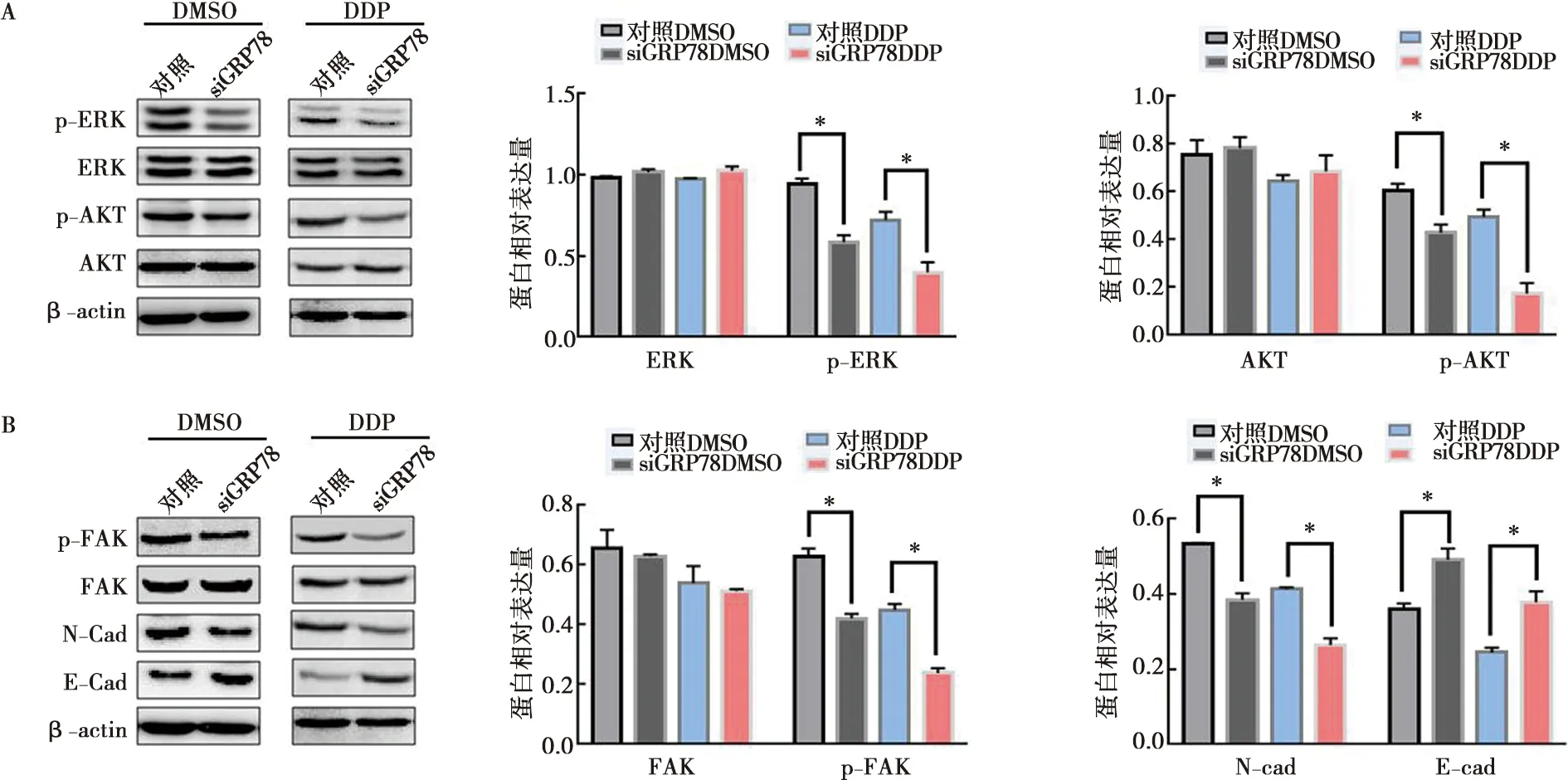
A:Western blot实验检测细胞ERK、p-ERK、AKT和p-AKT蛋白表达;B:Western blot实验检测细胞FAK、p-FAK、N-cad和E-cad蛋白表达;*:siGRP78与对照比较,采用t检验,P<0.05
3 讨 论
越来越多的研究表明GRP78的表达与肿瘤的生长、侵袭转移和治疗后复发密切相关[7-10]。我们研究中发现GRP78在舌鳞癌DDP耐药细胞中表达水平显著升高,这提示舌鳞癌对DDP的敏感性降低可能与GRP78表达水平升高有关。为了进一步研究GRP78的表达是否参与舌鳞癌DDP治疗后复发和转移,我们在舌鳞癌DDP耐药细胞中敲减GRP78后发现与对照组相比,GRP78敲减组细胞活力显著降低,对DDP的敏感性升高,细胞划痕实验和Transwell实验结果显示与对照组相比,GRP78敲减组细胞侵袭转移能力也显著降低。这表明GRP78表达水平升高是舌鳞癌DDP治疗后复发和转移的一个重要因素。
细胞外信号调节激酶1/2(extracelluar signal regulated kinase 1/2,ERK1/2)主要位于细胞质内,其在调节肿瘤细胞增殖、侵袭和迁移方面起到重要作用和氨基末端激酶(c-Jun N-terminal kinase,JNK)是丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPKs)的重要组成部分[11-12]。PI3K/AKT通路是一条与细胞增殖、迁移、蛋白质合成、血管生成、化学耐药等多方面有关的重要通路,在肿瘤的发生发展中起到重要的调控作用[13-14]。范丽梅等[15]的研究表明抑制GRP78表达能与DDP协同作用增加细胞凋亡的发生而逆转卵巢癌SKOV3/DDP细胞对DDP的耐药性,其机制可能是通过影响AKT/mTOR信号通路的活性导致的。也有学者研究证明GRP78参与调节ERK激酶的活化并促进肝癌的发生发展[16]。我们的研究也证实在舌鳞癌DDP耐药细胞中抑制GRP78表达能与DDP协同显著降低ERK、AKT激酶的磷酸化水平,这说明在舌鳞癌中GRP78可能通过ERK和AKT信号通路调控细胞对DDP的耐药性。
有研究认为钙黏附蛋白N(N-cad)的异常表达与肿瘤的侵袭转移密切相关[17]。本研究结果显示与对照组相比,敲减GRP78表达N-cad蛋白表达降低而E-cad蛋白表达升高,这表明抑制GRP78的表达可以协同DDP逆转舌鳞癌细胞EMT的发生。而细胞的侵袭转移是一个复杂而严密的过程,除了EMT的发生,还包括细胞外基质的降解、黏着斑的形成、侵袭伪足形成等一系列复杂的过程。在肿瘤细胞中FAK是介导细胞黏着斑形成并调节细胞运动的关键因子,而β1-FAK-Rho GTPases通路在调节肌动蛋白细胞骨架运动方面发挥重要的作用[18]。在我们的研究中敲减GRP78的表达,FAK磷酸化水平显著降低,因此我们推测GRP78通过FAK激酶调控了舌鳞癌细胞对细胞外基质的黏附并促进细胞运动。为了进一步探讨GRP78对细胞侵袭伪足形成能力的影响,我们应用免疫荧光实验检测Cortactin的表达,结果显示与对照组比较,GRP78敲减组Cortactin的表达水平显著降低。
综上所述,GRP78通过ERK、AKT激酶上调细胞的增殖能力,导致舌鳞癌细胞对DDP的敏感性降低,同时GRP78介导了舌鳞癌细胞EMT的发生并通过活化FAK激酶促进细胞侵袭转移能力升高。因此在舌鳞癌DDP治疗过程中,可以将GRP78作为联合用药的新靶点。

