基于实际问题解决的认知模型建构与应用
刘绮思 李春红


摘要:分析了复分解反应教学中存在的问题:“首因效应”会导致复分解反应原理的认知困境;学生缺乏在真情境中策略性解决问题的思路。以NaCl为载体创设真实问题情境,完成“从粗盐中获得纯净NaCl”和“寻找生成NaCl的反应”两个学习任务。在解决认知冲突过程中建构并应用复分解反应除杂模型,理解复分解反应的微观实质;根据元素守恒思想,利用基本反应类型的特征找到生成NaCl的反应物;总结解决酸、碱、盐类问题的思路,提高在综合体系中问题解决的能力。
关键词:复分解反应;模型认知;问题解决
文章编号:1008-0546(2023)09-0008-06
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2023.09.002
一、教学主题内容及教学现状分析
节课之前学生已经学习了人教版化学九年级下册[1]第十单元“常见的酸和碱”“酸和碱的中和反应”、第十一单元“生活中常见的盐”。学生已经认识了常见的酸、碱、盐的组成、主要性质和用途,建构了复分解反应的认知模型,如图1所示,完善了对物质分类及化学基本反应类型的认识。本节课是完成上述教学之后开设的一节复习课,主要教学内容包括:(1)依据物质组成对物质进行分类,知道从物质组成角度认识物质的性质——酸、碱、盐之间可以发生复分解反应。(2)理解复分解反应的宏观特征和微观实质,宏观特征包括反应过程中化合价是否变化、元素重组的方式等;微观实质为溶液中自由移动的阴阳离子碰撞结合,使某些离子数目减少,反应发生。(3)从元素守恒角度认识化学反应,依据化学基本反应类型的特征,预测与分析物质转化的反应物。
通过访谈、调查问卷两种方式检测学生有关已学知识的掌握情况,有两点值得关注:(1)关于NaCl溶液、NaOH溶液、Na2CO3溶液都能导电的原因分析:认同溶液中有自由移动的带电粒子的同学有55.12%,但很少有同学能表达出来。(2)关于Fe+CuSO4=FeSO4+Cu反应的实质是“铁原子和溶液中铜离子发生反应”:认同或完全认同的同学有29.12%。
已有的教学设计中主要存在两种教学思路认识复分解反应:(1)强化宏观物质角度——学生通过实验探究判断反应是否发生,根據明显的实验现象分析归纳此类反应的特点,得到复分解反应的定义及发生条件。[2,3](2)强化微观离子角度——学生分析中和反应中微观离子的变化,通过实验获取宏观物质转化的事实,应用微粒观抽提出“特征离子对”,得到复分解反应的定义及微观实质。[4-6]此外,由于化学为中考选考科目,考试难度和前几年相比有所下降;学生重视程度不够,教师不易控制教学难易度,“难度增加型”和“要求不明型”都易导致学生学无章法,思绪混乱。[7]
基于上述分析,教学中存在的问题有:(1)学生对于酸、碱、盐在水溶液中的存在形式,微粒之间如何作用,如何发生化学反应存在认知障碍;(2)学生不了解复分解反应的微观实质,“首凶效应”[8]会导致复分解反应原理的认知困境,给高中的离子反应教学留下隐患;(3)学生即便可以从微观角度认识复分解反应,但各教学环节较为割裂,缺乏在真实情境中策略性解决问题思路,应用知识能力较弱。因此,为了解决以上问题,建议:(1)精心设计教学问题,引发学生认知冲突,在建构并应用认知模型的过程中加强从微粒角度理解复分解反应,帮助学生站在反应规律的高度再认识酸、碱、盐三类物质;(2)以学生熟悉的物质和生活经验为出发点,创设复分解反应的有效教学情境,提高学生应用知识解决问题的能力,帮助学生建立解决一类问题的思路。
二、教学思想与创新点
1.精心设计,引发认知冲突,建构认知模型
化学学科核心素养中,重视“模型认知”将有利于学生形成化学学科特有的学科观念和思想方法,针对初中学生的特点,教学中需特别关注理论联系实际,基于教学内容和学生既有认知,精心设计情境问题,让学生形成认知冲突。[9]本节课将学生的认知冲突有效融人建构及应用模型的过程中:(1)在选择除杂试剂时,学生习惯从宏观物质角度人手,找到NaOH、Ba(OH)2、BaC12等除杂试剂,学生认为NaOH只和MgC12发生反应,忽略了和MgSO4的反应。教师通过“烧杯画图法”引导学生从微观离子角度分析物质组成,将学生的思维难点外显,让学生发现NaOH除去的是溶液中所有的Mg2+,逐步建构出复分解反应的除杂模型,呈现出解决问题的思维路径,如图2所示。(2)在实验验证过程中,学生发现用Ba(OH)2溶液的确可以除去粗盐水中所有的Mg2+和SO2-,但此时是否得到纯净的NaCI?教师通过演示实验,向上层清液中滴加酚酞溶液后变红,让学生产生直接的认知冲突,引出除杂试剂过量问题。帮助学生意识到在实际生产中过量问题是普遍存在的,它的好处是可以保证杂质被完全去除,但是也会带来新的过量问题。学生应用已有认知模型(见图2)解决问题,巩固所学内容,在解决认知冲突的过程中理解复分解反应的微观实质。因此,将“认知冲突”和“模型认知”有效结合,可以凸显学生思维的进阶过程,提升学生运用知识解决问题的能力。
2.创设情境,解决真实问题,实现概念应用
以“物质组成结构决定性质”这一大概念为统领,物质的化学性质是通过化学反应来体现的,而物质的性质与反应是由其元素组成和内部结构所决定的,不从组成和结构角度认识物质性质与反应,就难以形成对物质性质与反应的深入理解。[10]酸、碱、盐类化合物在溶液中以自由移动的阴阳离子形式存在,这些自由移动的离子有哪些行为特征?通过解决“从粗盐中获得纯净NaCI”的问题,学生从复分解反应的角度认识到阴阳离子在水溶液中的行为是“双交换”且交换是有条件的:阴阳离子相互结合生成水、气体或者沉淀,使溶液中离子数目减少,反应发生。因此,利用复分解反应的微观实质可以帮助学生找到除杂试剂,去除粗盐中的可溶性杂质。
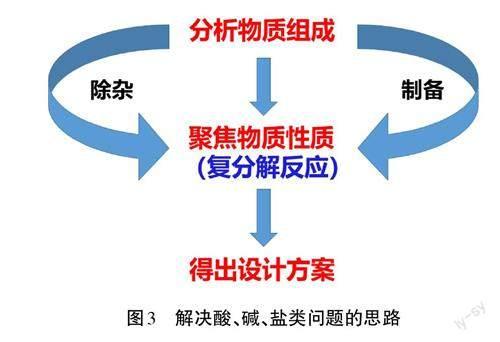
在“物质组成结构决定性质”这一大概念下,可以抽提出次级大概念:物质由元素组成,依据物质的元素组成可以将物质分类,同类物质具有相似的性质,在一定条件下含有同一元素的各类物质可以相互转化。[10]通过解决“寻找生成NaCI的反应”的问题,学生根据“化学反应前后元素种类不变”的思想,体会四种基本反应类型的特征。复分解反应的特征文中已陈述;化合反应的特征:从组成简单的物质转化成组成复杂的物质;分解反应的特征:从组成复杂的物质转化成组成简单的物质;置换反应的特征:有条件的“单交换”,活动性强的金属置换出活动性弱的金属。因此,利用基本反应类型的特征可以帮助学生更快地找到生成NaCI的反应物。总结解决酸、碱、盐类问题的思路,如图3所示。
三、教学设计
1.教学目标
(1)通过完成“从粗盐中获得纯净NaCl”的任务,建构并应用复分解反应除杂模型,深入理解复分解反应的宏观特征与微观实质。
(2)通过完成“寻找生成NaCl的反应”的任务,从元素守恒角度认识化学反应,进一步体会复分解反应及其他三种基本反应类型的特征。
(3)总结得出解决酸、碱、盐类问题的思路,在真情境、真问题中提升对综合体系中知识理解和问题解决的能力,为高中学习离子反应奠定基础。
2.教学流程
四、教学片段
1.從粗盐中获得纯净NaCI
【展示资料】NaCI的用途、来源(海水晒盐)及海水中盐类成分含量统计表,如表2所示,[11]部分酸、碱、盐的溶解性表,如表3所示。[1]
【学习任务】以粗盐中含量较多的NaCl、MgC12和MgSO4为例,如何从过滤后的粗盐水中获得纯净的NaCl?写出相关反应的化学方程式,画出流程图。
【学生方案1】大部分同学先加NaOH溶液再加Ba(OH)2溶液,如图4所示。
【学生方案 2】小部分同学先加 BaCl2溶液再加NaOH溶液,如图5所示。
【学生方案3】个别同学先加NaOH溶液再加BaCl2溶液。
MgCl2 + 2NaOH=Mg(OH)2↓+ 2NaCl;
MgSO4 + BaCl2=BaSO4↓+ MgCl2
【教师提问】以学生方案1为例:这两个反应属于哪种基本反应类型?反应是如何发生的?
【学生回答】复分解反应。这些物质在溶液中以离子形式存在,离子在溶液中进行“双交换”,生成沉淀和另外一种物质。
【教师追问】既然这些物质在溶液中以离子形式存在,装有粗盐水的烧杯里有什么离子?杂质离子是谁?
【学生回答】烧杯里有Na+、Cl-、Mg2+、SO24-,杂质离子是Mg2+和SO24-。
【教师质疑】查阅溶解性表发现(见表 3),OH-可以和Mg2+结合生成Mg(OH)2沉淀,但是,OH-除去的只是MgCl2中的Mg2+吗?
【学生回答】OH-除去的是溶液中所有的Mg2+,包括MgCl2的Mg2+和MgSO4的Mg2+。
【教师小结】虽然要除去的是MgCl2和MgSO4两种宏观物质,但从微观角度分析,实际上要除去的是Mg2+和SO2-4 两种杂质离子,根据复分解反应中离子的行为特征可以快速找到解决方案,例如:要除去Mg2+,与它相对应的离子是OH-;要除去SO2-4 ,与它相对应的离子是Ba2+。
【教师提问】找到OH-和Ba2+就可以了吗?能直接向溶液中加离子吗?
【学生回答】不能加离子,要加宏观的物质。
【教师追问】选择哪种含有OH-的物质?为什么?
【学生回答】NaOH。因为 OH-是一种阴离子,要想组成物质,需要找一种阳离子;这种阳离子最好不是杂质离子,所以选择 Na +,构成 NaOH 这种宏观物质。同理,含有Ba2+的物质就是BaCl2。
【学生补充】用Ba(OH)2可以同时除去Mg2+和SO2-4(见图2)。
【学生实验】实验目的:利用Ba(OH)2溶液除去混合液中的Mg2+和SO2-4 。
实验步骤:向装有 5 mL 10%的 NaCl、MgCl2、Mg?SO4混合溶液的西林瓶中加入一滴管Ba(OH)2饱和溶液,观察现象。
实验现象:产生白色沉淀。
【教师提问】如何验证Mg2+和SO2-4 已去除干净?
【学生回答】继续滴加Ba(OH)2溶液,观察是否有白色沉淀生成,如果没有,说明杂质离子已去除干净。
【演示实验】实验目的:证明Mg2+和SO2-一已去除干净。
【实验步骤】沉降后取上层清液,继续滴加Ba(OH)2饱和溶液,观察现象。
【实验现象】不产生白色沉淀。
【师生归纳】建构复分解反应的除杂模型(见图2):从微观角度分析物质组成,酸、碱、盐类化合物在溶液中以阴阳离子形式存在;聚焦物质的性质,根据复分解反应中离子的行为特征,找到能形成水或气体或沉淀的离子对进行杂质离子的去除;根据除杂试剂不引入新杂质的原则从微观离子转化成宏观物质,找到除杂试剂,也就是载体物质。
【演示实验】实验目的:引出Ba(OH)2过量问题
【实验步骤】沉降后取上层清液,滴加两滴酚酞溶液,观察现象。
【实验现象】溶液变红。
【教师提问】滴加酚酞溶液后,为什么会变红?
【学生回答】溶液变红说明溶液显碱性,Ba(OH)2过量了。
【学习任务】应用复分解反应除杂模型解决Ba(OH)2过量问题。
【小组讨论汇报】加H2CO3;加H2SO4;加MgSO4。凶为从微观角度分析,要除去的杂质离子是Ba2+和OH一,查阅溶解性表发现(见表3),与Ba2+相对应的离子是CO3一和SO4一,与OH一相对应的离子是H+和Mg2+;阴阳离子结合构成宏观物质。
【教师质疑】SO2一和Mg2+是之前要除去的杂质离子,不优先选择它们;H2CO3不稳定、易分解。怎么办?
【学生回答】可以选择两种除杂试剂:Na2CO3和HCl(见图6)。
【课后思考】(1)加入Na2CO3和HCI后发生哪些化学反应,写出化学反应方程式;(2)为了得到纯净的NaCI,还需要考虑哪些问题,解决方案是什么?
2.寻找生成NaCI的反应
【教师提问】利用复分解反应的特征寻找生成NaCI的化学反应。
【学生回答】如图7所示。
【师生归纳】复分解反应的特征——“双交换”:一部分交换用于形成NaCl,满足元素守恒;另一部分交换满足复分解反应发生的条件,生成水、气体或者沉淀。
【学习任务】根据所给物质:Na、C12、HCI、NaCIO3,利用其他三种基本反应类型的特征寻找生成NaCl的反应。
【小组讨论汇报】如图8所示。
【师生归纳】根据元素守恒思想,明确了反应物中要含有钠元素和氯元素。根据反应类型的特点,聚焦其他三種基本反应类型:冈为NaClO3中既含有钠元素也含有氯元素,它的组成和NaCl的组成相比更复杂,所以,从组成复杂的物质转化成组成简单的物质,可以考虑分解反应;Na、Cl2和NaCl相比,它们的组成更简单,因此,从组成简单的物质变成组成复杂的物质,可以考虑化合反应;置换反应的特点是“单交换”,这个交换也是有条件的,活动性强的金属置换出活动性弱的金属。最后寻找到合适的反应物来生成NaCl。
3.总结提升
【总结提升】总结解决酸、碱、盐类问题的思路(见图3),板书设计见图9。
五、教学反思
本节课所在的教学班级共36人,4人为一组,分成9组进行教学。本节课围绕NaCl这种物质,将物质组成与分类、元素守恒、复分解反应及其他三种基本反应类型等相关知识融合于真实情境问题的解决过程中。在“从粗盐中获得纯净NaCl"的教学环节中,2组学生能画出正确的除杂流程图(见图5),5组学生在用NaOH溶液除杂的过程中考虑不周全(见图4),不清楚NaOH和MgC12 、MgS04两种物质都会发生复分解反应,因此,在教师引导下,学生能从微观角度分析物质组成,理解复分解反应的微观实质,建构复分解反应除杂模型;在解决除杂试剂Ba(OH)2溶液过量的问题中,8组学生能利用已建构的除杂模型找到合理的除杂试剂(见图6),应用复分解反应相关知识解决问题的能力得以提升。在“寻找生成NaCI的反应”的教学环节中,绝大多数学生能应用元素守恒思想,知道反应物中一定含有Na元素和CI元素;6组学生能在白板上呈现出正确的化学方程式,但只有少部分学生能流利地表达出生成NaCI的化学反应的原因,大部分学生需要在教师引导下总结基本反应类型的特征,学生应用化学语言表达的能力有待提高。在今后的教学中,教师要做好示范作用,用标准的化学语言教学,强化学生的记忆与理解;教师要多给学生表达的机会,多给学生纠错的机会,以学生为主体的课堂才能更好地传授知识。
参考文献
[1] 人民教育出版社,课程教材研究所,化学课程教材研究开发中心,义务教育教科书:化学(九年级下册)[M].北京:人民教育出版社,2014:50-88.
[2] 颜士才.指向深度学习的初中化学“复分解反应”概念教学[J].化学教育(中英文),2021,42(15):7-10.
[3] 蔡武昌,苏艳玲.以学生为中心的初高中“复分解反应”衔接教学[J].中学化学教学参考,2020,(10):57-58.
[4] 张灵丽.基于学生主动建构的微粒观进阶研究[J].化学教学,2021,(10):42-47.
[5] 程绍山.运用微粒观开发复分解反应教学价值的实践与研究[J].化学教育(中英文),201 5,(15):29-33.
[6] 曹逸.“复分解反应”复习课教学设计[J].中学化学教学参考,2021,(7):85-86.
[7] 钱海如.“复分解反应”的核心问题分析与教学策略[J].化学教育(中英文),201 7,38(21):14-18.
[8] 张军,复分解反应原理认知困境的成因与对策探析[J].化学教育(中英文),20 1 7,38(7):35-39.
[9] 朱如琴.促进深度学习的专题复习教学[J].化学教育(中英文),202 1,42(5):26-33.
[10]何彩霞.化学学科核心素养导向的大概念单元教学探讨[J].化学教学,201 9,(11):44-48.
[11]百度百科.海水中的常量元素[DB/OL].https://baike.bai-du.com/item/海水中的常量元素/6026873?fr=aladdin.

