微杆菌XL1左聚糖酶的发酵条件优化及酶学性质研究
徐海洋 赵紫琰 陈倩倩 吴丹 张岩 霍东明 徐淋香

摘要:为提高微杆菌XL1左聚糖酶的产量,采用单因素试验和响应面试验对微杆菌XL1的产酶发酵条件进行优化,并对左聚糖酶的酶学性质和水解产物进行分析。优化结果表明,微杆菌XL1的最佳产酶条件为左聚糖3.4 g/L,酵母粉3.8 g/L,FeSO4·7H2O 0.01 g/L,CaCl2 0.1 g/L,KH2PO4 1 g/L,MgCl2 0.15 g/L,初始pH值6.0,接种量4%,25 ℃、180 r/min培养30 h。在此条件下,微杆菌XL1发酵液酶活力达到3.47 U/mL,相比优化前提高了298%。酶学性质分析表明,左聚糖酶的最适反应温度为55 ℃,最适反应pH为5.5;在40~50 ℃、pH 5.0~7.0时酶活力较稳定;Co2+ 、 Ca2+和Mn2+能显著提高酶活力;Cu2+ 、 Ni2+ 、 Zn2+和EDTA对酶有较强的抑制作用;β-巯基乙醇和表面活性剂(Triton X100、Tween 80、SDS)对酶活力的影响较小。该左聚糖酶对左聚糖、菊粉和蔗糖均有水解活性,左聚糖和菊粉的最终水解产物为果糖。该左聚糖酶在生产高果糖浆上具有良好的应用潜力。
关键词:微杆菌;左聚糖酶;发酵优化;响应面;酶学性质
中图分类号:TS201.25文献标志码:A 文章编号:1000-9973(2023)06-0007-08
Abstract: In order to improve the yield of Microbacterium sp. XL1 levanase, the fermentation conditions for enzyme production of Microbacterium sp. XL1 are optimized by single factor test and response surface test, and the enzymatic properties and hydrolysates of levanase are analyzed. The optimization results show that the optimal enzyme production conditions of Microbacterium sp. XL1 are levan 3.4 g/L, yeast powder 3.8 g/L, FeSO4·7H2O 0.01 g/L, CaCl2 0.1 g/L, KH2PO4 1 g/L, MgCl2 0.15 g/L, initial pH value 6.0, inoculation amount 4%, culturing at 25 ℃ and 180 r/min for 30 h. Under these conditions, the enzyme activity of Microbacterium sp. XL1 fermentation broth reaches 3.47 U/mL, which is 298% higher than that before optimization. Analysis of the enzymatic properties shows that the optimum reaction temperature of levanase is 55 ℃ and the optimum reaction pH is 5.5; enzyme activity is more stable at 40~50 ℃ and pH 5.0~7.0; Co2+, Ca2+ and Mn2+ can significantly increase the enzyme activity; Cu2+, Ni2+, Zn2+ and EDTA have strong inhibition effect on the enzyme; β-mercaptoethanol and surfactants (Triton X100, Tween 80 and SDS) have little effect on the enzyme activity.
果聚糖(fructan)是β-D-呋喃果糖的多聚體,是由非还原性末端的蔗糖与多个果糖残基组成的水溶性多糖,主要存在于某些被子植物(约15%)和细菌中[1]。根据糖苷键连接方式的不同,主要分为两种类型:左聚糖和菊粉。左聚糖(levan)主链以β-2,6-糖苷键连接,主要来源于细菌和单子叶植物[2];菊粉(inulin)主链以β-2,1-糖苷键连接,在菊芋的块茎中含量丰富[3]。左聚糖和菊粉为可再生非粮生物质资源,在生产高果糖浆、低聚果糖等食品领域具有广阔的市场[4]。
左聚糖酶(levanase,EC 3.2.1.65),学名β-2,6-D-果聚糖酶,属于糖苷水解酶32家族(glycosyl hydrolases family 32)。目前已从多种微生物中分离出左聚糖酶,如链霉菌(Streptomyces sp.)[5]、假单胞菌(Pseudomonas)[6]、葡萄糖醋杆菌(Gluconacetobacter)[7]、芽孢杆菌(Bacillus sp.)[8]、红酵母菌(Rhodotorula sp.)[9]、唾液链球菌(S. salivarius)[10]等。研究表明,大多数左聚糖酶的最适温度范围在40~50 ℃,最适pH范围在5.5~6.5[11]。根据左聚糖酶作用底物方式的不同,可分为外切型左聚糖酶和内切型左聚糖酶两大类。外切型左聚糖酶大多能同时降解β-2,6-糖苷键连接的左聚糖和菊粉的β-2,1-糖苷键,从两种底物中释放游离果糖,在左聚糖和菊粉商业化生产超高果糖浆上具有很大潜力[12]。高果糖浆是一种功能性糖类水溶液,具有甜味纯正、渗透压高、增强风味、吸湿保湿性好等优点,在酸奶、碳酸饮料、烘焙食品、冰淇淋和乳制品中被广泛用作一种重要的甜味剂,同时在制药企业也用于制作注射液和胶囊配方等[13-14]。内切左聚糖酶特异性地将左聚糖水解为一系列聚合度在2~10的低聚果糖,低聚果糖是一种功能性多糖,具有众多益生作用,如改善脂质代谢,促进矿物质的吸收,降低血脂和抗肿瘤等[15]。
本研究利用单因素法和响应面法对微杆菌XL1产左聚糖酶的发酵条件进行优化,并对其酶学性质和水解产物进行了分析,旨在为应用于高果糖浆制备所需要的酶来源提供新途径,为该左聚糖酶的工业化应用提供理论依据。
1 材料与方法
1.1 主要材料与试剂
1.1.1 菌种
微杆菌XL1:本实验室保藏。
1.1.2 试剂
左聚糖:本实验室分离的微杆菌利用蔗糖合成;菊粉(纯度≥98%):上海源叶生物科技有限公司;SDS(分析纯):上海阿拉丁生化科技股份有限公司;酵母粉和胰蛋白胨(分析纯):英国Oxoid公司;其他试剂:上海国药集团化学试剂有限公司。
1.1.3 培养基
固体培养基:酵母粉5 g/L,胰蛋白胨10 g/L,氯化钠10 g/L,琼脂15 g/L,自然pH。
种子培养基:FeSO4·7H2O 0.01 g/L,CaCl2 0.1 g/L,NaNO3 3 g/L,KH2PO4 1 g/L,MgCl2 0.15 g/L,酵母粉 3 g/L,pH 7.0。
发酵培养基:FeSO4·7H2O 0.01 g/L,CaCl2 0.1 g/L,KH2PO4 1 g/L,MgCl2 0.15 g/L,左聚糖 1 g/L,酵母粉 3 g/L,pH 7.0。
1.2 主要仪器与设备
DHG-9240A电热鼓风干燥箱、LPR-150生化培养箱 上海博珍仪器设备制造厂;1379生物安全柜 赛默飞世尔(苏州)仪器有限公司;THZ-C台式恒温振荡器 太仓市华美生化仪器厂;DK-8D恒温水浴锅 常州诺基仪器有限公司;Micro 17R台式离心机、1510全波长酶标仪 美国Thermo Fisher Scientific公司。
1.3 方法
1.3.1 粗酶液的制备
将微杆菌XL1接种到固体培养基中,于30 ℃培养箱中培养36~48 h,活化菌株。再从固体培养基中挑取单菌落接种于种子培养基中,30 ℃、180 r/min摇床培养16 h。将种子液以4%的接种量接种于发酵培养基中,30 ℃、180 r/min摇床培养30 h。发酵液于4 ℃,8 000 r/min离心10 min,收集上清液即为粗酶液。
1.3.2 酶活力测定
采用3,5-二硝基水杨酸(DNS)法测定粗酶液的酶活[16]。取150 μL 20 g/L左聚糖溶液(50 mmol/L、pH 5.5的乙酸钠缓冲液配制),加入50 μL酶液混匀,55 ℃水浴10 min后迅速加入200 μL DNS终止反应,沸水浴5 min显色,冷却后吸取200 μL加入酶标板中(在相同的条件下,以灭活的粗酶液作为空白对照)。测定540 nm处的吸光值,对照果糖标准曲线计算还原糖的含量。
酶活力单位定义:在55 ℃、pH 5.5的条件下,每分钟水解底物生成1 μmol还原糖所需要的酶量,即为1个酶活力单位(U)。
1.3.3 单因素试验
分别改变碳源种类(左聚糖、菊粉、麦芽糖、葡萄糖、果糖、可溶性淀粉)、碳源添加量(1,3,5,7,9 g/L)、氮源种类(氯化铵、硝酸钠、尿素、酵母粉、胰蛋白胨、大豆蛋白胨)、氮源添加量(1,2,3,4,5 g/L)、温度(22,25,28,30,35 ℃)、初始pH值(4.0,5.0,5.5,6.0,7.0,8.0)、接种量(2%、4%、6%、8%、10%)、培养时间(12,18,24,30,36,42 h),考察这些因素对菌株产酶的影响。以碳源种类为第一因素试验时,将发酵培养基中的左聚糖改为1 g/L其他碳源,按照1.3.1中方法制备粗酶液,并按照1.3.2中方法测定酶活力,以所测酶活力的最大值为100%计算相对酶活力。后续因素的试验均在前一因素试验的较优结果上进行。
1.3.4 响应面优化试验
基于单因素试验结果,选出对左聚糖酶产量影响较大的3个因素,采用三因素三水平的Box-Behnken响应面试验设计法,以初始pH值(A)、左聚糖添加量(B)、酵母粉添加量(C)为自变量,以左聚糖酶活力(Y)为响应值,采用Design-Expert 12软件对试验数据进行分析。响应面试验因素与水平见表1。
1.3.5 左聚糖酶的酶学性质
酶的最适反应温度:将酶液与底物混匀,分别在20~70 ℃的水浴条件下反应10 min后,测定酶活力,以所测酶活的最大值为100%,计算相对酶活力。酶的热稳定性:将酶液在40,50,60 ℃水浴锅中孵育不同时间(最长为3 h),每隔30 min取样测酶活,以未加热孵育处理酶的酶活力为100%,计算相对酶活力。
酶的最适反应pH:将酶液和底物分别与不同pH值的缓冲液混匀,测定酶活力,根据相对酶活力的大小确定最适反应pH。酶的pH稳定性:将酶液与不同pH范围内的缓冲液混匀,于30 ℃下放置2 h后,测定残余酶活力。不同pH的缓冲液分别为50 mmol/L乙酸钠缓冲液(pH 4.0~5.5),50 mmol/L磷酸盐缓冲液(pH 5.5~7.5),50 mmol/L Tris-HCl缓冲液(pH 7.5~9.0)。
金属离子及其他化学试剂对酶活力的影响:在55 ℃、pH 5.5条件下,向酶反应体系中加入不同金属离子及其他化学试剂后,测定酶活力。金属离子和EDTA的终浓度为5 mmol/L,PMSF的终浓度为1 mmol/L,β-巯基乙醇的终浓度为10 mmol/L,表面活性剂Triton X100、Tween 80和SDS的終浓度为0.1%。以添加同等体积的灭菌去离子水测定的左聚糖酶活为对照,计算相对酶活力。
酶反应底物专一性测定:分别以浓度为2%的左聚糖、菊粉、蔗糖、木聚糖、普鲁兰、右旋糖酐为酶反应底物,在55 ℃、pH 5.5条件下测定酶活力。
1.3.6 水解产物薄层层析(TLC)
分别以浓度为0.5%的左聚糖和菊粉为酶反应底物,底物与酶的比例为1∶1,在55 ℃、pH 5.5条件下水解12 h,水解产物点样至硅胶板,层析杠中展开后吹干,喷显色剂。吹干后将硅胶板置于80 ℃烘箱中加热10 min显色。所用展开剂正丁醇、乙酸、水按照体积比5∶4∶1混合,显色剂为二苯胺2 g、苯胺2 mL、85%磷酸10 mL、丙酮100 mL混合。
1.4 数据分析
每组试验均平行测定3次,采用Origin 2018软件进行数据处理和作图,根据3组平行样的平均方差来绘制误差线。
2 结果与分析
2.1 單因素试验结果
2.1.1 碳源、氮源及其浓度对菌株产酶的影响
本试验研究了6种不同碳源对微杆菌XL1发酵产酶的影响,见图1中A。以左聚糖为碳源时,其酶活力远高于其他碳源,说明微杆菌XL1通过底物诱导分泌左聚糖酶,左聚糖酶是一种底物诱导酶。因此,选择左聚糖作为微杆菌XL1产左聚糖酶的最佳碳源。研究显示,许多多糖水解酶属于底物诱导酶,目标多糖水解酶发酵的最佳碳源为该酶的底物[17]。由图1中B可知,左聚糖浓度对酶产量的影响较显著,随着左聚糖浓度的增加,微杆菌XL1产左聚糖酶活力呈先上升后下降的趋势,在左聚糖浓度为3 g/L时达到最大值。当左聚糖浓度高于3 g/L时,酶的产量开始下降,高于5 g/L时,下降迅速。这种抑制可归因于黏度增加,导致细菌生长所需的氧气难以转移。这与Dahech等[18]用5 g/L以上左聚糖发酵培养时左聚糖酶活性下降迅速的结果相似。
氮源在微生物核酸和蛋白质构成中起到重要作用,微生物可利用的氮源可分为有机氮和无机氮。由图1中C可知,以酵母粉为氮源时,酶活力提升最显著,其次是胰蛋白胨和大豆蛋白胨,而以无机氮源氯化铵、硝酸钠、尿素发酵时,酶活均极低,说明微杆菌XL1更倾向于利用有机氮源。以酵母粉为氮源,考察其浓度对微杆菌XL1产左聚糖酶的影响。由图1中D可知,当酵母粉浓度为3 g/L时,菌株发酵液中左聚糖酶活力最高,继续增加酵母粉浓度,酶活力呈下降趋势,故酵母粉浓度以3 g/L为最佳。
2.1.2 发酵温度、培养基初始pH、接种量及培养时间对菌株产酶的影响
由图2中A可知,微杆菌XL1产左聚糖酶活性随温度的升高呈现先上升后下降的趋势,在25 ℃时酶活力最高,比Dahech等[18]报道的左聚糖酶最适发酵温度低15 ℃。由图2中B可知,培养基初始pH对左聚糖酶活力有较大影响,初始pH在4.0~5.5范围内时,微杆菌XL1产左聚糖酶活力呈上升趋势;当初始pH为5.5时,左聚糖酶活力最高;当初始pH为5.5以上时,左聚糖酶活力呈下降趋势,说明略酸性的环境利于微杆菌XL1产左聚糖酶。由图2中C可知,接种量对微杆菌XL1产酶的影响较小,在2%~4%的接种量范围内,增加接种量可以提高左聚糖酶活力,当接种量大于4%时酶活力开始下降,可能是初期加入的菌体过多,造成培养基营养物质大量消耗,使其生长受限,不利于产酶。因此,微杆菌XL1产左聚糖酶的最适接种量为4%。由图2中D可知,微杆菌XL1从发酵12 h开始产酶,随着发酵时间的进一步增加,酶活力不断上升,于30 h达到峰值,产酶量最高,继续延长培养时间,酶活力下降。
2.2 响应面试验结果
根据单因素试验中对微杆菌XL1产左聚糖酶影响相对较大的3个因素:初始pH值、左聚糖添加量、酵母粉添加量对产酶培养条件进行优化。以初始pH值(A)、左聚糖添加量(B)、酵母粉添加量(C)3个因素为自变量,以左聚糖酶活力(Y)为响应值设计响应面分析,试验设计与结果见表2,构建的响应面回归模型:Y=3.26+0.607 5A+0.252 5B+0.400 1C+0.237 5AB+0.227 5AC+0.122 5BC-1.14A2-0.939 2B2-0.624 3C2。
由表3可知,模型的P<0.000 1,表明所建立的模型极显著(P<0.01),失拟项的P值为0.276 5,判定为不显著(P>0.05),证明模型建立成功。该模型的判定系数R2 =0.979 7,修正判定系数RAdj2=0.953 7,表明该模型的拟合程度良好。由P值可知,自变量B对Y的影响显著(P<0.05),自变量A、C、A2、B2、C2对Y的影响极显著(P<0.01),其余均不显著(P>0.05);由F值可知,各因素对微杆菌XL1产左聚糖酶活力的影响次序为A(初始pH值)>C(酵母粉添加量)>B(左聚糖添加量)。
各因素间交互作用的三维响应面图见图3。
通过Design-Expert 12对模型优化求解,预测微杆菌XL1的最佳产酶条件为初始pH值5.99、左聚糖添加量3.40 g/L、酵母粉添加量3.79 g/L,此条件下左聚糖酶活力理论值为3.46 U/mL。考虑到实际的操作情况,选取初始pH值6.0、左聚糖添加量3.4 g/L、酵母粉添加量3.8 g/L进行验证试验,3次平行试验所得左聚糖酶的平均酶活为(3.47±0.02) U/mL,与预测值较接近,说明该模型能较好地预测实际发酵情况。
2.3 酶学性质
2.3.1 酶的最适反应温度及温度稳定性
Fig.4 Optimal reaction temperature (A) and temperature stability (B) of levanase
左聚糖酶的最适反应温度为55 ℃,比Jensen等[19]报道的B.subtilis所产左聚糖酶的最适温度高15 ℃。在40~60 ℃范围内,可保持60%以上的相对酶活力,当温度在60 ℃以上时,酶活力迅速下降。热稳定性结果显示,在40 ℃下温浴2 h可以保持90%以上活性,60 ℃下温浴酶活力迅速下降。研究表明,大多数左聚糖酶在30~50 ℃之间热稳定性较好,高于55 ℃时热稳定性较差[11]。
2.3.2 酶的最适反应pH及pH稳定性
左聚糖酶的最适反应pH为5.5,在pH 4.5~6.5之间可以保持60%以上的酶活力,与Murakami等[8]报道的Bacillus sp.所产左聚糖酶的最适pH相似。pH稳定性结果表明,左聚糖酶在pH 5.0~7.0的弱酸条件下高度稳定,孵育2 h后残余酶活力保持在80%以上,其中在50 mmol/L乙酸钠缓冲液(pH 5.5)中能保持90%以上的活性。
2.3.3 金属离子及其他化学试剂对酶活力的影响
金属离子终浓度为5 mmol/L时对左聚糖酶活力的影响见表4。
Mn2+、Co2+、Ca2+对左聚糖酶活力有明显的激活作用,其中Mn2+对酶活力的提升效果最显著,其相对酶活力高达160.4%,其次是Ca2+和Co2+,而Cu2+、Ni2+、Zn2+對左聚糖酶活力有较强的抑制作用,Zn2+的抑制效果最明显。EDTA对左聚糖酶活力有较强的抑制作用,5 mmol/L浓度下,测定酶活力为51.2%;蛋白酶抑制剂PMSF对左聚糖酶活性有部分抑制作用;还原剂β-巯基乙醇对酶活力的影响较小;表面活性剂Triton X100、Tween 80和SDS对酶活力基本没有影响。
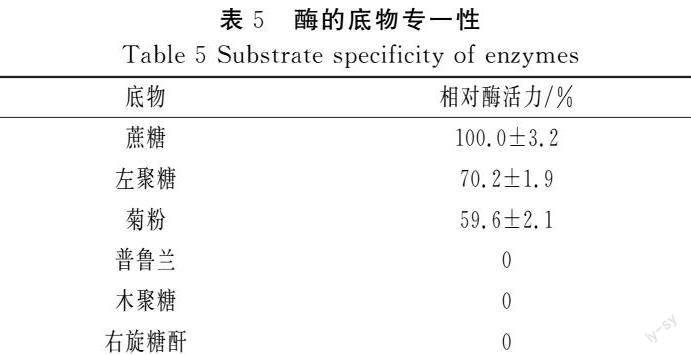
2.3.4 酶的底物专一性
由表5可知,微杆菌XL1产的左聚糖酶可以水解多种含β-呋喃果糖苷键的糖,如左聚糖、菊粉和蔗糖,而对普鲁兰、木聚糖、右旋糖酐均无酶活。
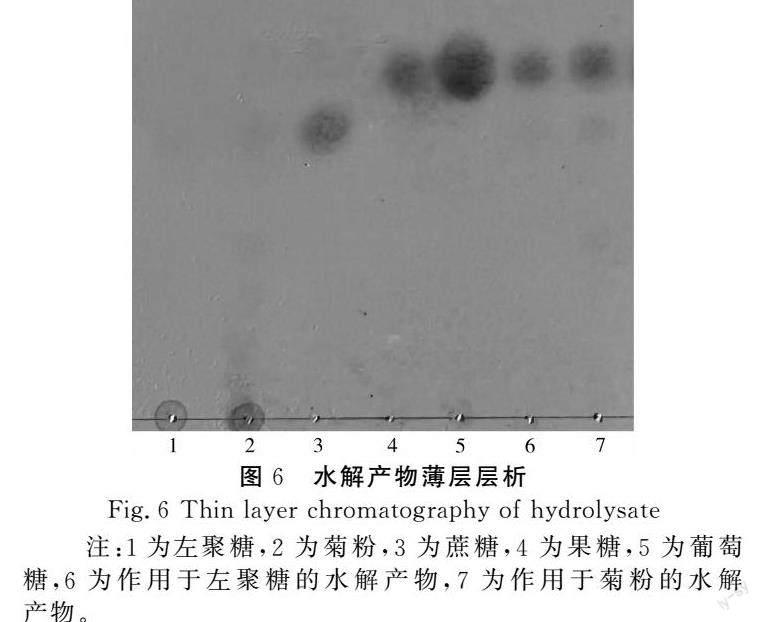
2.4 水解产物薄层层析
采用薄层层析法分析左聚糖酶水解左聚糖和菊粉的产物,见图6。左聚糖和菊粉经过与左聚糖酶反应12 h,几乎全部被水解,水解产物中几乎全部为果糖,表明微杆菌XL1发酵得到的左聚糖酶能够从非还原性末端水解左聚糖和菊粉,释放出果糖。因此,微杆菌XL1左聚糖酶具有应用于高果糖浆及结晶果糖生产的潜力。
图6 水解产物薄层层析
Fig.6 Thin layer chromatography of hydrolysate
注:1为左聚糖,2为菊粉,3为蔗糖,4为果糖,5为葡萄糖,6为作用于左聚糖的水解产物,7为作用于菊粉的水解产物。
3 结果与讨论
响应面分析法(RSM)是一种优化生物过程的统计学试验设计,已被用于多种微生物糖苷水解酶发酵产酶培养基的优化中,并取得了显著效果,包括壳聚糖酶[20]、β-葡聚糖酶、纤维素酶[21]和β-半乳糖苷酶[22]等。本研究在单因素试验的基础上,采用响应面法对微杆菌XL1产酶条件进行了优化,得到的最佳发酵条件为左聚糖3.4 g/L,酵母粉3.8 g/L,FeSO4·7H2O 0.01 g/L,CaCl2 0.1 g/L,KH2PO4 1 g/L,MgCl2 0.15 g/L,初始pH值 6.0,接种量4%,25 ℃、180 r/min条件下振荡培养30 h,发酵液中左聚糖酶活力达到3.47 U/mL,与初始酶活(0.87 U/mL)相比提高了298%。
通过对酶学性质进行分析,得到左聚糖酶的最适反应温度为55 ℃,在50 ℃及以下有较好的热稳定性;最适反应pH为5.5,在pH 5.0~7.0范围内孵育2 h,残余酶活力保持在80%以上。Co2+、Ca2+、Mn2+对酶活力有较强激活作用,Cu2+、Ni2+、Zn2+对酶活力有强烈抑制作用。金属离子对不同来源的左聚糖酶活力的影响各有不同,如Mn2+和Mg2+对Streptomyces sp. 7-3来源的左聚糖酶活力有一定促进作用[5],而对Pseudomonas sp. 43来源的左聚糖酶活力有强烈抑制作用[23]。EDTA对酶有较强的抑制作用,说明该左聚糖酶的活性中心需要金属离子的螯合,这与Chaudhary等[9]的研究结果相似。表面活性剂对酶活力几乎无影响,因此可在洗涤剂中添加该酶,增强洗涤效果。
高果糖浆(high fructose syrup)是一种可替代蔗糖的甜味剂,广泛应用于食品及饮料行业,具有广阔的市场需求。目前国内外工业化生产高果糖浆主要是以淀粉为原料,需用α-淀粉酶、糖化酶、葡萄糖异构酶催化多步反应生成,但该方法成本高、制备繁琐、得率低[24]。微杆菌XL1左聚糖酶水解左聚糖和菊粉的最终产物几乎全部为果糖,因此利用左聚糖酶一步反应即可生产高纯度的果糖,具有很高的商业价值。今后的研究将致力于粗酶的分离纯化,以及挖掘产酶基因并通过基因工程技术实现左聚糖酶的高效表达,为左聚糖酶制剂的工业发酵生产以及高果糖浆的开发利用打下基础。
参考文献:
[1]陆璐,陶雅军,罗学娅,等.糖苷水解酶32家族结构与功能的研究进展[J].中国酿造,2019,38(8):14-19.
[2]吴昕雨,严琳,伍红.谷氨酸棒状杆菌全细胞催化合成Levan果聚糖条件优化分析[J].中国畜牧兽医,2020,47(11):3474-3483.
[3]周东,隋丹,于涛,等.盐碱土壤对菊芋菊糖含量的影响[J].中国调味品,2014,39(3):5-9.
[4]WANG X, YU S, ZHANG T, et al. From fructans to difructose dianhydrides[J].Applied Microbiology and Biotechnology,2015,99:175-188.
[5]MURAKAMI H, MUROI H, KURAMOTO T, et al. Purification and some properties of a levanase from Streptomyces sp. No.7-3[J].Agricultural and Biological Chemistry,1990,54(9):2247-2255.
[6]KANG S K, LEE S O, LIM Y S, et al. Purification and characterization of a novel levanoctaose-producing levanase from Pseudomonas strain K-52[J].Biotechnology and Applied Biochemistry,1998,27(2):159-166.
[7]MENNDEZ C, HERNNDEZ L, SELMAN G, et al. Molecular cloning and expression in Escherichia coli of an exo-levanase gene from the endophytic bacterium Gluconacetobacter diazotrophicus SRT4[J].Current Microbiology,2002,45(1):5-12.
[8]MURAKAMI H, KURAMOTO T, MIZUTANI K, et al. Purification and some properties of a new levanase from Bacillus sp. No.71[J].Bioscience, Biotechnology, and Biochemistry,1992,56(4):608-613.
[9]CHAUDHARY A, GUPTA L K, GUPTA J K, et al. Purification and properties of levanase from Rhodotorula sp.[J].Journal of Biotechnology,1996,46(1):55-61.
[10]TAKAHASHI N, MIZUNO F, TAKAMORI K. Isolation and properties of levanase from Streptococcus salivarius KTA-19[J].Infection and Immunity,1983,42(1):231-236.
[11]ZHANG W, XU W, NI D, et al. An overview of levan-degrading enzyme from microbes[J].Applied Microbiology and Biotechnology,2019,103(19):7891-7902.
[12]MENNDEZ C, HERNNDEZ L, BANGUELA A, et al.Functional production and secretion of the Gluconacetobacter diazotrophicus fructose-releasing exo-levanase (LsdB) in Pichia pastoris[J].Enzyme and Microbial Technology,2004,34(5):446-452.
[13]马俊,安启坤,唐文竹.菊粉外切酶的异源表达、纯化及酶学性质[J].食品与发酵工业,2019,45(4):25-30.
[14]李凯,朱中燕,潘莉莉,等.原糖水解生产果葡糖浆的工艺优化[J].中国调味品,2019,44(5):149-153.
[15]MAGRI A, OLIVEIRA M R, BALDO C, et al. Production of fructooligosaccharides by Bacillus subtilis natto CCT7712 and their antiproliferative potential[J].Journal of Applied Microbiology,2020,128(5):1414-1426.
[16]PORRAS-DOMNGUEZ J R, VILA-FERNNDEZ , RODRGUEZ-ALEGRA M E, et al. Levan-type FOS production using a Bacillus licheniformis endolevanase[J].Process Biochemistry,2014,49(5):783-790.
[17]程瑞.索拉胶降解菌产葡聚糖酶的研究[D].南京:南京理工大学,2014.
[18]DAHECH I, AYED H B, BELGHITH K S, et al. Microbial production of levanase for specific hydrolysis of levan[J].International Journal of Biological Macromolecules,2013,60:128-133.
[19]JENSEN S L, DIEMER M B, LUNDMARK M, et al .Levanase from Bacillus subtilis hydrolyses β-2,6 fructosyl bonds in bacterial levans and in grass fructans[J].International Journal of Biological Macromolecules,2016,85:514-521.
[20]盧波斯,崔丹丹,李志明,等.高效产壳聚糖酶海洋菌株Mitsuaria sp. SH-50的筛选、鉴定及产酶条件优化[J].中国调味品,2022,47(7):1-9.
[21]文晓霞,李豪,魏溱,等.Cladosporium sp. AY-42固态发酵产纤维素酶条件优化[J].中国调味品,2020,45(11):23-28,33.
[22]黄倩,李洁,郑晓春,等.奶酪中高产β-半乳糖苷酶菌株的筛选及发酵条件的优化[J].中国调味品,2021,46(2):23-30.
[23]JUNG K, LEE S, LEE J, et al. Purification and characterization of a levanbiose-producing levanase from Pseudomonas sp. No. 43[J].Biotechnology and Applied Biochemistry,1999,29(3):263-268.
[24]戴晨霞,曹慧方,罗会颖,等.来源于Alicyclobacillus sp. A4葡萄糖异构酶的克隆表达及转化应用研究[J].生物技术通报,2018,34(11):144-151.

