弹性蛋白肽的制备工艺优化及其理化性质分析
李清岚 刘颖 崔春


摘要:采用牛动脉弹性蛋白为原料,以弹性蛋白酶抑制活性和蛋白回收率为评价指标,研究弹性蛋白肽制备工艺和理化性质。结果表明,胰酶在酶添加量1.0%、pH 11、温度45 ℃和时间15 h的条件下酶解弹性蛋白,弹性蛋白酶抑制活性(蛋白浓度为10 mg/mL)为35.63%,蛋白回收率可达80.08%;弹性蛋白酶解过程中,部分β-折叠和α-螺旋转化为β-转角,酶解产物小于1 000 Da的肽段占45.50%,富含疏水性氨基酸和芳香族氨基酸,具有较强还原力,清除DPPH和ABTS自由基的IC50值分别为6.90,3.41 mg/mL,且在温度<85 ℃、pH为中性和碱性的条件下具有良好的稳定性。
关键词:弹性蛋白;胰酶;MMP-12抑制活性;蛋白回收率;理化性质
中图分类号:TS201.2文献标志码:A 文章编号:1000-9973(2023)06-0189-06
Abstract: With bovine arterial elastin as the raw material, elastase inhibitory activity and protein recovery rate as the evaluation indexes, the preparation process and physicochemical properties of elastin peptides are studied. The results show that when elastin is hydrolyzed by pancreatin under the conditions of enzyme addition amount of 1.0%, pH of 11, temperature of 45 ℃ and time of 15 h, the elastase inhibitory activity (protein concentration of 10 mg/mL) is 35.63% and the protein recovery rate is 80.08%. During the enzymolysis of elastin, some β-folding and α-helix are converted into β-turn. In the enzymatic hydrolysate, the peptides less than 1 000 Da account for 45.50%, which are rich in hydrophobic amino acids and aromatic amino acids, have strong reducing capacity, and the IC50 of scavenging DPPH and ABTS radicals is 6.90, 3.41 mg/mL respectively, and they have good stability at temperature < 85 ℃, pH neutral and alkaline conditions.
Key words: elastin; pancreatin; MMP-12 inhibitory activity; protein recovery rate; physicochemical properties
收稿日期:2022-12-05
基金项目:国家自然科学基金项目(31201416);国家重点研发计划项目(2016YFD0400803)
作者簡介:李清岚(1997—),女,硕士,研究方向:食品生物技术。
*通信作者:崔春(1978—),男,教授,博士,研究方向:食品生物技术。
基质金属蛋白酶(matrix metalloproteinase,MMPs)过度表达时会加速降解弹性蛋白、胶原蛋白等细胞外基质成分,表现为皮肤松弛、失去弹性、皱纹加深[1-3]。弹性蛋白酶(MMP-12)是降解弹性蛋白的关键酶[4],且能激活其他MMPs活性[5],与皮肤衰老密切相关,因此MMP-12抑制活性被认为是延缓皮肤衰老的潜在解决方案。弹性蛋白肽(elastin peptide,EP)是弹性蛋白原的降解产物,与MMP-12有良好的亲和力[6],调控弹性蛋白和胶原蛋白的mRNA表达[7-8],增殖成纤维细胞并促进细胞外基质成分的合成[9-10],因此通过生物酶解技术制备EP具有良好的开发价值。
弹性蛋白是一种硬蛋白,主要存在于牛、猪等哺乳动物的韧带(约80%)、主动脉(30%~50%)、肺(10%~25%)、皮肤(2%~3%)或鱼类的动脉球。丁刘刚等[11]以牛颈韧带为原料,利用多种酶的协同作用在pH 7、50~60 ℃酶解10~20 h,制备具有美容作用的EP。蔡亚君等[12]采用木瓜蛋白酶在pH 6~8、30~60 ℃下酶解猪蹄粉10~20 h,制备可改善睡眠的EP。刘洋[13]、Nakaba等[14]分别以牛动脉、鱼动脉球制备具有抗皮肤衰老活性的EP。目前国内外对EP的研究多集中在活性评价,鲜有提及EP回收率,相关制备工艺的基础性研究也较少。然而,在实际生产中酶解效率对于原料利用和经济效益具有重要意义。随着市场对弹性蛋白肽需求的与日俱增,寻求效率高、成本低、效果显著的制备工艺亟待解决。本研究通过酶筛选和工艺优化提高弹性蛋白的酶解效率,探讨弹性蛋白肽的理化性质,以期为制定科学的生产工艺提供数据支撑。
1 材料与方法
1.1 材料与试剂
新鲜牛动脉:购于当地市场;弹性蛋白酶、N-succinyl-Ala-Ala-Ala-pNA:Sigma公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS):上海麦克林生化科技有限公司;其他无机试剂均为分析纯。
1.2 主要仪器与设备
L-8800氨基酸分析仪 安捷伦科技有限公司;U-3000液相色谱仪、Multiskan Sky多功能酶标仪 赛默飞世尔科技有限公司;真空冷冻干燥机 宁波新芝生物科技股份有限公司。
1.3 试验方法
1.3.1 弹性蛋白的提取
新鲜牛动脉清洗后去除表面脂肪,绞碎。采用热碱法[15]提取,去除表面油脂和可溶性杂蛋白。将牛动脉与0.1 mol/L NaOH按1∶10(质量和体积比)混匀,95 ℃水浴振荡1 h,水洗至中性,离心取沉淀冻干,储存使用。
1.3.2 酶种类筛选
按照表1的水解条件,称取2 g弹性蛋白粉,加20 g水复溶,调节pH,酶底比(E/S)为1.0%,在一定温度下酶解15 h后沸水浴灭酶10 min,10 000 r/min离心10 min,取上清液,测定MMP-12抑制活性、蛋白回收率和水解度。
1.3.3 弹性蛋白酶解工艺优化
1.3.3.1 单因素试验
选用胰酶对弹性蛋白酶解,通过对酶添加量(0.5%、1.0%、1.5%、2.0%、2.5%)、酶解温度(40,45,50,55,60,65 ℃)、酶解时间(9,12,15,18,21,24 h)、酶解pH(6,7,8,9,10,11)进行研究,优化MMP-12抑制肽制备工艺。
1.3.3.2 正交试验
采用L9(33)正交表(见表2),选取酶解温度、酶解时间和酶解pH 3个考察因素,以MMP-12抑制活性和蛋白回收率为评价指标,确定最优酶解工艺条件。
1.3.4 蛋白回收率和水解度的测定
采用GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法测定总氮,水解度采用甲醛滴定法测定。
水解度(%)=上清液氨基酸态氮含量原料总氮含量×100。
蛋白回收率(%)=上清液总氮质量原料总氮质量×100。
1.3.5 MMP-12抑制活性的测定
根据刘洋[13]的方法并稍作修改,96孔板依次加入200 μL样品和50 μL 弹性蛋白酶(60 mU/mL),充分混匀,于25 ℃放置3 min,随后加入50 μL N-succinyl-Ala-Ala-Ala-pNA(1 mmol/L),在410 nm处测定吸光度,记为Ac0、As0,将板放在全波长扫描仪上于25 ℃温育10 min,随后立即在410 nm处测定反应后的吸光度,记为Ac、As。以Tris-HCl 缓冲液作为对照。MMP-12抑制活性计算公式如下:
MMP-12抑制活性(%)=1-As-As0Ac-Ac0×100。
式中:As0为反应前样品组的吸光度,As为反应后样品组的吸光度;Ac0为反应前对照组的吸光度,Ac为反应后对照组的吸光度。
1.3.6 弹性蛋白和EP的理化性质测定
1.3.6.1 红外光谱分析
采用红外光谱(FT-IR)法测定蛋白结构,称取20 mg样品,溴化钾混合压片,波长扫描范围设置为400~4 000 cm-1,FT-IR光谱和二级结构采用Ominic和PeakFit软件进行分析。
1.3.6.2 氨基酸组成的测定
参考GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》测定氨基酸组成。
1.3.6.3 肽分子量的测定
采用HPLC法测定分子量分布,色谱柱:TSKgel G2000SWXL(7.8 mm×300 mm,250 mm),檢测波长220 nm,柱温30 ℃。流动相为水∶乙腈为80∶20(体积比),加入浓度为0.1%的TFA,以0.5 mL/min等度洗脱。以标准品分子量对数与保留时间作图得标准曲线,计算分子量分布。
1.3.6.4 抗氧化活性的测定
根据叶昱辉[16]的方法测定还原力。
根据GB/T 39100—2020《多肽抗氧化性测定 DPPH和ABTS法》测定。
1.3.6.5 温度和pH对EP活性保留率的测定
配制质量浓度为10 mg/mL的样品溶液,分为温度组(25,45,65,85,100,121 ℃保温2 h)和pH组(2.0,4.0,6.0,8.0,10.0,12.0放置2 h后将pH调至8.0),分别将25 ℃和pH 8.0设为对照组(100%),计算MMP-12抑制活性保留率。
1.4 数据处理
试验数据使用Excel和SPSS 23.0软件统计分析,结果记为“平均值±标准偏差”,采用Tukey检验进行显著性分析,P<0.05视为具有显著性差异,使用Origin 2018软件作图。
2 结果与分析
2.1 酶种类筛选
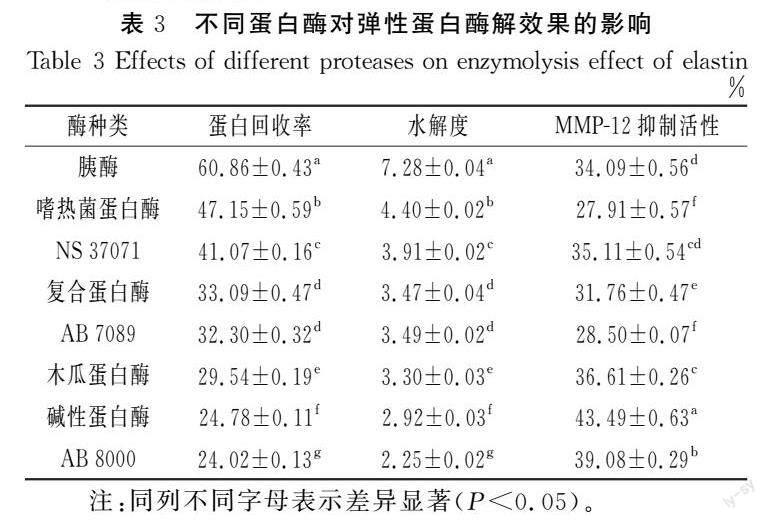
不同蛋白酶的酶切位点不同,催化同一底物产生的肽链长度和氨基酸序列不同导致活性有差异。由表3可知,采用碱性蛋白酶、AB 8000、木瓜蛋白酶酶解的EP的MMP-12抑制活性显著高于其他蛋白酶,NS 37071、胰酶酶解的EP次之,但碱性蛋白酶、AB 8000、木瓜蛋白酶酶解的蛋白回收率和水解度很低,表明弹性蛋白未充分水解,造成总体活性贡献率低和原料的浪费。NS 37071与胰酶酶解的EP的MMP-12抑制活性无显著性差异,但胰酶酶解的EP蛋白回收率是NS 37071的1.48倍,显著高于NS 37071。胰酶中蛋白酶主要由胰蛋白酶、胰糜蛋白酶、弹性蛋白酶、羧肽酶等组成,姜佳等[17]利用胰蛋白酶和胰糜蛋白酶协同酶解猪肺可获得高锁链素含量的弹性蛋白肽,说明胰蛋白酶和胰糜蛋白酶能提高弹性蛋白肽的释放量,此外,弹性蛋白酶对弹性蛋白具有特异吸附性,对弹性蛋白优先水解且有很强的水解作用[18],这可能是胰酶能深度水解结构稳定的弹性蛋白的原因。综合考虑活性和得率,选择胰酶进一步试验。
由图1可知,当蛋白浓度小于50 mg/mL时,随着EP浓度的增大,MMP-12抑制活性随之提高,表明EP的MMP-12抑制活性与蛋白浓度存在良好的剂量关系,因此EP的蛋白回收率越大,对产品整体的贡献率越大。
2.2 单因素试验结果
由图2可知,随着酶解温度的升高,MMP-12抑制活性呈现倒“V”趋势,在45 ℃时MMP-12抑制活性、蛋白回收率达到最大值,因此45 ℃为最佳酶解温度。随着酶添加量的增加,MMP-12抑制活性无显著性差异,说明在不同酶添加量下可能得到相似组成的EP。当酶添加量在0.5%~1.0%时,蛋白回收率增加幅度较大,当酶添加量>1.0%时,蛋白回收率增加缓慢。综合考虑生产成本,确定酶添加量为1.0%。随着酶解时间的延长,蛋白回收率随之增大,在15 h后增加幅度变缓,MMP-12抑制活性在12 h后无显著性差异,这与刘洋[13]的研究结果相似,因此选择9~15 h进一步优化。pH在8~11范围内MMP-12抑制活性无显著性差异,且在pH 10时达到最高蛋白回收率,过高的pH(>12)会导致胰酶失活,因此选择pH 9~11进一步优化。
2.3 正交试验结果
由表4中极差分析可知,影响蛋白回收率和MMP-12抑制活性的主次顺序均为时间>pH>温度。对于因素A和因素C,蛋白回收率和MMP-12抑制活性的最优水平分别为A2和C3。对于因素B,优化水平可选B2或B3。取B2时,MMP-12抑制活性比取B3时提高10.3%,蛋白回收率減少6.4%,故因素B取B2。因此,本试验的优化组合为A2B2C3,即酶解温度为45 ℃,酶解时间为15 h,酶解pH为11。在该条件下酶解,蛋白回收率为80.08%,水解度为12.98%,蛋白浓度为10 mg/mL时MMP-12抑制活性为35.63%。
2.4 弹性蛋白和EP的红外光谱分析
酶解前后弹性蛋白在4 000~500 cm-1范围内的FT-IR光谱见图3。
3 500~3 100 cm-1区域强而宽的特征峰是由O-H和N-H伸缩振动引起的,吸收峰红移,说明形成氢键,可能是由于N-H伸缩振动与氢键互相结合[19]。1 700~1 600 cm-1为酰胺I带,此波段的吸收峰表示蛋白分子间以及分子内部形成的二级结构。一般而言,酰胺I带吸收的波数越低,蛋白质中的氢键作用越高,酶解后的酰胺I带(CO伸缩振动峰)发生了蓝移(约8 cm-1),可能是酶解处理破坏了弹性蛋白结构中CO参与的氢键作用,从而引起蛋白螺旋结构的部分解体[20],表明其二级结构发生变化。
由表5可知,在酶解过程弹性蛋白的二级结构之间出现了相互转化。β-折叠从49.45%降低到32.12%,α-螺旋从15.27%降低到9.65%,无规则卷曲无显著性变化,β-转角从13.36%增加到32.09%,β-反平行从1.40%增加至5.04%。β-折叠结构变化较复杂,包括分子内、分子间平行和反向平行等多种形式,其中平行β-折叠较β-反平行折叠更规则。弹性蛋白的重复序列具有较高的形成分子内和分子间氢键的能力,这与β-折叠形成有关,由表5可知,弹性蛋白的β-折叠含量高达49.45%,这可能与弹性蛋白特殊的氨基酸组成有关,且β-折叠相较于α-螺旋、β-转角更稳定[21],α-螺旋、β-折叠的减少和β-转角的增加可能使蛋白质展开,二级结构由有序转为无序,利于酶解的进行,使得更多的疏水性氨基酸暴露。
2.5 弹性蛋白和EP的氨基酸组成
弹性蛋白和EP具有相似的氨基酸组成和含量,弹性蛋白(肽)的标志性氨基酸(Des和Ide)含量约为0.18%,非极性氨基酸占比超过90%,Gly含量高达24%,Ala含量约占19%;亲水性氨基酸含量较低,其中Met含量极少(未检出),与报道的(牛来源)弹性蛋白氨基酸组成相符[22]。EP高水平的Gly、Ala、Val、Pro、Leu、Phe被报道与弹性蛋白酶具有良好的亲和力[23],这可能是其具有较高MMP-12抑制活性的原因。弹性蛋白酶解后,碱性氨基酸Lys、Arg、His和酸性氨基酸Asp含量增加,芳香族氨基酸Phe和Tyr含量占比约为10%,高含量的疏水性氨基酸和芳香族氨基酸可能对EP的抗氧化活性起着关键作用。
2.6 EP的肽分子量分布
由表7可知,EP的分子量小于3 000 Da的多肽组分占弹性蛋白肽的60.49%,其中小于1 000 Da的多肽占45.50%,据报道,小肽更容易被吸收利用且在体内发挥生物活性作用[24—25]。同时,蛋白过度酶解可能会因含有大量游离氨基酸而导致活性降低,Alemán等[26]研究发现酶解物中的游离氨基酸会降低其抗氧化活性,本研究中EP分子量小于180 Da的多肽占比仅为0.44%,含量极低,说明在该酶解条件下,弹性蛋白并未过度水解。
2.7 EP的抗氧化活性
弹性蛋白肽的抗氧化活性对延缓皮肤衰老有潜在贡献作用[27—29]。
由图4可知,随着质量浓度的增加,EP的还原力、DPPH自由基和ABTS自由基的清除能力都逐渐增强。当质量浓度为8.0 mg/mL时,EP在700 nm处的吸光值为0.352,与0.1 mg/mL谷胱甘肽的还原力相当,具有较强的还原力。唐敏等[30]制备的牛颈韧带EP在质量浓度30 mg/mL时,在700 nm处的吸光值不及0.3。经计算,EP的DPPH和ABTS自由基清除能力的IC50值分别为6.90,3.41 mg/mL。当EP的质量浓度分别约为GSH的25倍和38倍时,EP清除DPPH自由基和ABTS自由基的能力与GSH相当。
2.8 温度和pH对EP活性保留率的影响
热处理和pH处理是食品加工中的常用方法,由图5可知,升高温度(<65 ℃)对MMP-12抑制活性无显著影响,当温度升至85 ℃以上,MMP-12抑制活性低于85%。EP在不同pH条件下MMP-12抑制活性保留率呈现中间高两端低的特点,在中性和偏碱性条件下MMP-12抑制活性保留率保持在85%以上。
3 结论
以牛动脉弹性蛋白为原料,通过酶筛选和工艺优化制备具有高蛋白回收率的MMP-12抑制肽,分析其二级结构、氨基酸组成、肽分子量分布、抗氧化能力和加工稳定性,对它们的理化性质进行基础性研究,为EP的实际应用提供借鉴。
参考文献:
[1]KIM H, JANG J, SONG M J, et al. Inhibition of matrix metalloproteinase expression by selective clearing of senescent dermal fibroblasts attenuates ultraviolet-induced photoaging[J].Biomedicine & Pharmacotherapy,2022,150:113034.
[2]DUAN Y, CHEN Y, LI Y R, et al. The effects of reactive oxygen species in the process of skin photoaging[J].Life Research,2022,5(2):10.
[3]PILLAI S, ORESAJO C, HAYWARD J. Ultraviolet radiation and skin aging: roles of reactive oxygen species, inflammation and protease activation, and strategies for prevention of inflammation-induced matrix degradation-a review[J].International Journal of Cosmetic Science,2005,27(1):17-34.
[4]VAN DOREN S R. Matrix metalloproteinase interactions with collagen and elastin[J].Matrix Biology,2015,44-46:224-231.
[5]LIU M, SUN H J, WANG X F, et al. Association of increased expression of macrophage elastase (matrix metalloproteinase 12) with rheumatoid arthritis[J].Arthritis & Rheumatism,2004,50(10):3112-3117.
[6]VERMA R P, HANSCH C. Matrix metalloproteinases (MMPs): chemical-biological functions and (Q)SARs[J].Bioorganic & Medicinal Chemistry,2007,15(6):2223-2268.
[7]LIU Y, SU G W, WANG S G, et al. A highly absorbable peptide GLPY derived from elastin protect fibroblasts against UV damage via suppressing Ca2+ influx and ameliorating the loss of collagen and elastin[J].Journal of Functional Foods,2019,61:103487.
[8]LIU Y, SU G W, ZHOU F B, et al. Protective effect of bovine elastin peptides against photoaging in mice and identification of novel antiphotoaging peptides[J].Journal of Agricultural and Food Chemistry,2018,66(41):10760-10768.
[9]SHIRATSUCHI E, NAKABA M, YAMADA M. Elastin hydrolysate derived from fish enhances proliferation of human skin fibroblasts and elastin synthesis in human skin fibroblasts and improves the skin conditions[J].Journal of the Science of Food and Agriculture,2016,96(5):1672-1677.
[10]SHIRATSUCHI E, NAKABA M, SHIGEMURA Y, et al. Fish-elastin Hydrolysate: Development and Impact on the Skin and Blood Vessels[M]//Marine Proteins and Peptides: Biological Activities and Applications, Hoboken: Wiley-Blackwell,2013:467-486.
[11]丁劉刚,梁明,郭晓蕾,等.一种弹性蛋白肽及其制备方法、应用:中国,106381323A[P].2017-02-08.
[12]蔡亚君,彭其安,王布匀,等.改善睡眠的弹性蛋白活性肽及其制备工艺:中国,112521490A[P].2021-03-19.
[13]刘洋.弹性蛋白肽的抗皮肤光老化功效及其作用机制研究[D].广州:华南理工大学,2019.
[14]NAKABA M, OGAWA K, SEIKI M, et al. Properties of soluble elastin peptide from bulbus arteriosus in fish species[J].Fisheries Science,2006,72(6):1322-1324.
[15]MECHAM R P. Methods in elastic tissue biology: elastin isolation and purification[J].Methods,2008,45(1):32-41.
[16]叶昱辉.近江牡蛎多肽的分离纯化及其抗氧化、抗光老化活性研究[D].广州:华南理工大学,2018.
[17]姜佳,刘红彦,刘汉民,等.一种弹性蛋白肽的制备方法:中国,111955592A[P].2020-11-20.
[18]詹莉.枯草芽孢杆菌弹性蛋白酶的纯化及酶学性质的研究[D].雅安:四川农业大学,2008.
[19]刘丽莉,李丹,杨陈柳,等.牛骨胶原蛋白酶解工艺优化及结构特性分析[J].食品与机械,2017,33(7):40-46.
[20]梁健华.超声波辅助提取罗非鱼皮胶原蛋白及其功能结构性质的研究[D].广州:华南理工大学,2016.
[21]YONG Y H, YAMAGUCHI S, MATSUMURA Y. Effects of enzymatic deamidation by protein-glutaminase on structure and functional properties of wheat gluten[J].Journal of Agricultural and Food Chemistry,2006,54(16):6034-6040.
[22]SHIRATSUCHI E, URA M, NAKABA M, et al. Elastin peptides prepared from piscine and mammalian elastic tissues inhibit collagen-induced platelet aggregation and stimulate migration and proliferation of human skin fibroblasts[J].Journal of Peptide Science,2010,16(11):652-658.
[23]QIAN B, ZHAO X, YANG Y, et al. Antioxidant and anti-inflammatory peptide fraction from oyster soft tissue by enzymatic hydrolysis[J].Food Science & Nutrition,2020,8(7):3947-3956.
[24]XU Q B, HONG H, WU J P, et al. Bioavailability of bioactive peptides derived from food proteins across the intestinal epithelial membrane: a review[J].Trends in Food Science & Technology,2019,86:399-411.
[25]AHMED T, SUN X H, UDENIGWE C C. Role of structural properties of bioactive peptides in their stability during simulated gastrointestinal digestion: a systematic review[J]. Trends in Food Science & Technology,2022,120:265-273.
[26]ALEMN A, GIMNEZ B, PREZ-SANTIN E, et al. Contribution of Leu and Hyp residues to antioxidant and ACE-inhibitory activities of peptide sequences isolated from squid gelatin hydrolysate[J].Food Chemistry,2011,125(2):334-341.
[27]AMAKYE W K, YANG L, YAO M, et al. Skipjack (Katsuwonus pelamis) elastin hydrolysate-derived peptides attenuate UVA irradiation-induced cell damage in human HaCaT keratinocytes[J].Food Frontiers,2021,2(2):184-194.
[28]謝丽平.具有抗氧化、抗衰老活性的多肽筛选、分离纯化及结构鉴定[D].广州:华南理工大学,2019.
[29]马梦娇.中华鳖肉抗氧化肽的制备及其抗衰老功能研究[D].无锡:江南大学,2020.
[30]唐敏,许文涛,罗云波,等.弹性蛋白特性及其多肽抗氧化活性研究[J].中国食品学报,2014,14(2):55-59.

