可溶性大豆多糖的提取及在食品中的应用研究进展
刘赵 沈海军 周凌晨 曹仲文

摘要:可溶性大豆多糖是一种从豆制品加工副产物豆渣中提取的酸性多糖,具有良好的抗淀粉老化、抗淀粉黏结、乳化和乳化稳定性、蛋白质稳定性、成膜性等优异的食品加工特性,同时还具有降血糖、降血脂、抗氧化和预防癌症等生理功能,在食品、医药、保健等行业都有广泛的应用前景。文章不仅综述了可溶性大豆多糖传统的提取、分离纯化方法及其原理,而且介绍了两种新型大豆多糖提取工艺:电解水提取法和高压脉冲电场辅助提取法。最后对可溶性大豆多糖在食品中的应用及相应作用机制做了简述,以期为豆渣的高值利用、可溶性大豆多糖的提取及实际应用提供参考。
关键词:可溶性大豆多糖;多糖提取;电解水提取法;高压脉冲电场辅助提取;分离纯化
中图分类号:TS241文献标志码:A 文章编号:1000-9973(2023)06-0199-010
Abstract: Soluble soybean polysaccharide is an acidic polysaccharide extracted from soybean residue, a kind of by-product of soybean product processing. It has excellent food processing characteristics such as good resistance to starch aging and starch adhesion,emulsification and emulsification stability, protein stability, film-forming properties, and also has physiological functions such as reducing blood sugar and blood lipid, antioxidation and cancer prevention.It has broad application prospect in food, medicine, health care and other industries.In this paper, not only the traditional extraction, separation and purification methods and principles of soluble soybean polysaccharides are reviewed, but also two new soybean polysaccharide extraction processes including electrolyzed water extraction method and high voltage pulsed electric field assisted extraction method are introduced. Finally, the application and the corresponding action mechanism of soluble soybean polysaccharides in food are briefly described, aiming to provide references for the high value utilization of soybean residue, the extraction and practical application of soluble soybean polysaccharides.
Key words: soluble soybean polysaccharides; polysaccharide extraction; electrolyzed water extraction method; high voltage pulsed electric field assisted extraction; separation and purification
收稿日期:2022-12-07
基金項目:中餐非遗技艺传承文化和旅游部重点实验室开放课题(WLB2202)
作者简介:刘赵(1996—),男,硕士,研究方向:食品加工技术。
*通信作者:曹仲文(1973—),男,副教授,博士,研究方向:轻工技术与工程及传统烹饪产业化。
可溶性大豆多糖(soluble soybean polysaccharides,SSPS)多为白色或淡黄色粉末状,是一类低黏度的酸性多糖,在水中有较高的溶解性[1]。其结构与果胶类似,由长链的鼠李糖半乳糖醛酸和短链的高聚半乳糖醛酸构成主链,半乳糖和阿拉伯糖组成中性的侧链,还含有鼠李糖、阿拉伯糖、葡萄糖、岩藻糖和木糖等多种单糖组分[2-3]。不同提取工艺使大豆多糖的分子质量有较大差异,一般分布在5~1 000 kDa之间[4]。大豆多糖与其他生物多糖相比黏性更低,并且具有良好的抗黏结性[5]、抗氧化性[6-7]、蛋白质稳定性[8]、乳化性、絮凝性[9]、成膜性[10]及抗淀粉老化[11]等优良性;同时大豆多糖还具有降血脂、降血糖、抑菌、抗肿瘤、抗氧化等功效[12]。因此,可广泛应用于食品、医药、美容、保健等行业,具有良好的发展前景。
大豆又称黄豆,为蝶形花科一年生草本植物,是我国重要的食物原料之一。《2019 大豆食品重点加工企业调研报告》[13]显示2018年我国食品工业大豆用量约为1 260万吨,按每加工1吨大豆产生2吨湿豆渣计[14],我国的湿豆渣年产量至少为2 500万吨。由于其含水量高、不易保存、豆腥味重、口感粗糙等问题,目前豆渣主要用作饲料或者肥料,有的甚至直接丢弃,导致资源严重浪费。
豆渣干基中含有30%左右的可溶性大豆多糖,将豆渣经过脱脂、提取、纯化、灭菌和干燥等工序即可获得均一的大豆多糖。本文对大豆多糖的提取、分离纯化及其在食品中的应用进行简要综述,以期为豆渣的高值化利用和大豆多糖的推广提供有益参考。
1 可溶性大豆多糖的提取
可溶性大豆多糖主要是指存在于豆皮细胞壁内的可溶性多糖。为了提高大豆多糖的提取率,一般需要采用物理或化学手段对细胞壁的结构和组成进行破坏以利于多糖成分的溶出。当前主要的提取方式有热水浸提法、酸浸提法、碱浸提法、酶法提取法、超声波辅助提取法、微波辅助提取法、超临界流体萃取法、亚临界萃取法及新型提取方法。
1.1 热水浸提法
单一的热水提取法在早期多糖提取中较常用。水是强极性溶剂,与极性的多糖分子有很好的相溶性,持续的高温可以使部分植物细胞壁发生破裂,内部的水溶性多糖成分溶出,从而提高多糖的提取率。此方法具有操作简单、成本低廉、无毒、无污染等优点,但热水对细胞壁的溶解力有限,所以需要多次浸提,消耗时间长,提取效率低。
施翠娥等[15]以市售大豆粉为原料,探讨了提取温度、提取时间、料液比3个因素在热水浸提大豆多糖时对提取率的影响,结果表明提取温度>提取时间>料液比,并得到最优提取条件:温度90 ℃、时间2 h、料液比1∶80(g/mL),反复浸提2次,得率为19.33%。桂雨豪等[16]在热水浸提的基础上采用PCF高压反应釜提高浸提时的温度和压力,弥补传统热水提取法的不足。研究以豆渣纤维为提取基材,溶液pH值、固液比、提取温度3个因素对粗多糖提取率、还原糖含量、透明度、多糖纯度的综合影响。实验结果表明,浸提温度对SSPS影响最大,pH值和提取时间次之,料液比的影响最小。最佳提取条件:温度110 ℃、时间3 h、pH 4.5、料液比1∶20(g/mL),此时大豆多糖提取率为52.4%,大大提高了多糖提取率。因此,将物理改性豆渣与热水提取法或其他方法相结合提高多糖产量是一个值得探索的方向,如朱丹等[17]利用超高压处理沙果渣膳食纤维,Fayaz等[18]探究了高压均质对豆渣膳食纤维的影响,Chen等[19]使用行星式球磨(planetary ball milling)技术对豆渣进行微粉化,以上文献的结果都表明高温、高压和快速剪切等物理处理手段不仅可以促使细胞内可溶性多糖的释放,而且能使部分不溶性多糖转化为可溶性多糖。
1.2 酸浸提法
酸浸提法是指利用合适浓度的乙酸、盐酸、六偏磷酸钠等弱酸性溶液进行多糖的提取。此方法提取的大豆多糖较纯净[20],可避免蛋白质的污染。然而该方法对操作要求高,如酸度偏高或提取时间过长会引起多糖糖苷键断裂,造成多糖发生降解和空间结构改变,影响多糖的产量和活性[21]。
Yamaguchi等[22]系统研究了六偏磷酸钠的浓度、提取温度、提取时间对大豆多糖萃取的影响。结果表明,在100 ℃下,用50倍于其体积的2%六偏磷酸溶液提取2 h,几乎可将豆渣内的可溶性多糖萃取完全,并且避免了蛋白质污染。将多糖的黏度、分子量和组分构成与市售样品进行比较,在分子量与中性糖组分构成方面没有观察到任何差异。熊杰等[23]以豆渣为提取原料,分别探索了以柠檬酸和酒石酸作为提取介质获取大豆多糖的工艺特点及影响提取率的因素。其研究数据表明柠檬酸在pH 3.7、酒石酸在pH 3.8时提取效果最佳,蛋白质溶出率低,此时酒石酸提取率为14.67%,较柠檬酸提取率(9.88%)高,所以酒石酸更适合作为大豆多糖的提取媒介。在此基础上通过单因素实验获得了酒石酸溶液提取大豆多糖的最宜条件:提取时间1.5 h、提取温度110 ℃、pH 3.8,此时大豆多糖得率为27.65%,蛋白质溶出率为2.18%。
1.3 碱提取法
碱提取法一般是指采用NaOH或KOH等弱碱性溶剂提取多糖的方法。碱性溶液可加速纤维之间酯键的断裂,促进细胞壁的溶解,有利于胞内多糖的释放,提高多糖的提取率。该方法适合于含有糖醛酸的多糖[24]及细胞坚硬、水溶性差的植物[25],具有提取效率高、耗时短等优点。但是堿提取法处理脂肪和蛋白质含量高的样品时易产生大量泡沫,需及时除沫和更换碱液[26]。
孟岳成等[27]研究了在碱性溶液中提取豆渣中SSPS的工艺,正交实验结果表明提取温度对多糖得率的影响最大。在最佳工艺温度110 ℃、pH 11、时间2 h、料液比1∶20(g/mL)条件下,大豆多糖提取率为16.24%。碱提法在植物多糖提取研究中应用广泛,如刺五加多糖[28]、杏鲍菇多糖[29]、花生多糖[30]、甘蔗皮多糖[31]等的提取中皆有应用。
1.4 酶法提取法
酶提法是指利用各种酶对细胞壁进行水解从而促进胞内多糖的溶出,依据处理对象的不同使用的酶有所差异,一般常用的有纤维素酶、果胶酶、淀粉酶、蛋白酶等。酶提法具有催化性高、提取条件温和、针对性强的特点,能以较少的溶剂获得较高的提取率,但是该方法对反应温度要求苛刻且成本昂贵。
宋慧等较全面地研究了酸性蛋白酶、胰蛋白酶、木瓜蛋白酶、风味蛋白酶、植物水解蛋白酶、果胶酶和纤维素酶于料液比1∶20(g/mL)、提取温度50 ℃、提取时间4 h及各酶最适宜pH值的条件下提取豆渣中的可溶性多糖,结果表明酸性蛋白酶、胰蛋白酶和风味蛋白酶酶解后大豆多糖的提取率较高。其进一步研究发现10%的酸性蛋白酶配合8%的风味蛋白酶在水解时间6 h、pH 6、料液比1∶20(g/mL)的条件下,可溶性大豆蛋白的提取率最高,为9.28%。范文奇等[32]利用纤维素酶提取豆粕中的多糖,经过多次实验得到最佳实验组合:酶解90 min、温度60 ℃、pH 5、纤维素酶添加量1%、料液比1∶20 (g/mL),此时大豆多糖提取率达到14.92%。Cheng等[33]使用淀粉酶和诺维信复合植物水解酶提取豌豆膳食纤维中的可溶性多糖。
1.5 超声波辅助提取法
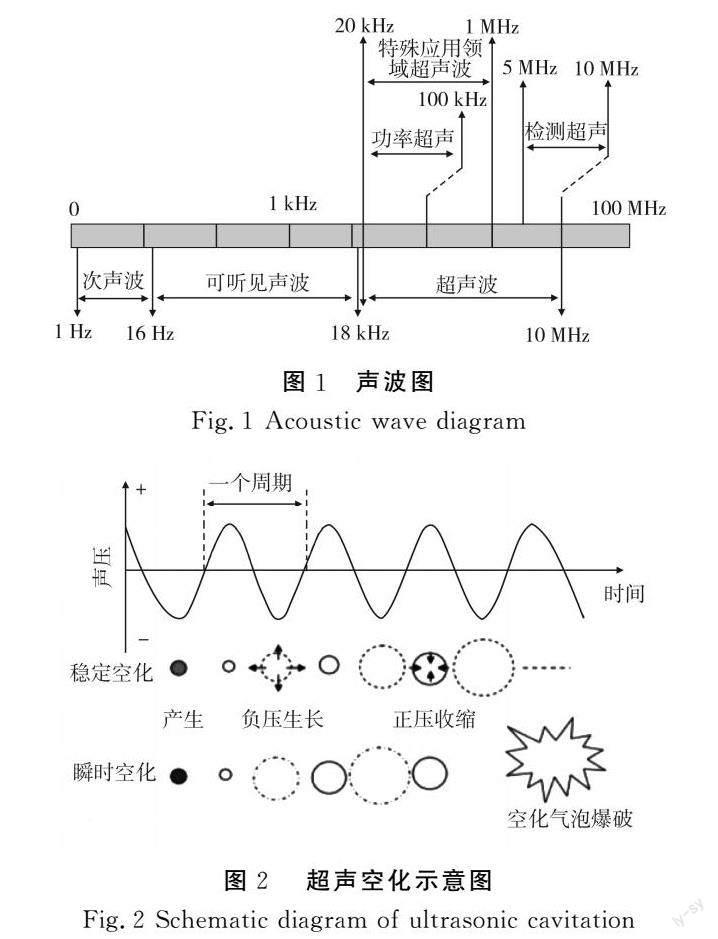
超声波是一类频率超过人类听觉阈值(频率>16 kHz)的声波[34-35]。根据频率的不同,超声波可以分为两类:功率超声和检测超声,见图1。在萃取时使用的是功率超声,其频率在20~100 kHz之间,具有低频、高能的特点。提取中常以液体作为传播介质,在超声波的作用下液体介质不断受到压缩和拉伸, 当超声强度足够大时,液体内部受到足够大的负压,液体介质分子间的平均距离达到极限,其本身会被撕裂形成暂时的近似真空的空洞, 即空化核。空化核会进一步长大形成气泡并不断地聚集及生长。持续进行超声,分布在液体中的空化气泡会被压缩崩溃,出现局部高温以及放电现象, 称为空化现象[36-38]。根据空化气泡破裂的情况可以分为稳态空化和瞬时空化两种类型[39],见图2。当超声强度超过空化气泡的空化阈值时,空化气泡在经过几次压缩和膨胀后可以从稳态空化转化成瞬态空化[40]。空化泡瞬间长大破裂,吸收的能量在极短的时间和极小的空间内释放出来,形成高温高压的环境[41],同时伴随一定强度的冲击波和微射流,从而破坏细胞壁结构,使其在瞬间破裂,释放细胞内的有效成分,大大提高了提取率[42]。另外,超声过程中可产生自由基(H2O→H++·OH)。
郝继伟[43]简单探讨了超声功率、提取时间、提取温度和料液比对提取可溶性大豆多糖的影响,结果表明超声功率对提取率的影响较大。田海娟等[44]以生产豆腐过程中产生的废渣为原料,通过响应面实验法研究了超声波辅助提取大豆多糖的工艺,确定的最佳提取条件为:超声功率200 W、超声温度90 ℃、超声时间20 min、料液比1∶25,此时提取率为1.869%。田瑞红等[45]将超声波法与酶法相结合,进行豆渣中可溶性大豆多糖的提取研究。实验结果表明在最佳提取工艺条件下,超声波协同酶法的提取率(25.92%)比单纯的超声波提取率(11.51%)提高了14.41%。
1.6 微波辅助提取法
微波是指波长为1~1 000 mm、频率为300 MHz~300 GHz的电磁波。微波可使被加热物体内的极性分子,尤其是水分子进行高频反复运动,分子间相互摩擦产生内摩擦热,进而提高被加热物体的温度。在运用微波进行多糖提取时,持续的微波使细胞内的温度迅速上升,液体水汽化并产生蒸汽压,当细胞内的压力超过细胞壁的承受极限时,细胞会被冲破,形成微小的孔洞,有利于细胞内容物的释放和溶剂的渗入。该方法具有省时快速、穿透力强、提取效率高、绿色无污染等优点。
任花[46]利用微波辅助法提取豆渣可溶性多糖,考察了微波功率、提取温度、提取时间及料液比对多糖得率的影响,正交实验结果表明在微波功率700 W、提取时间4 min、液料比40∶1、浸提2次的条件下大豆多糖得率最高,为6.64%。王胜男等[47]通过对比发现,使用微波辅助草酸铵法提取的大豆多糖,其乳化能力更强,常温贮藏30 d未出现明显的乳析现象。范宏亮等[48]进一步探讨了微波功率、处理时间、料液比对可溶性大豆多糖乳化性能的影响,结果显示480 W、35 min、1∶20(g/mL)條件下得到的大豆多糖乳化性能最好。
1.7 超临界流体萃取法
超临界态是指物质处于一种特殊流体状态。当温度和压力达到某一值时,气相与液相之间的界面消失,成为一个均匀体系,此值即临界点。当流体的温度和压力高于临界温度和临界压力时,该流体处于超临界状态,此时的流体称为超临界流体。超临界流体不仅具有气体和液体的双重特性,而且具有溶解性强、扩散性好、易于控制的优点。该法能很好地保留提取物质的活性且不会造成溶剂污染,常用的超临界流体物质有二氧化碳、氮气、一氧化二氮等。
超临界CO2萃取法是指使用二氧化碳作为流体的一种超临界萃取方法。谭兰芳等[49]采用超临界CO2萃取法提取白花蛇舌草粗多糖,得到萃取压力25 MPa、萃取温度40 ℃、携带剂浓度40%、料液比1∶8(g/mL)时多糖得率为0.364%。杨孝辉等[50]通过响应面分析法考察了萃取温度、萃取压力、萃取时间、携带剂浓度4个因素对超临界CO2流体萃取淮山多糖工艺的影响。结果表明萃取压力>萃取温度>携带剂浓度>萃取时间,最佳提取条件下多糖提取率为0.280 7%。
1.8 亚临界水萃取法
亚临界水萃取法又称高压热水或热液态水,是指在一定压力下(1~22.1 MPa),将水加热到100~374 ℃时,水仍然保持液体状态[51]。该技术具有操作简单、提取效率高、活性保存率高、安全性高的优点。
娄冠群等[52]探讨了亚临界水萃取法提取豆渣中可溶性大豆多糖的最优工艺条件,结果表明在亚临界水温度150 ℃、液料比35∶1、提取时间11 min的条件下,大豆多糖提取率最高(22.8%),比传统热水提取法(提取温度100 ℃、液料比25∶1(mL/g)、提取时间180 min,多糖得率12.3%)更加节能省时且提取率更高。赵彬等[53]考察了亚临界水萃取小麦胚芽多糖的工艺流程及条件,利用单因素实验和响应面实验得到最佳工艺条件:pH 6、液料比20∶1(mL/g)、提取温度150 ℃、浸提时间10 min,此条件下小麦胚芽多糖提取率为7.26%,是传统水提法多糖得率(3.29%)的2倍左右。
1.9 新型提取技术
1.9.1 电解水提取技术
电解水(electrolyzed-oxidizing water,EOW)又称氧化还原电位水,是一种通过直流电的特殊电解装置对一定浓度的盐溶液或者酸溶液进行低压电解,使溶液的pH值、氧化还原电位、有效氯浓度等指标发生变化,从而赋予盐溶液或者酸溶液特殊的理化性质,故也称电生功能水。根据pH值的不同,可将电解水分为酸性电解水(acidic electrolyzed water,AEW)、微酸性电解水(slightly acidic electrolyzed water,SAEW)和碱性电解水(alkaline electrolyzed water,AlEW)[54]。
电解水技术在食品工业中常被作为一种冷杀菌技术[55-56],近年来有少数学者尝试将其应用于动植物功能性成分的提取。韩晓梅等[57]在提取虾壳素时尝试使用电解水技术脱除虾壳中的蛋白质和矿物质等杂质,并对不同浓度盐溶液制备的电解水除杂效果进行比较。研究结果表明, 1% NaCl制备的电解水比0.1% NaCl制备的电解水除杂能力强。在20 V的电解条件下,使用1% NaCl制备的酸性电解水除矿物质6 h后再用碱性电解水脱蛋白质6 h,虾壳素提取率为19.46%, 矿物质去除率为99.64%,蛋白质去除率为97.99%,成品各指标均符合国家标准,且盐酸用量较传统方法降低了96.48%。李楚楚等[58]采用强酸性电解水作为提取液,研究了溶液pH、提取温度、提取时间、料液比对柿渣中果胶提取率的影响。通过单因素实验和响应面实验得到最佳工艺条件:溶液pH 1.6、提取温度85.4 ℃、提取时间78.7 min、料液比1∶50(g/mL),此时提取率为5.678%。袁森等[59]考察了电解水代替部分强碱提取豆渣中的可溶性大豆多糖,正交实验结果为提取温度65 ℃、提取时间70 min、pH 11、料液比1∶10、电解水∶氢氧化钠4∶6,此时提取率最高(12.08%),比传统碱提法节省了40%的强碱用量。
1.9.2 高压脉冲电场辅助提取法
高压脉冲电场技术(pulsed electric field,PEF)是一种新型食品加工技术,主要利用高压脉冲发生器产生的脉冲波对动植物的细胞进行作用,使细胞壁发生破裂、蛋白质变性等,以达到灭活的目的。其波形主要有方波、指数衰减波以及振荡波等,这几种波形中以方波对细胞的破坏力最强,振荡波最差[60]。目前国内主要将其用于食品杀菌、酶的灭活等方面,在动植物功能性成分提取方面应用还较少。已有研究表明高压脉冲的脉冲波可使苹果果实细胞出现质壁分离,细胞膜通透性增加, 细胞内容物外漏[61],同时高压脉冲处理可使细胞纤维结构发生断裂[62],因此可以提高活性成分的浸提率。
骆航等[63]利用响应面实验法优化了高压脉冲电场辅助提取火棘果主要活性成分的工艺条件。实验结果表明,料液比1∶30(g/mL)、乙醇浓度68%、电场强度19 kV/cm、脉冲数11个的条件下,火棘果总黄酮、多酚、红色素和浸膏得率最高。用高压脉冲电场协同超声提取豆渣中水溶性大豆多糖,其多糖得率为19.24%,纯度为83.41%,与传统热水提取法相比降低了提取温度,将提取时间缩短了1/2~3/4[64]。
2 可溶性大豆多糖的分离纯化
通过上述方法提取的可溶性大豆多糖往往还含有单糖、蛋白质、色素、无机盐等杂质,需进一步分离纯化。
2.1 除蛋白
2.1.1 Sevage法
Sevage法是利用蛋白质在氯仿-正丁醇(4∶1)混合液中变性沉淀而多糖不沉淀,通过离心达到去除蛋白的目的。该方法较温和,对多糖的结构影响小,但是效率低,需多次重复。
2.1.2 三氯乙酸法(TCA法)
根據蛋白质在酸性条件下会发生变性,生成不溶性的盐沉淀这一特性达到除蛋白的目的。一般在低温条件下将5%~10%的三氯乙酸溶液滴加至多糖提取液中,充分混匀至提取液不再浑浊,在4 ℃条件下静置过夜,离心除去下层蛋白质沉淀、取上清液即可[65]。该方法具有提取效率高、除蛋白效果好的特点,但是会对多糖结构造成破坏,多糖损失率高。
2.1.3 酶法
一般是使用各种蛋白酶对提取液中的蛋白质进行酶解,常用的酶有木瓜蛋白酶、碱性蛋白酶、中性蛋白酶等。该方法反应条件温和,但是成本昂贵,操作繁琐。桂雨豪[66]对比了木瓜蛋白酶、碱性蛋白酶、中性蛋白酶去除大豆多糖提取液中蛋白杂质的效果,得出木瓜蛋白酶的效果最好(蛋白残留率为6.16%),中性蛋白酶次之(蛋白残留率为7.95%),碱性蛋白酶最差(蛋白残留率为9.87%)。
2.2 脱色
常用的多糖脱色方法有活性炭法、过氧化氢法、大孔树脂法等[23]。
2.2.1 活性炭法
活性炭是一种黑色无定形的多孔碳,内部有众多大小不一的微孔、过渡孔、大孔,使其具有较大的内表面积(500~1 000 m2/g),因此有很好的吸附效果,常用来脱色、脱味、吸附有害金属离子等。此方法脱色效果显著,但是耗时长且多糖损失率较高。
2.2.2 过氧化氢法
过氧化氢是一种强氧化剂,能使发色基团氧化分解,具有脱色效率高、适应范围广、不易复色等优点,但可能会对多糖结构造成破坏。
2.2.3 大孔吸附树脂法
大孔吸附树脂是以苯乙烯和丙酸酯为单体,通过乙烯苯交联,而后采用甲苯或者二甲苯制孔形成的多孔结构,通过范德华力和较大的表面积达到吸附效果,同时多孔的结构可以起到分离纯化的作用。其不溶于酸碱及有机溶剂,不受无机盐类及强离子、低分子化合物的影响[67]。但是解吸易受洗脱剂的种类、浓度、pH等的影响。操作较复杂,不易在实验室操作。
2.3 可溶性大豆多糖的纯化
2.3.1 醇沉法
主要通过乙醇降低溶液的介电常数使多糖脱水发生沉淀,再经离心得到多糖。该方法几乎适用于所有水溶性多糖,但特异性差,需经多次重沉淀,导致多糖损失率较高。施翠娥等[15]经实验得出,80%的乙醇对可溶性大豆多糖的分离效果较好。
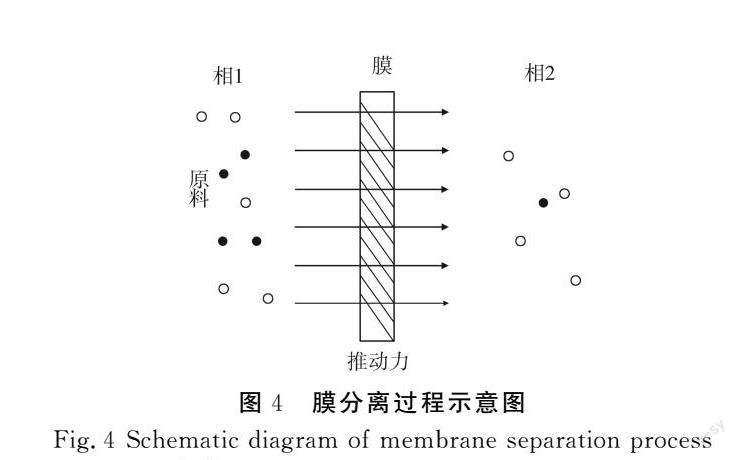
2.3.2 膜分离技术
膜分离技术是利用具有一定选择透过特性的过滤介质,以外界压力或化学位差为推动力,使多组分液体中的特定物质透过,达到分离纯化和富集的作用。该方法具有节能、高效、提取温度低、操作可连续的优势,缺点是需要专业设备进行操作。膜分离过程示意图见图4。
苏浩等[68]使用0.5 μm无机陶瓷膜、10 kDa有机膜及复合纳滤膜对豆渣中提取的可溶性多糖进行分离,得到了2 179,39,10 kDa 3种分子量的可溶性大豆多糖,说明该方法可以有效分离可溶性大豆多糖。
2.3.3 凝胶柱层析法
凝胶柱层析法是根据凝胶孔径的大小分离不同组分,当样品溶液缓慢流经色谱柱时,大分子物质因直径较大不易进入凝胶微孔,所以用洗脱剂洗脱时下移速度较快而先流出,小分子后流出。常用的凝胶有葡聚糖凝胶和琼脂糖凝胶,洗脱剂多为不同浓度的盐溶液和缓冲液[23]。此法不适宜黏性多糖的分离。Gu等[69]使用凝胶柱层析法从中药材黄精中分离出黄精多糖。
3 可溶性大豆多糖在食品上的应用
3.1 作为膳食纤维添加剂应用于保健食品、功能性食品及特殊人群膳食
Madar[70]通过AOAC组织发布的膳食纤维含量测试方法,测得水溶性大豆多糖中水溶性膳食纤维含量高达60%以上,因此可溶性大豆多糖具备膳食纤维的生理功能。根据已有资料,膳食纤维能降低血糖、血脂和胆固醇[71-72],膳食纤维是一类不能被人体消化的多糖,进入消化器官后吸水膨胀,形成具有黏性的水溶液,阻碍消化酶与食物的接触,同时还有一部分附着在肠壁上形成隔膜,从而限制小肠对葡萄糖、脂肪和胆固醇等物质的吸收。膳食纤维还能预防肥胖[73-74],膳食纤维具有良好的持水力和膨胀力,可增加饱腹感,延长胃排空时间,减少人体对食物的摄入量,进而达到预防肥胖的目的。膳食纤维还具有促进肠道有益菌群的生长,预防肠道疾病的能力[75-76],膳食纤维在肠道内可被部分有益菌利用,从而促进肠道有益菌的生长,抑制腐败菌的繁殖。同时膳食纤维还能促进胃肠蠕动,加快排便,缩短有害物质在肠道内的停留时间。Maeta等[77]发现富含膳食纤维的豆渣汤可有效治疗便秘。膳食纤维还能预防癌症[78-79],膳食纤维可与有害的金属离子等物质结合避免被人体吸收,同时可加快有害物质的排泄,缩短与人体接触的时间。
3.2 作为抗黏结剂和抗老化剂应用于米面制品
关于可溶性大豆多糖抗淀粉黏结和老化的机制研究较少,主流观点认为可溶性大豆多糖可吸附于淀粉颗粒表面,阻隔淀粉分子之间彼此接触,从而降低淀粉糊化后的黏度,缓解米面制品冷却过程中发生黏连的现象。另外,吸附于淀粉颗粒表面的大豆多糖吸水形成具有隔离作用的水合层[80-81],不仅增加了其持水性,还避免了淀粉因失水而老化。Funami等通过激光扫描共聚焦显微镜(CLSM)观察可溶性大豆多糖对小麦淀粉糊化和回生的影响时,发现可溶性大豆多糖颗粒连续地存在于淀粉颗粒表面。Liu等[82]使用CLSM手段观察可溶性大豆多糖于藕粉和葛根粉中的分布情况,得到和Funami等相同的结果。两人的实验结果为上述可溶性大豆多糖抗淀粉老化和黏结的机制提供了可靠证据。当然也有人认为大豆多糖对淀粉的抗老化可能是多种原因共同造成的,比如影响了淀粉的结晶重排,大豆多糖造成了不适于淀粉老化的水环境等,具体机制还有待进一步研究。
具体应用上研究较多如面条[83]、米饭[84]、面包[85]、油条[86]、春卷[87]等,此处不再赘述。
3.3 作为乳化剂和稳定剂应用于乳液
乳液是含有2种或2种以上互不相溶液体的不稳定体系。食品中常见的两种乳液类型为:水包油(oil in water,O/W)和油包水(water in oil,W/O),其形成需借助外界能量的输入,如快速搅拌、高压均质、持续沸腾等。通常乳液并不能长期保持稳态,如絮凝、聚结、Ostwald熟化、分层、沉淀及相反转等因素会引起O/W型乳液的失稳[88-89],因此需加入乳化剂以维持乳液的长期稳定。按分子量可将乳化剂划分为小分子乳化剂和大分子乳化剂两类,食品工业上常用的小分子乳化剂有吐温、司班、磷脂、皂苷等,其具有乳化活性高的特点[90-91],但适应性和长期稳定性不如天然大分子乳化剂[92],如阿拉伯胶。可溶性大豆多糖和阿拉伯胶相似,是一种多糖-蛋白复合物,具有优良的表面活性,且乳化性能较阿拉伯胶更佳[93]。可溶性大豆多糖中的疏水氨基酸能吸附于油滴表面,将深入水相部分的糖支链固定在油滴上,水溶液中的支链则在油滴表面形成一层水化膜。由于静電和空间位阻的双重作用,使其具有优异的乳化稳定性,且乳液稳定性不受pH值、高温及盐离子的影响[94],因此相较于小分子乳化剂应用范围更广。可溶性大豆多糖稳定乳液机理模型见图5。
徐洁茹等[95]利用乙酸酐法对大豆多糖进行乙酰化修饰,发现修饰后的SSPS乳化活性和乳化稳定性得到进一步提高,且不易受高温和pH的影响。Tavasoli等[96]将SSPS与酪蛋白酸钠(NaCS)通过干法美拉德反应形成共轭复合物,研究其乳化性能。实验结果表明,加热24 h、SSPS∶NaCS为1∶9时,形成的共轭复合物具有较高的pH值、热稳定性和较好的乳化性能。
通过化学方法提高大豆多糖的乳化性能及对高温、高酸环境的耐受性,弥补天然大分子乳化剂活性的不足,对其工业应用有很重要的意义。
3.4 作为酪蛋白稳定剂应用于酸性乳饮料
牛乳中的酪蛋白胶束是由4个亚组分(αs1-酪蛋白、αs2-酪蛋白、β-酪蛋白、κ-酪蛋白)通过磷酸钙纳米簇连接而成[96],其等电点约为pH 4.6[97]。当溶液pH<5时,酪蛋白磷酸钙完全溶解,胶束之间的空间位阻降低,酪蛋白胶粒净负电荷减少,静电排斥力降低。当溶液pH低于酪蛋白等电点时,酪蛋白胶束粒的净负电荷逐渐转变为正电荷,彼此间没有足够的排斥力对抗范德华吸引力,导致酪蛋白聚集发生沉淀[98]。而SSPS是一种阴离子多糖,当pH>3时,主链上的半乳糖醛酸使其具有带负电荷的酸性性质。因此可在酸性溶液中通过静电吸附于酪蛋白表面,形成空间位阻,避免酪蛋白质聚集出现沉淀现象。
朱丽娜等[99]研究了可溶性大豆多糖在酸性乳饮料中的稳定性,结果显示酸乳饮料在25 ℃储存条件下,其稳定性理化指标都没有显著的改变。周森等[100]研究发现0.4%的SSPS添加量对蛋白质量含1.0%的酸乳饮料稳定效果最佳,蛋白质含量超过2%时稳定性变差。SSPS与果胶可协同作为酸乳饮料的稳定剂,SSPS与果胶比为1∶3时效果最好。
此外,汪洪涛等[101]、廖文艳等[102]的研究结果都表明,相较于果胶,以可溶性大豆多糖为稳定剂制成的饮料黏度低,口感更爽口。
3.5 作为膜材料应用于食品包装及水果保鲜
可溶性大豆多糖有良好的成膜特性,具有阻气、阻菌和一定的机械强度,可以喷涂于食物表面起到保鲜的作用或者制作成绿色可降解的食品包装膜[103]。单一的SSPS制成的膜各性能指标较差,通常需要添加改性剂(TiO2[104-106]、SiO2、Cloisite 30B[107]、ZnO[108]等纳米金属离子或各类精油[109-111])增强SSPS膜分子间的作用力,减少膜的含水量,提高膜的机械强度、阻隔性能、耐水性能、抗菌性能等。其机理原理见图6。
皮薄水多以及易被氧化的水果在储藏时常因表皮破损、后熟作用、霉菌污染、褐变等导致水果品质降低,货架期缩短,降低了经济效益。目前除了冷藏贮藏外,有人尝试使用SSPS涂膜的方式进行保鲜,该方法具有绿色环保、安全无毒、操作简单等特点。曾维丽等[112-113]将SSPS与植物提取物复配制成涂膜应用于草莓和葡萄的保鲜,可显著提高好果率,减少水分的损失和霉菌污染。
3.6 作为抗冻剂应用干鱼糜制品及肉制品
肉糜类制品在冷冻保藏时会因蛋白质变性,造成食用品质变差、营养成分流失等问题。高文宏等[114]发现可溶性大豆多糖的羟基可与蛋白质分子结合,形成空间位阻,避免蛋白质因聚集而发生变性。此外,可溶性大豆的羟基能与一部分自由水结合,使其转变成结合水,降低了肉糜类制品的结晶点,从而减小蛋白质因冰晶生成而变性的影响。通过综合评估认为5%的SSPS能有效延缓肌原纤维蛋白冷冻变性,能作为一种低能量的抗冻剂使用。
4 结语
首先,可溶性大豆多糖不仅有巨大而廉价的原料来源,而且有着广泛应用场景,值得深入研究。其次,可溶性大豆多糖的提取工艺已有不少,但是对不同提取工艺获得的可溶性大豆多糖的分子量、抗氧化性、乳化性、成膜性、抗淀粉老化等指标存在差异,以及会导致性能差异的机制没有进一步深入探讨。如探明机制可根据实际需求更加科学合理地选用适当的、高效的提取方法,更有针对性。最后,可溶性大豆多糖作为天然多糖有不足,因此通过化学方法修饰其结构或与其他物质复合以提升某方面的性能,使其更具有商业价值。
参考文献:
[1]FURUTA H, MAEDA H. Rheological properties of water-soluble soybean polysaccharides extracted under weak acidic condition[J].Food Hydrocolloids,1999,13(3):267-274.
[2]NAKAMURA A, FURUTA H, MAEDA H, et al. Analysis of structural components and molecular construction of soybean soluble polysaccharides by stepwise enzymatic degradation[J].Bioscience,Biotechnology,and Biochemistry,2001,65(10):2249-2258.
[3]NAKAMURA A, FURUTA H, MAEDA H, et al. Analysis of the molecular construction of xylogalacturonan isolated from soluble soybean polysaccharides[J].Bioscience,Biotechnology, and Biochemistry,2002,66(5):1155-1158.
[4]靳薔薇.天然高分子乳化剂的比较研究[D].上海:上海交通大学,2017.
[5]FUNAMI T, NAKAUMA M, NODA S, et al. Effects of some anionic polysaccharides on the gelatinization and retrogradation behaviors of wheat starch:soybean-soluble polysaccharide and gum arabic[J].Food Hydrocolloids,2008,22(8):1528-1540.
[6]MATSUMURA Y, EGAMI M, SATAKE C, et a1. Inhibitory effects of peptide-bound polysaccharides on lipid oxidation in emulsions[J].Food Chemistry,2003(83):107-119.
[7]宋慧,苗敬芝,董玉玮.双酶法提取大豆多糖及其抗氧化性研究[J].中国食品添加剂,2011(5):89-93.
[8]NAKAMURA A, FURUTA H, KATO M, et al. Effect of soybean soluble polysaccharides on the stability of milk protein under acidic conditions[J].Food Hydrocolloids,2003,17(3):333-343.
[9]钟碧疆.可溶性大豆多糖絮凝性及机理研究[D].广州:华南理工大学,2011.
[10]刘塞纳.水溶性大豆多糖甲氧基含量对其成膜性能的影响[J].中国油脂,2018,43(4):130-134.
[11]赵启竹.可溶性大豆多糖对淀粉老化的抑制及影响因素研究[D].无锡:江南大学,2021.
[12]傅晶依,王思琪,丁修庆,等.大豆多糖的提取、分离纯化与功能的研究进展[J].食品研究与开发,2020,41(13):213-218.
[13]徐玉环,吴月芳.2019大豆食品重点加工企业调研报告[J].大豆科技,2019(6):37-40.
[14]张振山,叶素萍,李泉,等.豆渣的处理与加工利用[J].食品科学,2004(10):400-406.
[15]施翠娥,蒋立科,李苗苗.大豆多糖提取分离工艺的优化研究[J].安徽农学通报(上半月刊),2009,15(3):148-150.
[16]桂雨豪,郭蔼明,杨锦杰,等.从豆渣中提取水溶性大豆多糖的工艺优化研究[J].中国酿造,2015,34(9):71-74.
[17]朱丹,朱立斌,牛广财,等.沙果渣膳食纤维超高压处理条件优化及其微观结构表征[J].天然产物研究与开发,2020,32(1):118-126.
[18]FAYAZ G, PLAZZOTTA S, CALLIGARIS S, et al. Impact of high pressure homogenization on physical properties, extraction yield and biopolymer structure of soybean okara[J].LWT-Food Science and Technology,2019,113:108324.
[19]CHEN P C, LIN C, CHEN M H, et al.The micronization process for improving the dietary value of okara (soybean residue) by planetary ball milling[J].LWT-Food Science and Technology,2020,132:109848.
[20]王曼宇,劉乃新,张福顺.植物源性多糖提取及生物活性研究进展[J].中国农学通报,2021,37(29):34-41.
[21]ZHANG B, LI Y, ZHANG F, et al. Extraction, structure and bioactivities of the polysaccharides from Pleurotus eryngii: a review[J].International Journal of Biological Macromolecules,2020,150:1342-1347.
[22]YAMAGUCHI F, KOJIMA H, MURAMOTO M, et al. Effects of hexametaphosphate on soybean pectic polysaccharide extraction[J].Bioscience,Biotechnology,and Biochemistry,1996,60(12):2028-2031.
[23]熊杰,杨玥熹,华欲飞.豆渣水溶性大豆多糖提取工艺研究[J].大豆科学,2009,28(6):1119-1122.
[24]韦巍,李雪华.多糖的研究进展[J].国外医学药学分册,2005,32(3):179-180.
[25]WU G H, HU T, LI Z Y, et al. In vitro antioxidant activities of the polysaccharides from Pleurotus tuber-regium (Fr.) Sing[J].Food Chemistry,2014,148:351-356.
[26]朱强,蒋建茹,林欣大.酸碱法提取黄粉虫中壳聚糖的要点[J].科技创新导报,2014,11(14):238.
[27]孟岳成,邱蓉,张学兵.碱法提取可溶性大豆多糖的工艺[J].食品研究与开发,2009,30(11):83-86.
[28]李利红,李凯,李向辉,等.刺五加多糖的提取工艺研究[J].饲料研究,2019,42(6):93-96.
[29]俞明君,李苗苗,王金浩,等.杏鲍菇水溶性和碱溶性多糖提取工艺研究[J].食用菌,2017,39(6):78-80.
[30]YE J, HUA X, ZHAO Q, et al. Characteristics of alkali-extracted peanut polysaccharide-protein complexes and their ability as Pickering emulsifiers[J].International Journal of Biological Macromolecules,2020,162:1178-1186.
[31]王萱萱,刘春宇,谢贝昱,等.碱提甘蔗皮多糖提取工艺、初步结构及其对α-葡萄糖苷酶的抑制作用[J].中国农业科学,2021,54(12):2653-2665.
[32]范文奇,要志宏,申丽媛,等.豆粕多糖的酶法提取工艺研究[J].中国调味品,2017,42(5):65-68,83.
[33]CHENG M, QI J R, FENG J L, et al. Pea soluble polysaccharides obtained from two enzyme-assisted extraction methods and their application as acidified milk drinks stabilizers[J].Food Research International,2018,109:544-551.
[34]SORIA A C, VILLAMIEL M. Effect of ultrasound on the technological properties and bioactivity of food: a review[J].Trends in Food Science & Technology,2010,21(7):323-331.
[35]BARBERO G F, LIAZID A, PALMA M, et al. Ultrasound-assisted extraction of capsaicinoids from peppers[J].Talanta,2008,75(5):1332-1337.
[36]郭孝武.超声提取分离[M].北京:化学工业出版社,2008.
[37]RASO J, MANAS P, PAGAN R, et al. Influence of different factors on the output power transferred into medium by ultrasound[J].Ultrasonics Sonochemistry,1999,5(4):157-162.
[38]FERANADEZ-LEON M F, FRENANDEZ-LEON A M, LOZANO M, et al. Altered commercial controlled atmosphere storage conditions for 'Parhenon' broccoli plants (Brassica oleracea L. var. italica). Influence on the outer quality parameters and on the health-promoting compounds[J].LWT-Food Science and Technology,2013,50(2):665-672.
[39]KIKUCHI K, IOKA A, OKU T, et al. Concentration determination of oxygen nanobubbles in electrolyzed water[J].Journal of Colloid and Interface Science,2009,329(2):306-309.
[40]侯睿.水溶性大豆多糖與超声波辅助冷冻协同改善草鱼鱼糜品质的研究[D].广州:华南理工大学,2018.
[41]何玉红.豆渣中水溶性大豆多糖的提取及其在面包中的应用[D].合肥:合肥工业大学,2007.
[42]VALACHOVIC P, PECHOVA A, MASON T J. Towards the industrial production of medicinal tincture by ultrasound assisted extraction[J].Ultrasonics Sonochemistry,2001,8(2):111-117.
[43]郝继伟.超声波提取豆渣中水溶性大豆多糖工艺研究[J].大豆科学,2011,30(3):507-510.
[44]田海娟,于晓平,季蕾蕾.Design-Expert设计超声波法提取豆渣中大豆多糖工艺优化[J].食品研究与开发,2014,35(24):66-70.
[45]田瑞红,江连洲,胡少新,等.超声波酶法提取豆渣中水溶性多糖条件的优化[J].大豆科技,2019(1):179-183.
[46]任花.微波辅助法提取豆渣中大豆多糖的工艺研究[J].轻工科技,2015,31(12):21-22,25.
[47]王胜男,赵玲玲,张红运,等.提取方法对大豆种皮多糖乳化能力的影响[J].中国食品学报,2018,18(1):154-161.
[48]范宏亮,赵玲玲,李君,等.微波辅助提取工艺对大豆种皮水溶性多糖-蛋白乳状液乳化活性及表面电位的影响[J].食品科学,2018,39(20):49-56.
[49]谭兰芳,许文珍,杨跃歌,等.超临界CO2萃取白花蛇舌草粗多糖工艺研究[J].化工管理,2021(6):81-82.
[50]杨孝辉,郭君.响应面法优化超临界CO2流体萃取淮山多糖工艺[J].食品工业科技,2019,40(7):185-189,198.
[51]张继贤.亚临界水萃取温度对香菇多糖化学结构、链构象转变及生物活性的影响研究[D].镇江:江苏大学,2020.
[52]娄冠群,张永忠,李振艳,等.亚临界水提取豆渣中可溶性大豆多糖工艺研究[J].中国油脂,2010,35(5):61-63.
[53]赵彬,张海晖,张继贤,等.小麦胚芽多糖的亚临界水萃取的工艺研究[J].食品工业,2017,38(7):45-49.
[54]谢慧琳,唐金艳,林育钊,等.电解水技术在采后果蔬保鲜中的应用研究进展[J].盐城工学院学报(自然科学版),2020,33(1):61-66.
[55]赵月涵,杨盈悦,邓尚贵,等.冷杀菌技术在水产品保鲜中的应用研究进展[J].中国渔业质量与标准,2021,11(5):56-64.
[56]翟娅菲,田佳丽,相启森,等.非热加工技术在果蔬保鲜中的应用[J].食品工业,2021,42(5):327-332.
[57]韩晓梅,吴小禾,李文亚,等.电解水在利用虾壳提取甲壳素中的应用研究[J].食品研究与开发,2019,40(16):51-57.
[58]李楚楚,赵丹丹,韩雪,等.利用酸性电解水提取柿子渣中果胶及其工艺优化[J].食品科技,2019,44(1):274-280.
[59]袁森,杜明星,李博生.电解水替代强碱提取大豆渣可溶性多糖工艺优化研究[J].河北农业大学学报,2021,44(1):85-90.
[60]汤国强,沙俊杰,黄宝军.油田污水处理中高压脉冲电场杀菌方法的研究[J].化工自动化及仪表,2015,42(8):901-903.
[61]BAZHAL M I, NGADI M O, RAGHAVAN G S V, et al. Textural changes in apple tissue during pulsed electric field treatment[J].Journal of Food Science,2003,68(1):249-253.
[62]LOHANI U C, MUTHUKUMARAPPAN K. Application of the pulsed electric field to release bound phenolics in sorghum flour and apple pomace[J].Innovative Food Science & Emerging Technologies,2016,35:29-35.
[63]骆航,王文渊,尹素娟,等.响应面法优化高压脉冲电场提取火棘果活性成分[J].食品安全质量检测学报,2022,13(2):373-380.
[64]华南理工大学.一种利用高压脉冲电场协同超声提取豆渣中水溶性大豆多糖的方法:中国,CN202110528203.8[P].2021-09-07.
[65]侯越,包鸿慧.榛蘑多糖提取液脱蛋白方法的研究[J].农产品加工,2018(15):69-70,76.
[66]桂雨豪.水压热法制备水溶性大豆多糖与其应用研究[D].广州:华南理工大学,2016.
[67]向瑞琪,谢锋,李占彬.食用菌多糖提取、检测、生物活性与机制研究进展[J].黑龙江农业科学,2021(7):109-115.
[68]苏浩,余以刚,杨海燕,等.膜分离技术在水溶性大豆多糖提取中的应用[J].食品工业科技,2009,30(8):216-217,220.
[69]GU W, WANG Y, ZENG L, et al. Polysaccharides from Polygonatum kingianum improve glucose and lipid metabolism in rats fed a high fat diet[J].Biomedicine & Pharmacotherapy,2020,125:109910.
[70]MADAR Z. Effect of brown rice and soybean dietary fiber on the control of glucose and lipid metabolism in diabetic rats[J].The American Journal of Clinical Nutrition,1983,38(3):388-393.
[71]ARUN K B, THOMAS S, RESHMITHA T R, et al. Dietary fibre and phenolic-rich extracts from Musa paradisiaca inflorescence ameliorates type 2 diabetes and associated cardiovascular risks[J].Journal of Functional Foods,2017,31:198-207.
[72]LUO X, WANG Q, ZHENG B, et al. Hydration properties and binding capacities of dietary fibers from bamboo shoot shell and its hypolipidemic effects in mice[J].Food and Chemical Toxicology,2017,109:1003-1009.
[73]HAN S F, JIAO J, ZHANG W, et al. Lipolysis and thermogenesis in adipose tissues as new potential mechanisms for metabolic benefits of dietary fiber[J].Nutrition,2017,33:118-124.
[74]CHEW K Y, BROWNLEE I A. The impact of supplementation with dietary fibers on weight loss: a systematic review of randomised controlled trials[J].Bioactive Carbohydrates and Dietary Fibre,2018,14:9-19.
[75]ZHOU R, REN Z, YE J, et al. Fermented soybean dregs by neurospora crassa: a traditional prebiotic food[J].Applied Biochemistry and Biotechnology,2019,189(2):608-625.
[76]白冰瑤,刘新愚,周茜,等.红枣膳食纤维改善小鼠功能性便秘及调节肠道菌群功能[J].食品科学,2016,37(23):254-259.
[77]MAETA A, KSTSKAWA M, INOMOTO Y, et al. Intake of okara soup for 2 weeks for breakfast improved defecation habits in young Japanese women with self-reported constipation: a randomized, double-blind, placebo-controlled, intervention study[J].Journal of Food Science,2020,85(10):3570-3576.
[78]HE Y, WANG B, WEN L, et al. Effects of dietary fiber on human health[J].Food Science and Human Wellness,2022,11(1):1-10.
[79]TANG L, XU F, ZHANG T, et al. Dietary fibre intake associated with reduced risk of oesophageal cancer in Xinjiang, China[J].Cancer Epidemiology,2013,37(6):893-896.
[80]王思遠.水溶性大豆多糖的改性及在米粉中的应用研究[D].广州:华南理工大学,2011.
[81]MAEDAA H, NAKAMURA A. Soluble Soybean Polysaccharide[M].Cambrrdge: Woodhead Publishing,2009:693-709.
[82]LIU D, LI Z, FAN Z, et al. Effect of soybean soluble polysaccharide on the pasting, gels, and rheological properties of kudzu and lotus starches[J].Food Hydrocolloids,2019,89:443-452.
[83]王雨,刘翀,洪静,等.可溶性大豆多糖对中筋小麦粉面团特性和生鲜面品质的影响[J].食品科技,2020,45(3):177-183.
[84]刘传菊,赵玉,汤尚文,等.可溶性大豆多糖对碎米粉物化特性的影响[J].中国粮油学报,2021,36(9):7-13,21.
[85]刘倩,吕远,邢胜杰,等.可溶性大豆多糖对面包品质的影响[J].食品科技,2013,38(5):179-182.
[86]胡喜萍.可溶性大豆多糖对面粉和面团流变学及油条品质的影响[J].现代面粉工业,2019,33(6):52.
[87]潘燕,钟昔阳,罗水忠,等.可溶性大豆多糖对春卷皮冻融循环过程中品质变化的影响[J].食品科学,2022,43(8):59-65.
[88]BANDE R M, PRASAD B, MISHRA I M, et al. Oil field effluent water treatment for safe disposal by electroflotation[J]. Chemical Engineering Journal,2008,137(3):503-509.
[89]ISRAELACHVIL J N.Intermolecular and Surface Forces: Special Interactions: Hydrogen-Bonding and Hydrophobic and Hydrophilic Interactions[M].New York:Academic Press,2011:151-167.
[90]PELAN B M C, WATTS K M, CAMPBELL I J, et al. The stability of aerated milk protein emulsions in the presence of small molecule surfactants[J].Journal of Dairy Science,1997,80(10):2631-2638.
[91]LOBO L, SVEREIKA A. Coalescence during emulsification: 2. Role of small molecule surfactants[J].Journal of Colloid and Interface Science,2003,261(2):498-507.
[92]DICKINSON E. Hydrocolloids at interfaces and the influence on the properties of dispersed systems[J].Food Hydrocolloids,2003,17(1):25-39.
[93]杨晓泉,齐军茹,司华静,等.大豆多糖的研究进展及在含乳饮料、米面等食品上的应用[J].中国食品添加剂,2008(3):135-139.
[94]KIKUCHI T, YOKOTSUKA T. Studies on the polysaccharides from soy sauce: Part I. Purification and properties of two acidic polysaccharides[J].Agricultural and Biological Chemistry,1972,36(4):544-550.
[95]徐洁茹,童群义.乙酰化可溶性大豆多糖的制备及其乳化性能研究[J].食品与发酵工业,2021,47(21):148-157.
[96]TAVASOLI S, MAGHSOUDLOU Y, JAFARI S M, et al. Improving the emulsifying properties of sodium caseinate through conjugation with soybean soluble polysaccharides[J].Food Chemistry,2022(377):131987.
[97]LOGAN A, DAY L, PIN A, et al. Interactive effects of milk fat globule and casein micelle size on the renneting properties of milk[J].Food and Bioprocess Technology,2014,7(11):3175-3185.
[98]TREJO R, CORZO-MARTINEZ M, WILKINSON S, et al. Effect of a low temperature step during fermentation on the physico-chemical properties of fat-free yogurt[J].International Dairy Journal,2014,36(1):14-20.
[99]朱丽娜,张立永,张敏,等.可溶性大豆多糖在酸性乳饮料中的应用[J].中国乳品工业,2009,37(4):33-35.
[100]周森,何志勇,曾茂茂,等.可溶性大豆多糖对于配制型酸性乳饮料稳定效应影响因素研究[J].食品科技,2019,44(7):308-313.
[101]汪洪涛,陈成,石雪萍,等.豆渣中水溶性大豆多糖的性质及应用研究[J].河南农业科学,2014,43(6):157-160.
[102]廖文艳,徐致远,刘振民.大豆多糖在常温褐色乳酸菌饮品中的应用[J].江苏农业科学,2016,44(12):303-305.
[103]黄宸,谢晶,薛斌,等.大豆多糖复合膜及其保鲜应用研究进展[J].食品与发酵工业,2021,47(10):251-258.
[104]申亚倩,陈志周,安永超,等.纳米 TiO2 改性天然聚合物包装膜的研究进展[J].包装与食品机械,2014,32(6):60-63.
[105]GHAZIHOSEINI S, ALIPOORMAZANDARANI N, NAFCHI A M. The effects of nano-SiO2 on mechanical, barrier, and moisture sorption isotherm models of novel soluble soybean polysaccharide films[J].International Journal of Food Engineering,2015,11(6):833-840.
[106]SHAILI T, ABDORREZA M N, FARIBORZ N. Functional, thermal, and antimicrobial properties of soluble soybean polysaccharide biocomposites reinforced by nano TiO2[J].Carbohydrate Polymers,2015,134:726-731.
[107]SALARBASHI D, TAFAGHODI M, BAZZAZ B S F, et al. Characterization of a green nanocomposite prepared from soluble soy bean polysaccharide/Cloisite 30B and evaluation of its toxicity[J].International Journal of Biological Macromolecules,2018,120:109-118.
[108]SALARBASHI D, MORTAZAVIS A, NOGHABI M S, et al. Development of new active packaging film made from a soluble soybean polysaccharide incorporating ZnO nanoparticles[J].Carbohydrate Polymers,2016,140:220-227.
[109]GHANI S, BARZEGAR H, NOSHAD M, et al. The preparation, characterization and in vitro application evaluation of soluble soybean polysaccharide films incorporated with cinnamon essential oil nanoemulsions[J].International Journal of Biological Macromolecules,2018,112:197-202.
[110]LIU Q R, WANG W B, QI J R, et al.Oregano essential oil loaded soybean polysaccharide films: effect of Pickering type immobilization on physical and antimicrobial properties[J].Food Hydrocolloids,2019,87:165-172.
[111]SALARBASHI D, TAJIK S, SHOJAEE-ALIABADI S, et al. Development of new active packaging film made from a soluble soybean polysaccharide incorporated Zataria multiflora Boiss and Mentha pulegium essential oils[J].Food Chemistry,2014,146:614-622.
[112]曾維丽,孙于庆,石晓.大豆多糖复合膜保鲜草莓的研究[J].保鲜与加工,2018,18(6):51-56.
[113]曾维丽,张锋杰.大豆多糖复合膜对红玫瑰葡萄的保鲜效果研究[J].中国果菜,2019,39(10):21-24,31.
[114]高文宏,黄扬萍,曾新安.水溶性大豆多糖对鳙鱼鱼糜蛋白冷冻变性及结构的影响[J].华南理工大学学报(自然科学版),2018,46(11):16-22.

