PXR、MDR1、CYP3A5和CYP2B6在高级别浆液性卵巢癌组织中的表达及其意义
张萍 马岚 陈桦
(1 青岛大学基础医学院,山东 青岛 266071;2 临沂市平邑县中医院病理科;3 青岛市市立医院病理科)
卵巢癌是最常见的妇科恶性肿瘤之一,其发病率仅次于宫颈癌和子宫内膜癌[1],患者5年生存率低于45%。近年来,全球卵巢癌发病率呈逐年上升趋势[2]。卵巢癌分为不同的组织学亚型,这些亚型在细胞起源、分子模式和临床特征上有所不同。最常见的亚型是高级别浆液性卵巢癌(high grade serous ovarian cancer,HGSOC),其也是卵巢癌患者死亡率较高的亚型之一[3]。随着分子病理学发展和靶向药物研发,HGSOC的诊疗取得了很大进步,但复发性和多药耐药(MDR)仍旧是其治疗上的主要障碍[4]。且孕烷X受体(PXR)、多药耐药蛋白1(MDR1)、细胞色素P450 3A5(CYP3A5)和细胞色素P450 2B6(CYP2B6)可通过不同的方式参与药物代谢,引起肿瘤的化疗耐药[5]。有研究显示,PXR基因能调控CYP3A5、CYP2B6、MDRl基因的表达[6],引起相应基因表达产物改变,从而影响相应的药物代谢,导致MDR的出现[7]。本研究通过免疫组织化学、实时定量荧光PCR及蛋白印迹等方法,对PXR、MDR1、CYP3A5和CYP2B6蛋白及基因进行检测,比较其在HGSOC和非HGSOC患者及HGSOC化疗耐药和敏感患者间的差异表达,以求为HGSOC患者个体化治疗提供更多理论依据。
1 资料与方法
1.1 一般资料
选取2019年9月—2021年12月青岛市市立医院妇科收治的56例HGSOC患者作为试验组。患者纳入标准:①原发性HGSOC者;②未合并其他脏器恶性疾病者;③既往无卵巢手术史者;④行腹腔镜或者开腹全子宫+双侧附件+盆腔淋巴结清扫术,且术后行铂类药物化疗者。排除标准:①认知功能或精神异常者;②合并有心肝肺等重要脏器疾病者;③临床资料缺损或丢失者。根据HGSOC患者对铂类化疗药的耐药情况,将初次采用铂类药物作为基础化疗药物并获得缓解,且停药超过6个月未复发者设为敏感组;将初次采用铂类药物作为基础化疗药物治疗有效,但完成化疗6个月内复发者设为耐药组。另选取妇科同期收治的行子宫+双侧输卵管切除术的16例子宫肌瘤患者作为对照组。
1.2 主要试剂和仪器
PXR鼠抗人单克隆抗体购自美国SantaCruz公司,MDR1、CYP3A5和CYP2B6鼠抗人单克隆抗体购自美国Abcam公司,免疫组化二抗PV-6000试剂盒、DAB试剂盒和山羊血清封闭液购自北京中杉金桥生物科技有限公司,GAPDH抗体、兔/鼠二抗购自上海艾比玛特医药科技有限公司,RNA提取试剂盒购自北京天根生化科技有限公司,荧光定量PCR试剂盒和反转录试剂盒购自赛默飞世尔科技(中国)有限公司,PCR引物由上海生工生物工程股份有限公司设计,蛋白印迹预制胶购自上海雅酶生物医药科技有限公司,电泳液、转膜液及裂解液购自上海碧云天生物科技有限公司,TBST购自北京索莱宝生物科技有限公司。仪器包括超微量分光光度计(上海凌光技术公司)、实时定量PCR仪CFX96 Real-Time PCR Detection System(美国伯乐公司)和电泳仪(北京君意东方电泳设备有限公司)等。
1.3 研究方法
1.3.1免疫组织化学检测 将试验组HGSOC患者肿瘤组织及对照组子宫肌瘤患者的正常输卵管组织置于40 g/L的甲醛溶液中固定,后脱水、包埋、切片、烤片、脱蜡,在柠檬酸盐缓冲液中加热进行抗原修复,使用山羊血清封闭;分别滴加PXR、MDR1、CYP3A5和CYP2B6一抗,37 ℃下孵育1 h,PBS清洗后滴加二抗,室温孵育30 min;继续用PBS清洗3次,DAB显色,苏木精复染,封片处理[8]。显微镜下观察,每张切片随机选取10个具有代表性着色的高倍视野作为最终结果。使用AxioVision Rel.4.6计算机化图像分析系统进行拍照。所有切片请病理学专家评估组织染色的程度,染色区域评分如下:0分(染色区域接近0)、1分(染色区域小于10%)、2分(染色区域11%~35%)、3分(染色区域36%~75%)、4分(染色区域76%~100%);染色强度评分如下:0分(无染色)、1分(弱染色)、3分(中度染色)和4分(强染色)。最终使用染色指数(SI)评分(SI评分=染色区域评分×染色强度评分)评价蛋白表达程度,SI评分≥4为阳性,SI评分<4为阴性[9]。统计各组患者中PXR、MDR1、CYP3A5、CYP2B6的阳性例数,并计算各组上述指标的阳性表达率。
1.3.2实时荧光定量PCR检测 将试验组HGSOC肿瘤组织及对照组正常输卵管组织分别在液氮中磨碎,按RNA提取试剂盒说明书步骤提取组织RNA,并用分光光度计测量吸光度值计算RNA浓度,根据各组浓度按照逆转录和扩增试剂盒说明书分别加入试剂和引物(表1)。在实时定量PCR仪上用两步法行PCR扩增,首先95 ℃预变性30 s;然后95 ℃变性 5 s,60 ℃ 退火30 s,共进行40个循环,从而得到各组的溶解曲线。根据PXR、MDR1、CYP3A5和CYP2B6基因扩增的CT值,以GAPDH作为内参照,使用2-△△CT法计算出各组PXR、MDR1、CYP3A5、CYP2B6 mRNA的相对表达量。

表1 PCR引物名称及序列
1.3.3蛋白质印迹分析 将试验组HGSOC肿瘤组织及对照组正常输卵管组织分别剪碎并充分研磨,加入裂解液和蛋白酶抑制剂及少量液氮匀浆;放置于预冷离心机中,在4 ℃下以12 000 r/min离心20 min;离心后EP管中吸取中间层,用BCA法检测蛋白浓度;加入Loading Buffer,100 ℃下煮沸10 min。根据测得蛋白浓度进行电泳、转膜,用含体积分数0.05脱脂奶粉的TBST液室温封闭2 h;以后分别加入PXR (1∶1 000)、MDR1(1∶2 000)、CYP3A5(1∶1 000)、CYP2B6(1∶1 000)和GAPDH(1∶8 000)一抗进行孵育,4 ℃环境下过夜。TBST清洗后,加入兔/鼠二抗(1∶8 000)室温孵育1 h,TBST溶液清洗3次后显影。使用Image J软件分析蛋白条带灰度值,以GAPDH为内参计算各组PXR、MDR1、CYP3A5和CYP2B6相对表达量。
2 结 果
2.1 试验组及对照组患者PXR、MDR1、CYP3A5和CYP2B6表达情况比较
本研究试验组56例患者中耐药组24例,敏感组32例;对照组患者16例。免疫组化染色结果显示,试验组患者HGSCO组织中PXR、CYP3A5和CYP2B6表达呈阳性,肿瘤细胞胞质呈现棕黄色,MDR1表达呈阳性,肿瘤细胞膜呈棕黄色;对照组患者正常输卵管组织PXR、CYP3A5和CYP2B6表达呈弱阳性或阴性,细胞质淡黄色或不着色,MDR1表达呈弱阳性或阴性,肿瘤细胞膜淡黄色或不着色(图1)。试验组患者HGSOC组织中PXR、MDR1、CYP3A5和CYP2B6的阳性表达率分别为71.4%、75.0%、73.2%和76.8%,对照组患者中上述指标的阳性表达率分别为43.8%、37.5%、31.3%和43.8%,试验组患者HGSCO组织上述指标的的阳性率均显著高于对照组(χ2=12.879~17.174,P<0.05)。

图1 试验组与对照组患者相应组织PXR、MDR1、CYP3A5和CYP2B6免疫组织化学染色结果(HE染色,400倍)
实时荧光定量PCR检测结果显示,试验组患者HGSOC组织中PXR、MDR1、CYP3A5和CYP2B6 mRNA相对表达量分别为0.79±0.18、0.93±0.06、0.87±0.07和1.01±0.11,对照组患者正常输卵管组织中上述指标mRNA相对表达量分别为0.30±0.05、0.35±0.03、0.31±0.021和0.59±0.05,两组比较差异有显著性(t=9.746~17.640,P<0.05)。
蛋白印迹实验结果显示,试验组患者HGSOC组织中PXR、MDR1、CYP3A5和CYP2B6蛋白的相对表达量分别为1.15±0.16、0.96±0.03、1.13±0.14和1.18±0.07,对照组患者正常输卵管组织中上述指标的相对表达量分别为0.56±0.00、0.68±0.06、0.54±0.05和0.58±0.08,两组比较差异有显著性(t=13.312~60.448,P<0.05)。见图2。

图2 试验组与对照组患者PXR、MDR1、CYP3A5和CYP2B6蛋白的表达量
2.2 敏感组及耐药组患者PXR、MDR1、CYP3A5Y和CYP2B6表达情况比较
耐药组患者的HGSOC组织中PXR、MDR1、CYP3A5和CYP2B6的阳性表达率分别为87.50%、91.70%、87.50%和95.80%,敏感组患者HGSOC组织中上述4指标的阳性表达率则分别为59.40%、62.50%、62.50%和62.50%,两组比较差异有显著性(χ2=4.371~8.549,P<0.05)。
实时荧光定量PCR检测结果显示,耐药组患者HGSOC组织中PXR、MDR1、CYP3A5和CYP2B6的mRNA相对表达量分别为0.83±0.10、0.93±0.08、0.87±0.08和1.01±0.09,敏感组患者HGSOC组织中上述指标mRNA的相对表达量分别为0.57±0.07、0.50±0.04、0.55±0.02和0.49±0.08,两组比较差异具有显著性(t=6.859~19.000,P<0.05)。
蛋白印迹实验结果显示,耐药组患者HGSOC组织中PXR、MDR1、CYP3A5和CYP2B6蛋白相对表达量分别为1.01±0.02、1.13±0.10、0.90±0.07和1.23±0.04,敏感组患者HGSOC组织中上述指标的蛋白相对表达量分别为0.73±0.04、0.47±0.06、0.44±0.26和0.60±0.14,两组比较差异有显著性(t=8.693~27.670,P<0.05)。见图3。
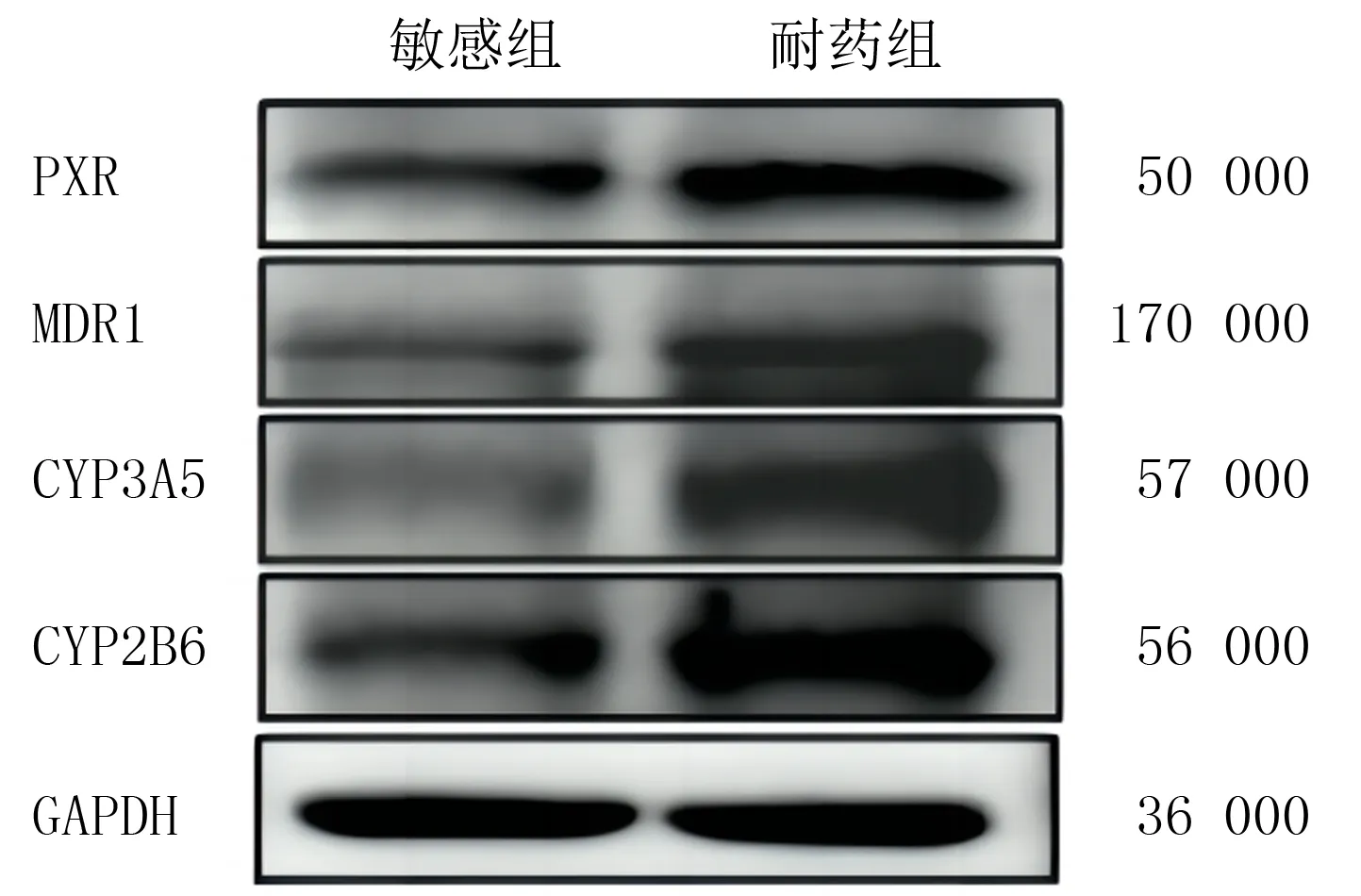
图3 耐药组与敏感组患者PXR、MDR1、CYP3A5和CYP2B6蛋白的表达量
2.3 试验组患者HGSOC组织中PXR与MDR1、CYP3A5、CYP2B6的相关性分析
Spearman相关性分析显示,试验组患者HGSOC组织中PXR与CYP3A5、CYP2B6的表达呈正相关(r=0.332、0.308,P<0.05),而与MDR1无明显相关性(P>0.05)。
3 讨 论
约80%卵巢癌患者在行全子宫+双侧附件+盆腔淋巴结清扫术后,会接受卡铂或顺铂和紫杉醇辅助化疗,其中70%患者会复发,进而对标准化疗方案中的铂类药物产生耐药,尤其是HGSOC患者,在治疗中面临着MDR的挑战,其预后往往较差[10-11]。有研究指出MDR潜在的机制有:①通过外排泵,如ABCB1编码的MDR1,增加药物的泵出;②通过药物代谢转运体(如MDR1表达的P-糖蛋白)使药物摄取减少;③激活细胞色素P450酶系(CYPs)和谷胱甘肽转移酶等药物代谢酶[12-13],从而分解药物并促进其排出。本研究通过免疫组化、实时定量荧光PCR以及蛋白印迹方法,证明了PXR、MDR1、CYP3A5以及CYP2B6在试验组患者HGSOC组织中表达升高;其中耐药组中患者PXR、MDR1、CYP3A5和CYP2B6的mRNA及蛋白相对表达量均显著高于敏感组,提示了HGSOC患者肿瘤组织中PXR、MDR1、CYP3A5和CYP2B6的高表达可能与耐药相关。因此可以通过检测上述因子,来预测HGSOC患者对化疗的敏感性,或者通过靶向抑制这些因子的表达来提高HGSOC患者对化疗药物的敏感性,以获得更有效的治疗效果。
PXR是核受体超家族的典型成员,在细胞内的主要功能是通过配体依赖的方式与调控基因序列结合,在细胞增殖、细胞周期等过程中发挥着重要作用[14]。PXR与宫颈癌、结肠癌及肺癌等多种恶性肿瘤相关[5]。PXR在解毒过程中也发挥着重要的作用,内源性化合物及化疗药物等外源性化合物在体内都可以通过结合配体激活PXR,上调药物代谢酶和转运体(例如CYPs和多药耐药蛋白等)的表达,从而加速自身在体内的代谢和清除[15],上述过程使化疗药物的效果大打折扣。本研究中,试验组患者中PXR阳性表达率和mRNA及蛋白相对表达量均明显高于对照组,说明PXR可能参与HGSOC的发生发展过程,这与VETTER等[16]的研究结果一致。MDR1是一种膜结合的ABC转运蛋白,它编码的P-糖蛋白参与多种抗癌药物(包括阿霉素、紫杉烷和铂类)的MDR。人体内MDR1可以广泛结合多种底物化合物,并利用ATP水解作用将化疗药物排出癌细胞[17],降低化疗药物的疗效。因此其存在是卵巢癌化疗失败的重要原因之一[18]。本研究中,试验组患者MDR1阳性表达率和mRNA及蛋白相对表达量均明显高于对照组。另外既往研究显示MDR1与卵巢癌的发生、发展及临床预后有关[19]。喻朝霞等[20]的研究也发现,MDR1的高表达参与了上皮性卵巢癌的发生及由良性到恶性的进展过程。这也与本研究的结论一致,提示MDR1可以作为HGSOC发生发展,尤其是从正常组织或良性病变进展为恶性病变的辅助诊断标志物之一。
CYPs是药物代谢的主要催化剂之一,其功能受基因多态性的影响较大,从而导致了药物疗效和(或)个体间差异显著[21]。CYP3A5基因位点的遗传变异影响了包括免疫抑制剂他克莫司、环孢素等在内的多种临床药物代谢[22]。SEELIG等[18]发现CYP3A5蛋白在多种恶性肿瘤中呈高表达,重要的是,它在外分泌样亚型肿瘤中会降低肿瘤细胞的药物敏感性,使其对酪氨酸激酶抑制剂和紫杉醇产生耐药性,这使得CYP3A5可能成为检验化学药物疗效和肿瘤早期诊断的预测因子。CYP2B6是人类唯一属于CYP2B亚家族的酶,其主要在成人肝脏中表达[23],可参与抗逆转录病毒、抗疟疾、抗癌以及抗抑郁药物的代谢过程,但是受自身基因多态性的影响[24],其催化活性和表达在个体之间差异较大。本研究中,试验组患者CYP3A5、CYP2B6的阳性表达率和mRNA及蛋白相对表达量均明显高于对照组,提示CYP3A5、CYP2B6的高表达可能参与了HGSOC的增殖侵袭过程。
为进一步探究HGSOC患者肿瘤组织中PXR、MDR1、CYP3A5以及CYP2B6间关系,本研究进行了Spearman相关分析,结果显示PXR与CYP3A5和CYP2B6的表达正相关,也与已有报道一致[25];CREAMER等[15]的研究表明PXR可调控MDR1的表达并存在协同作用,而本研究中PXR与MDR1无相关性,故后续可通过扩大样本量、细化实验如体外卵巢癌细胞培养、干扰PXR表达及观察MDR1表达有无变化等进一步研究两者间的关系。
综上所述,PXR、MDR1、CYP3A5、CYP2B6在HGSOC患者的肿瘤组织中呈高表达,其可能参与HGSOC的发生发展过程。PXR、MDR1、CYP3A5和CYP2B6的表达水平可用于判断HGSOC对化疗药物的敏感性,有助于为术后化疗提供指导意见。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛市市立医院科学伦理委员会的审核批准(文件号2022临审字第093号)。所有试验过程均遵照《青岛市市立医院中心实验室守则》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:张萍、马岚和陈桦参与了研究设计;张萍、陈桦参与了论文的写作和修改。所有作者均阅读并同意发表该论文。所有作者均声明不存在利益冲突。

