主动脉瓣膜间质细胞焦亡在钙化性主动脉瓣疾病中的作用
宗丽娟 杜占慧 游福蓉 王勤拯 张成 邢泉生
(青岛大学附属妇女儿童医院,山东 青岛 266034 1 心脏中心;2 普外科)
随着我国人民生活水平的提高以及人口老龄化程度的日益加剧,退行性钙化性主动脉瓣疾病(calcific aortic valve disease,CAVD)在心脏瓣膜疾病中所占比例逐年上升,已成为临床主动脉瓣置换的最主要病因[1-2]。CAVD以瓣膜发生纤维化和钙化为特征,导致瓣叶增厚及启闭功能受限,最终造成以心脏左室流出道梗阻为特征的心脏功能损害[3-4]。目前CAVD的治疗方法包括药物治疗和经外科手术或经皮介入的主动脉瓣膜置换术[5]。其中药物治疗仅可缓解症状,无法控制疾病进展;而瓣膜置换术治疗成本较高,术后人工瓣膜带来的抗凝风险、瓣膜衰败等问题仍困扰临床[6]。因此研究CAVD的发生机制,确定导致CAVD进展的分子调控途径,寻找潜在治疗靶点,将为CAVD的治疗提供新策略。
近年研究表明,CAVD是一种多细胞、多信号通路参与主动调控的疾病[7],其中作为主动脉瓣膜主体细胞的主动脉瓣膜间质细胞(AVICs),其炎性反应、成骨样转化、细胞死亡以及钙盐沉积等过程在CAVD的发生发展中发挥关键作用[8-12]。细胞焦亡是一种由焦亡蛋白Gasdermin家族介导的程序性细胞死亡方式,是机体的一种固有免疫反应,它既可以引起细胞的程序性死亡,同时又可导致周围组织的炎症反应。现已证实,细胞焦亡参与了多种疾病的发生发展[13-16],并与老年退行性疾病如老年性耳聋、阿尔茨海默病等发病密切相关[17],但与CAVD的发生是否相关至今尚未见报道。本研究通过体外培养AVICs并构建其钙化模型,旨在探讨细胞焦亡在CAVD中的作用。
1 材料与方法
1.1 主要试剂
杜尔贝克改良伊格尔(DMEM)培养基、胎牛血清购自美国Gibco公司,波形蛋白(Vimentin)、α-肌动蛋白(α-SMA)、Alexa Fluor 488标记羊抗兔IgG抗体购自英国Abcam公司,血小板-内皮细胞黏附分子(CD31)抗体购自美国ABclonal公司,Runt相关转录因子2(RunX2)、骨桥蛋白(OPN)、含Pyrin结构域NOD样受体家族3(NLRP3)、焦亡素D蛋白(GSDMD)、半胱氨酸蛋白酶1(Caspase-1)、白细胞介素-1β(IL-1β)和IL-18购买于美国Proteintech公司,GSDMD-N和Cleaved-Caspase-1抗体购自美国CST公司,Ⅱ型胶原酶、β-磷酸甘油钠、地塞米松、抗坏血酸及茜素红染料购买于北京索莱宝有限公司,Caspase-1抑制剂VX-765购自美国MCE公司,细胞计数试剂盒(CCK-8)购自武汉三鹰生物技术有限公司。
1.2 AVICs的培养和鉴定
术中摘取主动脉瓣重度反流患者的主动脉瓣瓣叶后,立即放置于4 ℃的磷酸缓冲盐溶液(PBS)中,转运至实验室。在无菌超净台中使用PBS清洗3次,无菌棉签轻柔擦拭刮除瓣膜表面内皮细胞,使用眼科剪将瓣叶剪成约1 mm×1 mm大小的组织块,置于PBS溶液配制的2 g/L的Ⅱ型胶原酶溶液中于37 ℃下消化6~7 h。将上述溶液1 000 r/min离心5 min,弃上清液,加入标准培养基[含体积分数0.12胎牛血清及100 kU/L青霉素/链霉素(1∶1)的DMEM培养基],在37 ℃、含体积分数0.05的CO2培养箱中培养至细胞融合度约达90%时进行传代。用细胞免疫荧光法检测细胞的间质细胞标志蛋白Vimentin、α-SMA及内皮细胞标志蛋白CD31以鉴定AVICs,使用荧光显微镜采集图像。经过AVICs鉴定明确的第3~6代细胞可以用于后续的实验。
1.3 VX-765溶液有效浓度的筛选
为筛选VX-765有效干预浓度,利用CCK-8实验检测VX-765对AVICs的细胞毒性。将处于对数生长期的AVICs接种于96孔板中,待细胞生长24 h且完全贴壁后,分别加入含有不同浓度(0、1、2.5、5、10、20、40、60、80 μmol/L)的VX-765标准培养基,每种浓度设置6个复孔。将孔板置于37 ℃、含体积分数0.05的CO2培养箱中培养24 h以后每孔加入CCK-8溶液10 μL,将孔板在培养箱中孵育2 h以后,使用酶标仪测量各浓度组细胞在450 nm波长处的吸光度(A)值,计算细胞存活率。细胞存活率=[(A实验孔-A空白孔)/(A对照孔-A空白孔)]×100%,选择干预药物的最佳浓度用于后续实验。
1.4 分组及处理
将传代细胞按照每孔约1.2×106个接种于6孔板中,培养24 h后。依据处理方式不同将细胞分为3组,对照组以标准DMEM 培养基培养14 d,钙化组以钙化培养基(含10 mmol/L β-磷酸甘油钠+100 nmol/L地塞米松+50 mg/L抗坏血酸的标准DMEM培养基)培养14 d,而抑制剂组则使用含10 μmol/L VX-765的DMEM培养基预处理24 h后转入钙化培养基继续培养14 d。
1.5 AVICs中钙结节表达水平检测
将各组细胞弃培养基,用40 g/L多聚甲醛溶液固定,经去离子水清洗以后加入茜素红染液,染色5 min后弃去染液,去离子水洗涤终止反应,普通光学显微镜下观察钙盐沉积情况。
1.6 AVICs中钙化、焦亡相关蛋白及炎症因子表达水平检测
将培养好的细胞接种于6孔板,待AVICs细胞融合度约达50%时,按1.4步骤处理细胞14 d,收集AVICs细胞并提取细胞中总蛋白,加入5×loading buffer,并置于水中煮沸15 min进行变性,保存于-80 ℃环境下。按照SDS-PAGE凝胶配置说明书配制分离胶和浓缩胶,加15 μg蛋白样品至凝胶孔中进行SDS-PAGE蛋白电泳,PVDF转膜之后以50 g/L脱脂奶粉室温封闭2 h。根据目的蛋白分子量裁剪PVDF膜条带,并分别加入钙化相关蛋白OPN、RunX2,细胞焦亡相关蛋白NLRP3、GSDMD、Caspase-1、GSDMD-N、Cleaved-Caspase-1,炎症因子IL-1β、IL-18以及内参β-actin单克隆抗体,4 ℃孵育过夜。以β-actin作为内参照,TBST洗3次,每次10 min,加入二抗并室温孵育1 h,TBST洗膜3次,每次10 min,最后加入ECL化学发光液显影并拍照。使用Image J 7.0软件分析上述蛋白条带灰度值,目标蛋白相对表达量以目标蛋白灰度值/β-actin蛋白灰度值计算。实验设置6个复孔,重复测量3次,结果取均值。
2 结 果
2.1 AVICs细胞表型鉴定
免疫荧光染色鉴定AVICs细胞表型,结果显示近乎所有细胞均可见间质细胞标志蛋白Vimentin及α-SMA表达,未见内皮细胞标志蛋白CD31表达(图1),说明分离培养的AVICs纯度理想,无明显内皮细胞污染,可以用于后续实验。
2.2 AVICs体外钙化模型的建立
茜素红染色结果显示,钙化组细胞呈现橙色着色,对照组细胞无明显阳性着色(图2)。蛋白免疫印迹检测结果显示,钙化组与对照组当中钙化相关蛋白OPN的相对表达量分别为1.28±0.16、0.32±0.03,RunX2的相对表达量则分别为2.27±0.15、0.39±0.02,钙化组中钙化相关蛋白OPN及RunX2的相对表达量均显著高于对照组(t=6.568、12.204,P<0.01)。见图3。
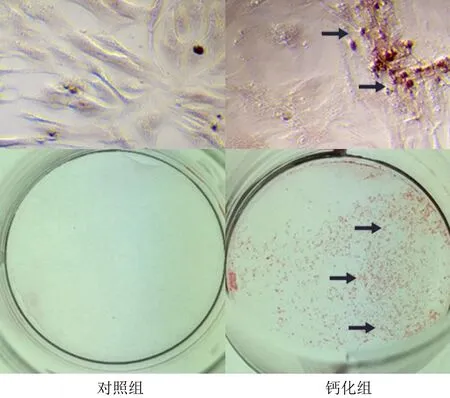
箭头所指区域为钙化结节
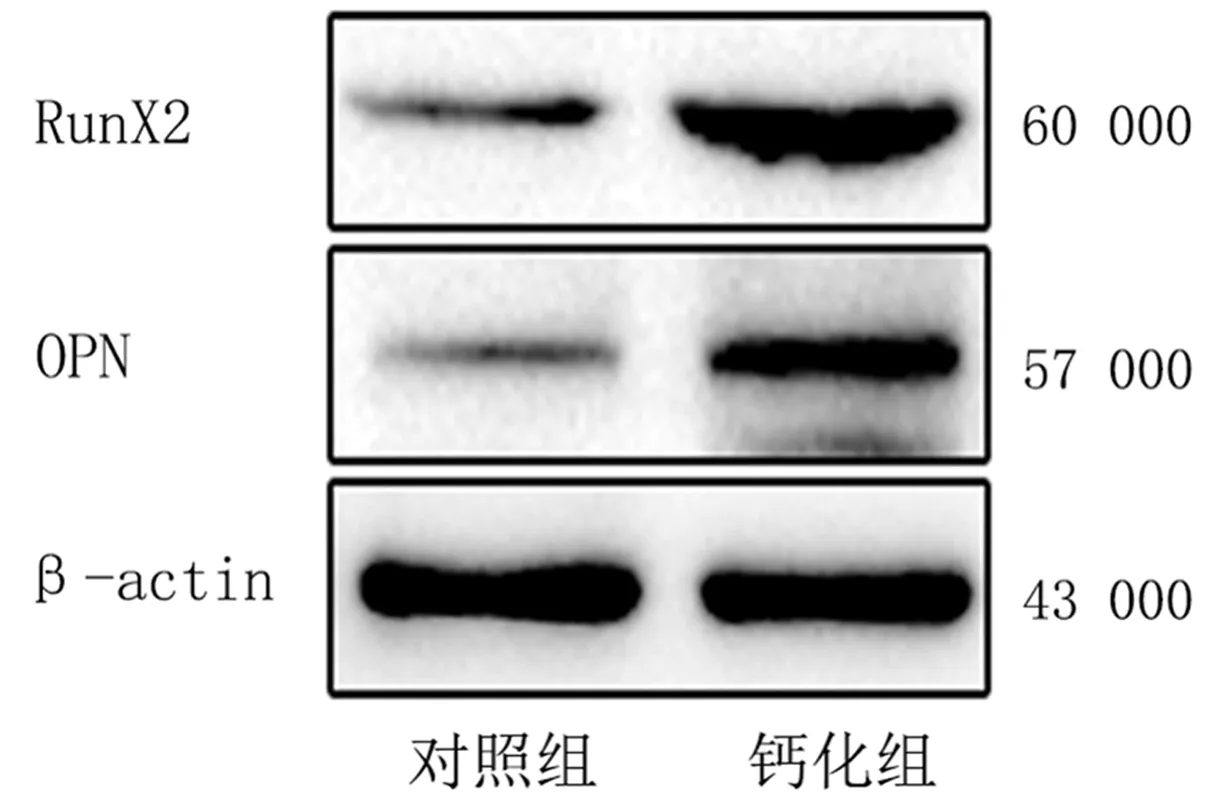
图3 对照组和钙化组AVICs中钙化相关蛋白表达水平
2.3 对照组和钙化组中AVICs焦亡相关蛋白表达水平比较
免疫印迹法检测结果显示,钙化组焦亡相关蛋白NLRP3、GSDMD、Caspase-1、GSDMD-N以及Cleaved-Caspase-1相对表达量显著高于对照组(t=4.586~15.842,P<0.01)。见图4、表1。
表1 对照组和钙化组AVICs焦亡相关蛋白的表达水平比较
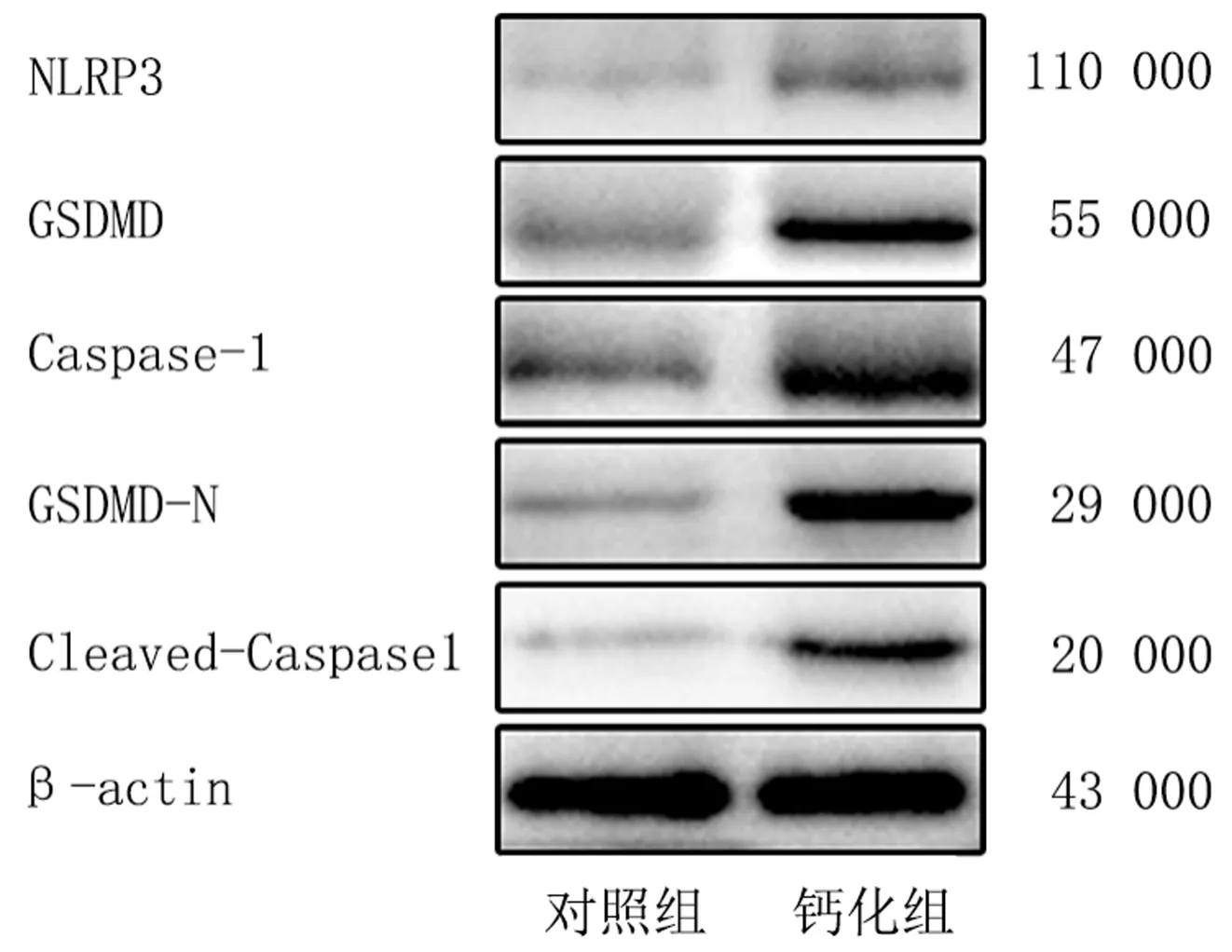
图4 对照组和钙化组AVICs焦亡相关蛋白表达水平
2.4 VX-765干预AVICs最佳浓度确定
CCK-8法检测结果显示,在VX-765浓度为0、1、2.5、5、10、20、40、60、80 μmol/L的标准培养基中,AVICs的存活率分别为(92.407±3.431)%、(95.725±1.203)%、(99.642±1.877)%、(100.750±6.751)%、(101.975±7.023)%、(87.975±1.141)%、(88.742±1.553)%、(83.650±1.648)%、(72.817±5.514)%,与浓度为10 μmol/L相比,当VX-765浓度为20、40、60、80 μmol/L时AVICs的存活率均显著降低(t=2.200~5.631,P<0.05),因此后续实验中抑制剂组均采用含10 μmol/L VX-765的标准培养基预处理AVICs 24 h后,再进行后续钙化培养基培养。
2.5 钙化组与抑制剂组中AVICs钙化、焦亡相关蛋白及炎性因子表达水平比较
茜素红染色结果显示,与钙化组相比,抑制剂组橙红色颗粒减少,钙化结节消退(图5)。免疫印迹法结果显示,抑制剂组OPN、RunX2、NLRP3、GSDMD、Caspase-1、GSDMD-N、Cleaved-Caspase-1以及IL-1β、IL-18的相对表达量均显著性低于钙化组(t=5.799~19.236,P<0.01)。见图6、表2。
表2 钙化组与抑制剂组AVICs钙化、焦亡相关蛋白及炎性因子表达水平比较

箭头所指区域为钙化结节
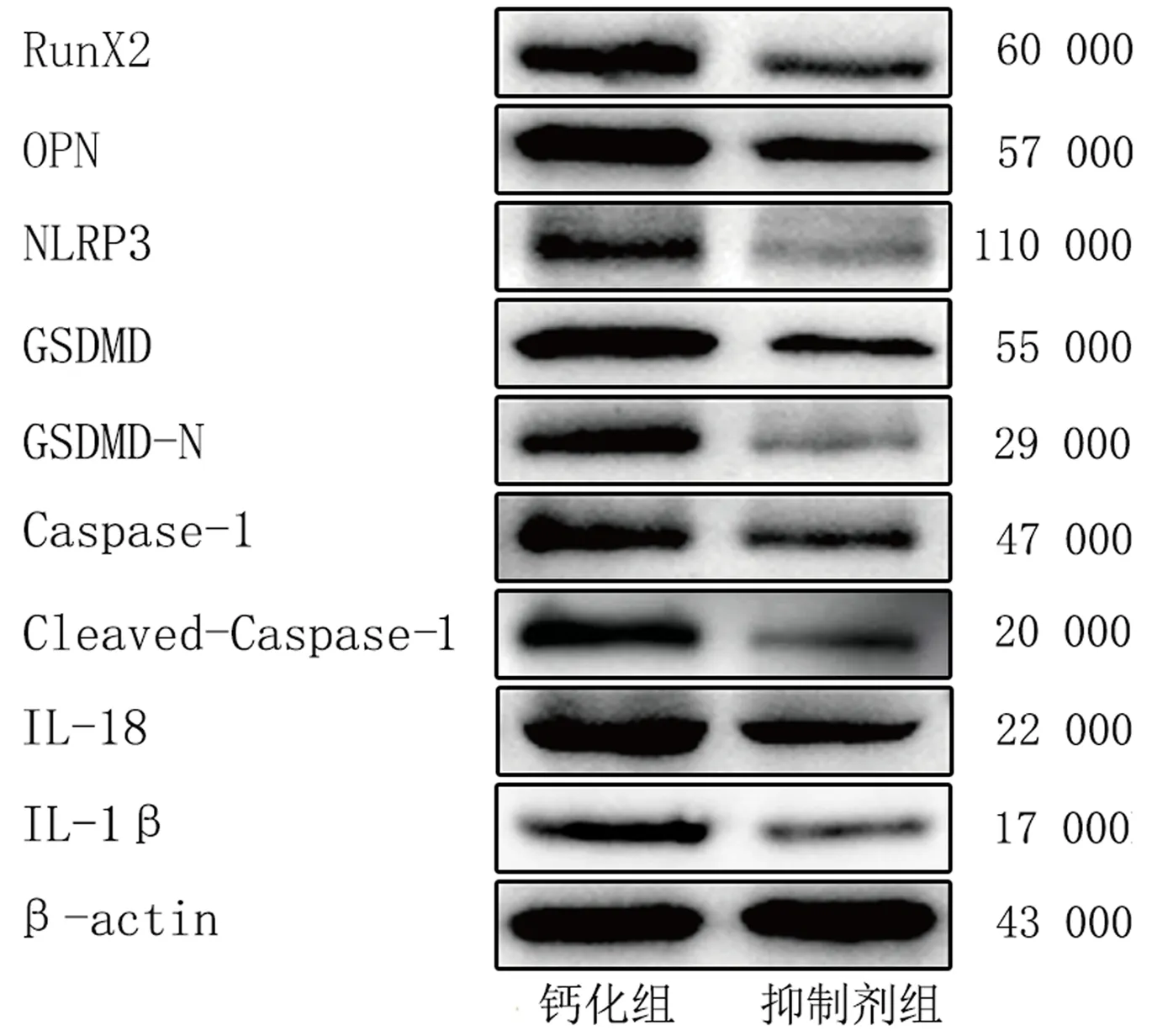
图6 钙化组与抑制剂组AVICs钙化、焦亡相关蛋白及炎症因子表达水平
3 讨 论
近年来,CAVD的发病率在老年人群中呈增长趋势,随着瓣膜病变程度加重,该病逐渐破坏老年患者血流动力学稳定性,发展至后期极易危及患者生命。虽然已经有大量关于CAVD的病因学及病理生理学方面的研究,但是CAVD的主要发病机制依然不明确。CAVD涉及到主动脉瓣瓣叶进行性增厚、基质重塑以及钙盐沉积等过程,上述过程导致瓣叶严重钙化、结构和功能减退,最终发生主动脉瓣严重狭窄和(或)关闭不全[18]。AVICs是主动脉瓣的主要组成成分之一,且AVICs向成骨样细胞分化的过程在CAVD疾病发展中起主要作用,这也是目前探讨CAVD发生机制的主要研究方向。多项研究表明,CAVD中主动脉瓣钙化早期病变与血管钙化相似,是一个异位钙化的过程,其中成骨细胞激活与间质细胞死亡同时存在。细胞焦亡属于细胞程序性坏死的一种,在动脉粥样硬化、血管钙化等多种心血管疾病进程中发挥重要作用[19],但CAVD中是否存在细胞焦亡及其相关机制目前尚未有研究报道。
本研究使用钙化培养基,建立AVICs体外钙化模型并进行验证。结果显示经过钙化培养基诱导的AVICs呈聚集样生长,茜素红染色呈现橙色着色,证明AVICs中存在钙盐沉积。免疫印迹法检测发现,钙化相关蛋白OPN和RunX2表达增多,提示AVICs向成骨样细胞分化。在此模型上,本研究进行了细胞焦亡的相关检测。细胞焦亡是由GSDMD介导的一种新型程序性炎症性细胞死亡模式,其特征是细胞肿胀变大,膜上孔洞形成及炎症因子等细胞内容物的释放。根据活化蛋白不同,细胞焦亡分为依赖Caspase-1的经典途径和依赖Caspase-4/5/11的非经典途径,目前经典激活途径研究较多[20]。在经典途径细胞焦亡中,Caspase-1作为焦亡的效应分子,通常以pro-Caspase-1的形式存在于细胞中,在各种损伤因素的刺激下,NLRP3等炎症小体被激活,并将pro-Caspase-1裂解成Caspase-1,活化的Caspase-1随后将GSDMD裂解为GSDMD-N,释放出的GSDMD-N在细胞膜上形成孔洞,进而促进炎性因子的释放和细胞肿胀,激活细胞焦亡[21]。细胞焦亡在机体内是一个动态过程,往往难以观测,目前活化的Caspase-1和GSDMD-N已被公认为细胞焦亡发生的标志物,通过检测这些指标的水平可以确定细胞焦亡的发生情况。本研究中AVICs经钙化培养基诱导以后,焦亡相关蛋白NLPR3、GSDMD、Caspase-1、GSDMD-N、Cleaved-Caspase-1等表达升高,表明AVICs向成骨样细胞改变的过程中存在细胞焦亡发生。
为进一步明确细胞焦亡在AVICs成骨样改变中的作用,本研究使用VX-765抑制焦亡效应分子Caspase-1的活性。VX-765是一种具有口服生物活性的Caspase-1抑制剂,现已被应用于银屑病和癫痫患者的Ⅱ期临床试验。本研究使用VX-765干预钙化培养基诱导的AVICs,通过CCK-8法确定VX-765的干预时间及浓度。实验结果显示,VX-765干预减少了细胞内钙结节的形成,且VX-765抑制剂组中的钙化相关蛋白OPN、RunX2,焦亡相关蛋白NLPR3、GSDMD、Caspase-1、GSDMD-N、Cleaved-Caspase-1及炎症因子IL-18、IL-1β的相对表达量均显著降低,上述结果提示VX-765能够减少细胞焦亡的发生,抑制AVICs向成骨样细胞分化。
细胞焦亡在本质上是一种炎症过程,而炎症在CAVD进展过程中发挥重要作用[22]。多项研究表明,慢性炎症反应贯穿瓣膜钙化的全过程,炎症信号通路的激活、炎性因子的表达和释放在AVICs向成骨样细胞分化中扮演重要角色[18,23]。在细胞焦亡中,NLPR3/Caspase-1通路的激活是焦亡的关键过程。已有研究表明,炎小体在多种衰老相关的疾病中发挥关键作用,可以作为心血管疾病治疗的重要靶点[24]。有研究发现,咖啡酸苯乙酯可以通过抑制Akt/NF-κB通路和NLPR3炎症小体的激活来减少条件培养基诱导下AVICs钙化结节的形成[25]。根据本研究结果,我们推测VX-765可能通过靶向抑制Caspase-1来减少细胞焦亡的发生,从而减轻炎症反应,延缓AVICs的成骨样分化。
综上所述,本研究结果表明在AVICs钙化及成骨样分化过程中存在细胞焦亡,应用VX-765干预后可有效缓解钙化培养基诱导下AVICs钙化结节的形成,其机制可能为VX-765干扰细胞焦亡中炎症小体形成,减少AVICs成骨样分化。因此,进一步研究细胞焦亡在CAVD中的作用机制将为临床防治CAVD提供新的作用靶点和治疗策略。
伦理批准和知情同意:本研究涉及的所有试验均已通过青岛大学附属妇女儿童医院医学伦理委员会的审核批准(文件号QFELL-YJ-2020-80)。所有试验过程均遵照《赫尔辛基人体研究伦理准则宣言》的条例进行。受试对象或其亲属已经签署知情同意书。
作者声明:宗丽娟、邢泉生、杜占慧、游福蓉、王勤拯参与了研究设计;宗丽娟、杜占慧、邢泉生、张成参与了论文的写作和修改。所有作者均阅读并同意发表该论文。所有作者均声明不存在利益冲突。

