基于免疫细胞组织浸润的免疫评分模型预测前列腺癌免疫治疗效果及预后分析研究
孙 飞,黎春明(海口市第三人民医院泌尿外科,海口 571100)
前列腺癌(prostate cancer,PCa)是全球男性中最常见的侵袭性恶性肿瘤之一,也是第二大致死性异质性癌症[1]。在我国,随着人口老龄化和诊断技术的提高,近年来前列腺癌的发病率明显上升,并逐渐呈现年轻化趋势。前列腺癌的病因尚不明确,其发生发展机制是一个涉及多种因素的复杂过程,包括吸烟、肥胖、种族、食物、年龄、化学和辐射暴露、性传播疾病等[2]。目前,前列腺癌的治疗包括手术切除、放化疗、内分泌治疗和免疫治疗,根治性前列腺切除术被认为是局限性前列腺癌的主要治疗方法[3]。然而,大约20%的前列腺癌患者会发生生化复发,前列腺特异性抗体的血清水平迅速升高,最终发展为去势抵抗性前列腺癌[4],这也是前列腺癌肿瘤特异性死亡的主要原因。最近,越来越多的证据表明免疫系统在肿瘤的发生和进展中起着关键作用,如免疫微环境和免疫细胞(巨噬细胞、中性粒细胞、T 细胞、NK 细胞)。肿瘤浸润免疫细胞(tumor infiltrating immune cells,TIICs)是肿瘤微环境的重要组成部分,可以改变肿瘤的免疫状态[5]。一些研究已经通过靶向TIICs 证明了针对肿瘤的治疗策略,其中涉及前列腺癌和TIICs 的临床结果和潜在机制也已被广泛报道[6],但通过分析免疫细胞浸润的免疫评分模型对前列腺癌患者免疫治疗效果及预后的预测研究较少。因此,本文基于免疫细胞浸润的免疫评分模型,对前列腺癌免疫治疗的效果和预后展开分析。
1 材料与方法
1.1 研究对象 从癌症基因组图谱 (the cancer genome atlas,TCGA) 选取266 个前列腺癌患者的基因表达谱和临床随访参数,并对整个相关候选数据集进行识别和评估。患者年龄51~79(65.23 ± 6.98)岁。
数据集的纳入标准:①癌症手术切缘阴性的样本;②每个数据集包含的标本超过60 个;③包括临床病理特征(临床分期、前列腺特异性抗原和结果)。排除标准:①数据库缺乏有效和足够的样本数据;②先前合格数据库的副本;③除手术切除外还进行放疗或化疗的患者。
1.2 方法
1.2.1 筛选肿瘤浸润免疫细胞:利用TCGA 基因表达谱数据,通过单样本基因集富集分析(single-sample gene set enrichment analysis,ssGSEA)量化免疫细胞并得到相关免疫细胞在肿瘤组织中的浸润情况。ssGSEA 根据基因在样本中的绝对表达对基因进行排序,并通过整合基因排序的经验累积分布函数之间的差异来计算富集分数[7-8]。进而表示特定基因集中的基因在单个样本中协调上调或下调的程度。
1.2.2 通过 LASSO 分析筛选关键预测因子:为了估计癌症基因组图谱(the cancer genome atlas,TCGA)数据库中生存率与免疫细胞浸润之间的关系,利用“Glmnet”包的套索方法(least absolute shrinkage and selection operator,LASSO)进行下一步筛选,使用“survival”和“survminer”包对关键预测因子进行生存分析,以验证不同TIICs 是否与预后相关。
1.2.3 风险评分模型的构建和验证:将符合条件的因子构建预后风险评分模型,每个患者的风险评分是通过回归系数(β)加权后得出的。通过数据库的中值风险评分作为阈值,将前列腺癌患者分为高风险组和低风险组。接着使用“survminer”包进行最佳分离统计,根据最佳分离将基因表达量分为高组和低组,制作Kaplan-Meier 生存曲线。
1.3 统计学分析 基于风险模型建立列线图来预测前列腺癌患者治疗无效(通过ImmuCellAI 算法得到的前列腺癌患者疗效预测结果)和生存的概率;绘制随时间变化的受试者工作特征 (receiver operating characteristic curve,ROC) 曲线,并计算ROC 曲线下的面积(area under the curve,AUC),以验证列线图的准确度;利用校准曲线比较基于TIICs 列线图的预测和观察结果,其中 45°线代表最佳预测;采用临床决策曲线分析法判断模型的预测可靠程度。
2 结果
2.1 前列腺组织免疫细胞分布情况以及预测因子的筛选 使用ssGSEA 量化免疫细胞浸润数据,最后得到22 个TIICs 包括:幼稚B 细胞、记忆B 细胞、浆细胞、CD8+ T 细胞、幼稚CD4+ T 细胞、静息记忆CD4+ T 细胞、激活记忆 CD4+ T 细胞、滤泡辅助性T 细胞、调节性T 细胞(Treg 细胞)、γδ T 细胞、静息NK 细胞、活化NK 细胞、单核细胞、M0 巨噬细胞、M1 巨噬细胞、M2 巨噬细胞、静息树突细胞、活化树突细胞、静息肥大细胞、活化的肥大细胞、嗜酸性粒细胞和嗜中性粒细胞。利用 LASSO 对以上22 个TIICs 进行下一步筛选,采用交叉验证法估计调整参数λ,最终选择6 个免疫细胞作为预测因子,分别为Treg细胞、M1巨噬细胞、M2 巨噬细胞、激活记忆CD4+ T 细胞、静息树突细胞和嗜中性粒细胞。
2.2 基于免疫细胞浸润的IRS 模型以及模型的评价 根据六个TIICs,计算样本的风险评分并根据个体预后风险评分以中位数为临界值分为低风险组和高风险组,见图1A;前列腺癌患者在治疗后的生存状况被标记为点图,见图1B,随着风险评分的升高,高风险组前列腺癌患者增多,预后不良人数增多;图1C 中还详细列出了高风险和低风险患者之间6 个TIICs 的热图。利用Kaplan-Meier 法绘制生存曲线,结果显示高风险患者中位总生存时间(3.8年)显著低于低风险组(6.9年)(Log-Rankχ2=4.259,P<0.001),见图2。

图1 患者的风险评分分布(A)、患者的生存状态(B)以及6 种TIICs 与风险分组相关性热图(C)

图2 风险评分分组的生存曲线分析
2.3 预后列线图模型的构建及验证 基于上述对6种TIICs 分析结果构建列线图预测模型,结果见图3。Treg 细胞86 分、M1 巨噬细胞76 分、M2 巨噬细胞55 分、激活记忆CD4+ T 细胞96 分、静息树突细胞49 分、嗜中性粒细胞68 分,总分430 分,对应死亡风险为74.69%。通过ROC 曲线的绘制对模型区分度进行评价,AUC 为0.769(95%CI:0.648~0.851,P<0.001),C-index 为0.834,大于0.75,模型区分度较高,见图4A;对预测模型的校准曲线进行检验:χ2=7.025,P=0.742,见图4B;通过绘制临床决策曲线可以看出,预测模型距极端曲线较远,当阈概率在12%~95%时使用列线图模型预测预后情况的净获益率较高,由此可见模型安全可靠,实用性强,见图4C。
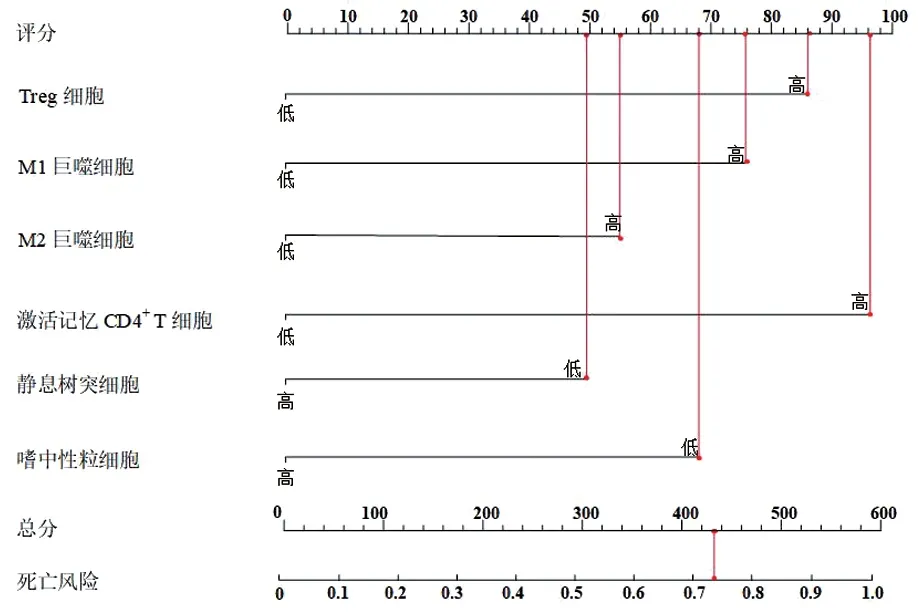
图3 基于TIICs 的预后列线图模型
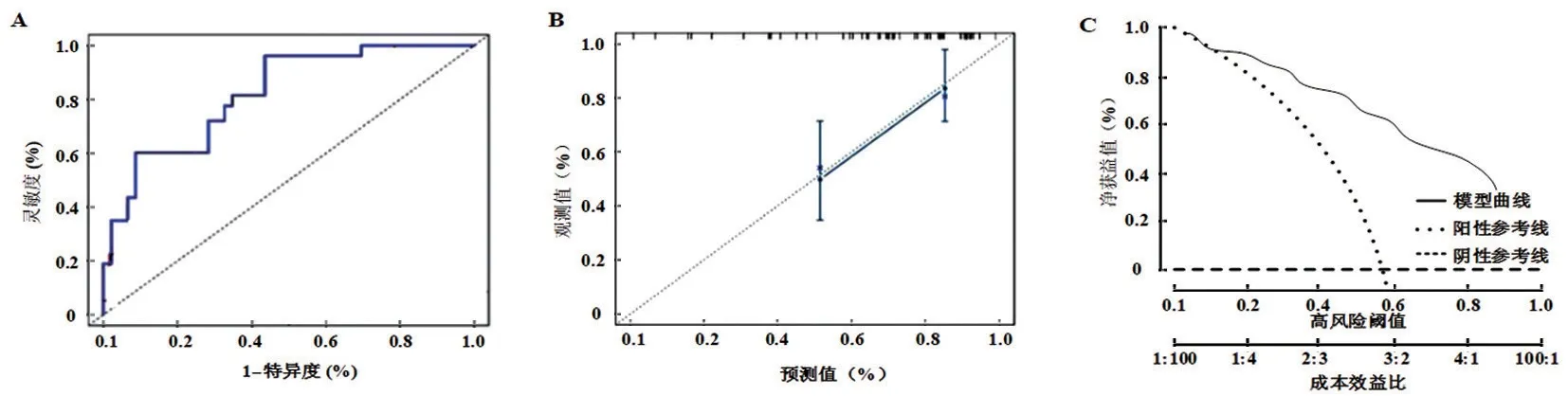
图4 预测模型验证
2.4 治疗效果列线图模型的构建及验证 采用ImmuCellAI 算法预测前列腺癌患者的治疗疗效,并将患者分为有效组和无效组,从图5A 可以看出,有效组患者主要集中在预后不良的高风险组(风险评分>0),而无效组患者大多集中在低风险组(风险评分<0),由此证明IRS 免疫评分模型可作为前列腺癌患者治疗效果的预测工具。此外,绘制了基于IRS 免疫评分模型预测前列腺癌患者治疗效果的列线图模型(图5B),Treg 细胞82 分、M1 巨噬细胞84 分、M2 巨噬细胞63 分、激活记忆CD4+ T 细胞97 分、静息树突细胞52 分、嗜中性粒细胞45 分,总分423 分,对应治疗无效的风险为73.21%。通过ROC 曲线的绘制对模型区分度进行评价,AUC 为0.752(95%CI:0.662~0.831,P<0.001),C-index 为0.803,大于0.75,模型区分度较高,见图6A;对预测模型的校准曲线进行检验:χ2=7.541,P=0.762,见图6B;通过绘制临床决策曲线可以看出,预测模型距极端曲线较远,当阈概率在13%~89%时使用列线图模型预测治疗效果的净获益率较高,由此可见模型安全可靠,实用性强,见图6C。

图5 治疗效果列线图模型的构建及验证
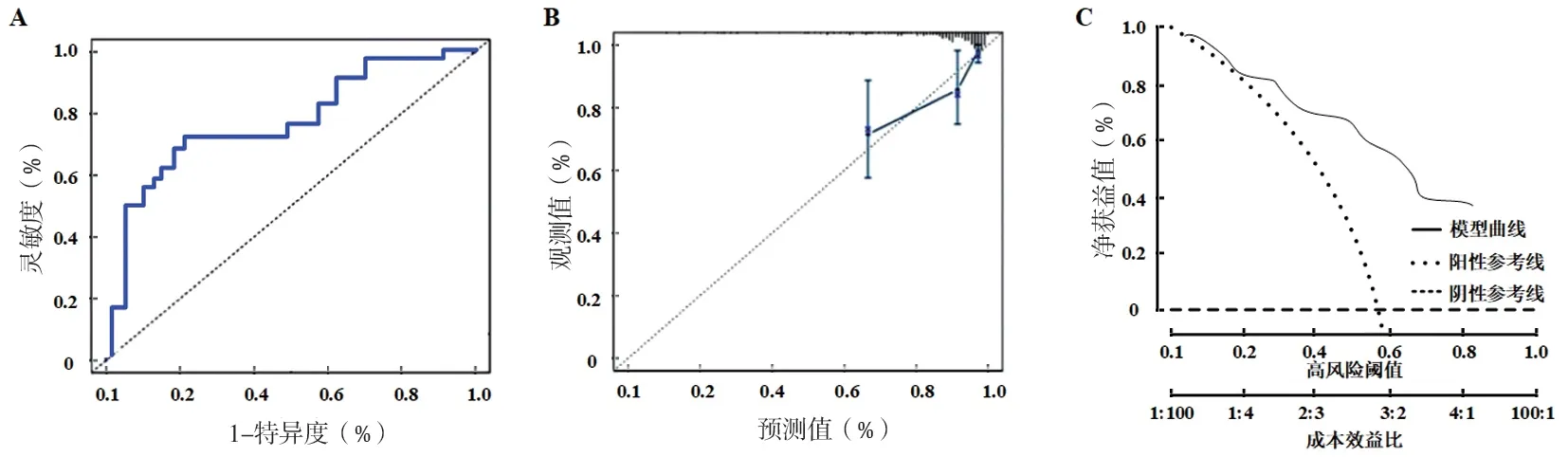
图6 预测模型验证
3 讨论
前列腺癌对全世界男性的健康构成严重威胁,占男性恶性肿瘤的25%[9]。在中国,随着超声引导下前列腺穿刺活检的应用,前列腺癌的发病率急剧上升。与其他肿瘤相比,前列腺癌的进展时间较长,因此5年的生存率高达80%以上[10]。然而,对于晚期前列腺癌,激素剥夺疗法可以通过雄激素受体信号通路暂时抑制肿瘤进展,但有效期只有二年,进而发展为去势抵抗性前列腺癌的阶段[11]。
在前列腺癌上皮中,一些免疫细胞类型(B 细胞、Treg 细胞、M1 和M2 巨噬细胞)有选择性富集,而其他类型(肥大细胞)有选择性消耗,表明TIICs 在前列腺癌进展中具有复杂的生物学作用。ANDERSEN 等[12]人研究发现高水平的浸润性Treg细胞和M1,M2 巨噬细胞是术后复发的显著不良预测因子。以往研究表明[13],Treg 细胞在肿瘤微环境中高度活化,其通过抑制效应细胞活化和增殖的各种机制进而抑制效应细胞,例如T 效应细胞、核细胞、巨噬细胞、自然杀伤细胞和抗原呈递细胞等。还可通过分泌抗炎细胞因子(例如 TGF-β 和IL-10)抑制免疫细胞的活性,从而控制炎症。因此在维持免疫耐受和平衡方面发挥重要作用。MENG等[14]人的研究结果表明,记忆B 细胞、Treg 细胞、M2 巨噬细胞和树突状细胞浸润在高风险评分组中显著增加,而浆细胞、CD8+T 细胞、单核细胞和活化肥大细胞浸润在高风险评分组中低于低风险评分组,与本文研究结果一致。有研究表明,前列腺癌组织中肿瘤相关巨噬细胞中血红素加氧酶-1表达增加可诱导M2 巨噬细胞极化,进而导致前列腺癌细胞侵袭和生长,且M2 巨噬细胞水平高与肿瘤分期高和前列腺癌特异性死亡之间具有显著相关性[15]。除此之外,M2 巨噬细胞还可以帮助建立肿瘤的免疫抑制状态,这可能有助于解释在较高风险评分组中观察到的M2 巨噬细胞浸润增加。相反,肿瘤中 CD8+ T 细胞浸润性的局部增加是预后良好的标志,这可能解释了在预后较好的低风险评分组中观察到的 CD8+ T 细胞浸润增加的原因。这些细胞类型的浸润不仅反映了免疫微环境,还可以对前列腺癌的预后进行预测[16]。
前列腺癌中TIIC 的不同比例与临床结果相关,本文研究发现激活记忆 CD4+ T 细胞浸润在治疗无效和预后不良方面有重要作用。在正常组织中,前列腺相关淋巴组织具有由CD3+ TCRαβ 组成的上皮内白细胞,常见的CD8+和CD4+表型弥漫性穿透上皮。在异常情况下,与正常前列腺组织相比,免疫细胞的含量会发生改变[17]。在小鼠体内冷冻消融模型验证研究中发现,CD8+ T 细胞在治疗后广泛浸润于组织中,有助于肿瘤的根除。相反,CD4+ T 淋巴细胞浸润增加与前列腺癌诊断和前列腺癌特异性生存率差相关[18]。在LIU 等[19]人的研究中发现,与年轻小鼠相比,来自老年小鼠脾脏的CD4+ T 细胞具有增加的 Th17 细胞、Th17 细胞因子和 Th17/Treg 比率。促进了前列腺癌细胞的活力、迁移和侵袭以及前列腺癌的进展。
尽管肿瘤抗原来源于宿主,但它可以被T 细胞识别为靶标。而T 细胞启动需要树突状细胞,它是最有效的抗原呈递细胞。传统的树突状细胞在发展抗肿瘤T 细胞反应中很重要,具有高度的交叉呈现能力,并分泌能够吸引CD8 T 细胞的分子,因此在促进抗原特异性肿瘤细胞杀伤方面有重要作用。在某些肿瘤类型中,树突状细胞肿瘤浸润与更好的临床结果相关。为了逃避免疫监测,肿瘤能够直接抑制肿瘤特异性免疫反应或影响树突状细胞极化、激活、生成和组织浸润。此外,癌症患者循环和浸润性树突状细胞的频率和激活能力通常低于健康个体[20]。因此,本文中静息树突状细胞的低水平浸润增加了预后不良的风险与以往研究结果具有一致性。
大多数前列腺癌相关死亡是由于晚期去势抵抗性疾病的发展,通常会发展为无法治愈的骨转移性前列腺癌[21]。骨微环境中具有丰富的嗜中性粒细胞,对前列腺癌具有细胞毒性并通过靶向STAT5 直接诱导骨转移性前列腺癌细胞凋亡[22]。此外,还发现骨髓中性粒细胞抑制骨微环境中的肿瘤生长,与 T细胞免疫抑制功能无关,对于患有转移性疾病的前列腺癌患者,升高的中性粒细胞与淋巴细胞比率与生存预后不良相关[23]。总之,这些研究揭示了嗜中性粒细胞在骨转移性前列腺癌进展中的作用,并且利用骨中的中性粒细胞细胞毒活性可以为治疗骨转移性前列腺癌提供一种新的免疫治疗策略。
值得注意的是,尽管这项研究已尽可能避免研究中的缺陷,但仍存在一些局限性。这项研究是回顾性的,因此6 个免疫相关细胞预后特征的准确性和有效性需要进一步在相关临床试验或其他一些公共队列中进行验证。
综上所述,本研究基于免疫细胞浸润的免疫评分模型预测了前列腺癌患者的免疫治疗效果和预后,发现通过利用在肿瘤微环境中的免疫细胞的信息,有助于改善早期前列腺癌的风险分层以及治疗后的预后分析。

