基于UPLC-MS/MS建立早产儿血清25-(OH)D3和3-epi-25-(OH)D3检测新方法及临床初步应用
刘 浩,彭 勇,尹一帆,叶 亮,陈 敏,苗静琨
(重庆市妇幼保健院/重庆医科大学附属妇女儿童医院儿科/新生儿筛查中心,重庆 401147)
维生素D(vitamin D,Vit D)是一种脂溶性维生素,不仅具有调节钙磷吸收及保持骨骼健康的作用,近年来还被发现具有促进细胞增殖分化及调节免疫系统的作用[1]。对于早产儿,Vit D 与新生儿呼吸窘迫综合征具有一定相关性,研究发现早产儿血清25-羟维生素D[25-hydroxyvitamin D,25-(OH)D]降低是新生儿呼吸窘迫综合征的独立危险因素之一[2]。因此,准确评估早产儿Vit D 水平具有十分重要的意义。
25-(OH)D 是评估人体Vit D 水平的理想标记物。由于新生儿体内的25-羟维生素D2[25-hydroxyvitamin D2,25-(OH)D2]浓度过低,几乎可以忽略,因此可通过血清25-(OH)D3来衡量其体内Vit D 水平[3]。3-epi-25- 羟维生素D3[3-epi-25-hydroxyvitamin D3,3-epi-25-(OH)D3] 是人体25- 羟维生素D3[25-hydroxyvitamin D3,25-(OH)D3] 的一个代谢产物,其分子式与25-(OH)D3完全相同;从空间结构来看,3-epi-25-(OH)D3是25-(OH)D3的差向异构体,由25-(OH)D3在肝细胞、骨细胞或皮肤细胞中差向异构酶的作用下生成,其结构上的差异表现为其C3 端的羟基发生了空间变化,由α 方向转变为β 方向[4]。3-epi-25-(OH)D3的下游代谢产物为3-epi-1α,3-epi-1α,25- 双羟维生素 D3[3-epi-1α,25-(OH)2D3] 与1α,25- 双羟维生素D3[1α,25-dihydroxyvitamin D3,1α,25-(OH)2D3]相比,其调节血钙的作用明显减弱,与Vit D受体的亲和力同样明显减弱致使基因调节与骨代谢调节作用显著降低,几乎失去生理性功能[5]。因此,评估体内Vit D 水平时需要区分25-(OH)D3与3-epi-25-(OH)D3。
目前,临床上检测血清Vit D 的方法主要包括免疫分析法(简称免疫法)和液相色谱-串联质谱法(简称质谱法)。免疫法因交叉反应无法区分25-(OH)D3与3-epi-25-(OH)D3;而质谱法如果没有经过充分的色谱分离同样不能区分25-(OH)D3与3-epi-25-(OH)D3,两种方法均可造成Vit D 检测发生误差[6]。近年来,虽然应用串联质谱技术检测25-(OH)D 越来越广泛,但多数实验室在检测25-(OH)D3时并没有分离3-epi-25-(OH)D3,无法达到准确评估Vit D 的目的。因此,本研究拟采用超高效液相色谱-串联质谱检测新方法(ultra-performance liquid chromatography-tandem mass spectrometry,UPLCMS/MS)技术,在充分分离3-epi-25-(OH)D3的基础上建立同时准确定量检测血清25-(OH)D3与3-epi-25-(OH)D3的方法,并在早产儿中开展初步应用。
1 材料与方法
1.1 研究对象 收集2021~2022年重庆市妇幼保健院新生儿科住院早产儿血液样本共134 例,其中男性79 例,女性55 例;孕周20~36 周;年龄2~31天;体重820~2 810 g。纳入研究的早产儿均未补充25-(OH)D3制剂。本研究已通过重庆市妇幼保健院伦理委员会审查批准,批号(2022)伦审(科)027 号。
1.2 仪器与试剂 UPLC-MS/MS 仪(美国Waters 公司的UPLC Xevo TQS);纯水仪(美国Millipore 公司的Synergy UV);色谱柱(Shim-pack Velox PFPP,2.1 mm × 100 mm,1.8 μm)(日本岛津公司);25-(OH)D3标准品及其同位素内标d6-25-(OH)D3(上海甄准生物科技有限公司);3-epi-25-(OH)D3标准品及其同位素内标d6-3-epi-25-(OH)D3(加拿大Toronto Research Chemicals 公司);空白基质血清来自华大公司脂溶性维生素试剂盒;色谱级甲醇与异丙醇[霍尼韦尔贸易(上海)有限公司];正己烷(成都市科隆化学品公司)。
1.3 方法
1.3.1 试剂的配制:标准品与内标干粉用甲醇溶解形成高浓度储存液,然后再用甲醇配制为相应浓度的工作液,-80℃保存备用。标准曲线配制:用空白基质溶液,采用倍比稀释法配制8 点标准曲线,25-(OH)D3标准曲线的浓度分别为3.75,7.50,15.00,30.00,60.00,120.00,240.00 和480.00 nmol/L;3-epi-25-(OH)D3标准曲线的浓度分别为1.00,2.00,4.00,8.00,16.00,32.00,64.00 和128.00 nmol/L。内标沉淀剂为甲醇与异丙醇以8∶2 的比例配制,d6-25-(OH)D3与d6-epi-25-(OH)D3的浓度均为25.00 nmol/L。质控品配制:用空白基质溶液配制低、中、高三个浓度的质控品,25-(OH)D3为5.00,50.00与200.00 nmol/L;3-epi-25-(OH)D3为1.25,5.00 与20.0 0nmol/L。
1.3.2 样品前处理:取100 μl血清于1.5 ml EP管中,加入200 μl 内标沉淀剂,旋涡震荡3 min 后加入1 ml 正己烷,再旋涡震荡3 min,然后19 000×g 4℃离心5 min,取上清,室温下氮气吹干,加入80 μl 50%(v/v)甲醇水复溶液,混匀后上机检测。
1.3.3 色谱及质谱条件:流动相A 为0.1%(v/v)甲酸水,B 相为0.1%(v/v)甲酸-甲醇。梯度洗脱条件:0~0.5min 为50%(v/v)B 相,0.5~7.5min由50% 均速升高至98%B 相,7.5~7.51min 为50%B 相,保持98%B 相至8min,流速0.4 ml/min。柱温温度为45℃,进样量10 μl。采用大气压化学电离正离子(atmospheric pressure chemical ionization positive mode,APCI+)模式进行电离,多反应监测(multiple reaction monitoring,MRM)模式进行采集,离子源电压550 V,离子源温度150℃。各种化合物的其他质谱参数见表1。
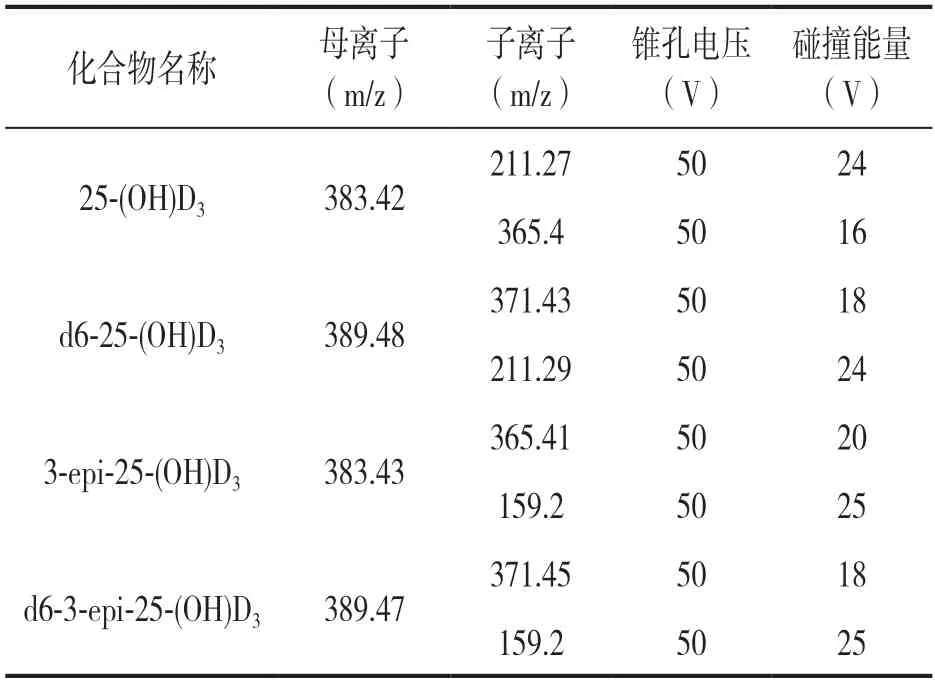
表1 待测化合物的相关质谱参数
1.3.4 方法学验证:建立的UPLC-MS/MS 检测法分别从最低定量限(lower limit of quantification,LLOQ)、线性关系、精密度与准确度等四个方面进行验证。最低定量限的信噪比大于10 且变异系数(coefficienct of variation,CV)≤20.00%为满足要求;线性关系以相关系数r2≥0.99 为满足要求;精密度以相对标准差(relative standard deviation,RSD)<15.00%为满足要求;准确度以回收率在±15.00%以内为满足要求[7]。
1.3.5 早产儿血清25-(OH)D3与3-epi-25-(OH)D3检测:早产儿于住院期间采集约1 ml 静脉血,样本离心后(2 000 r/min)分离血清,-80 ℃保存。采用新建方法检测早产儿血清25-(OH)D3与3-epi-25-(OH)D3;总25-(OH)D3浓度为25-(OH)D3与3-epi-25-(OH)D3浓度之和。参照《2016年全球营养性佝偻病管理共识》及《2021 中国儿童维生素A、维生素D 临床应用专家共识》提出的儿童Vit D 应用状况判断标准,本研究以血清25-(OH)D3浓度小于30.00 nmol/L 为缺乏;30.00~50.00 nmol/L 为不足;大于50.00 nmol/L 为适宜[8-9]。
1.4 统计学分析 采用Excel 软件与SPSS11.0 统计软件,计量资料采用均数 ± 标准差(±s)表示;率的比较采用两组率比较的卡方检验,P<0.05 为差异具有统计学意义。
2 结果
2.1 25 -(OH)D3与3-epi-25-(OH)D3的色谱图 见图1。25-(OH)D3,3-epi-25-(OH)D3及同位素内标的保留时间为5.34 min 和5.44 min,总分析时间8.0 min。25-(OH)D3与d6-25-(OH)D3的定量离子对为383.41>211.27 与389.48>371.43;3-epi-25-(OH)D3与d6-3-epi-25-(OH)D3的定量离子为383.43>365.41与389.47>371.45。
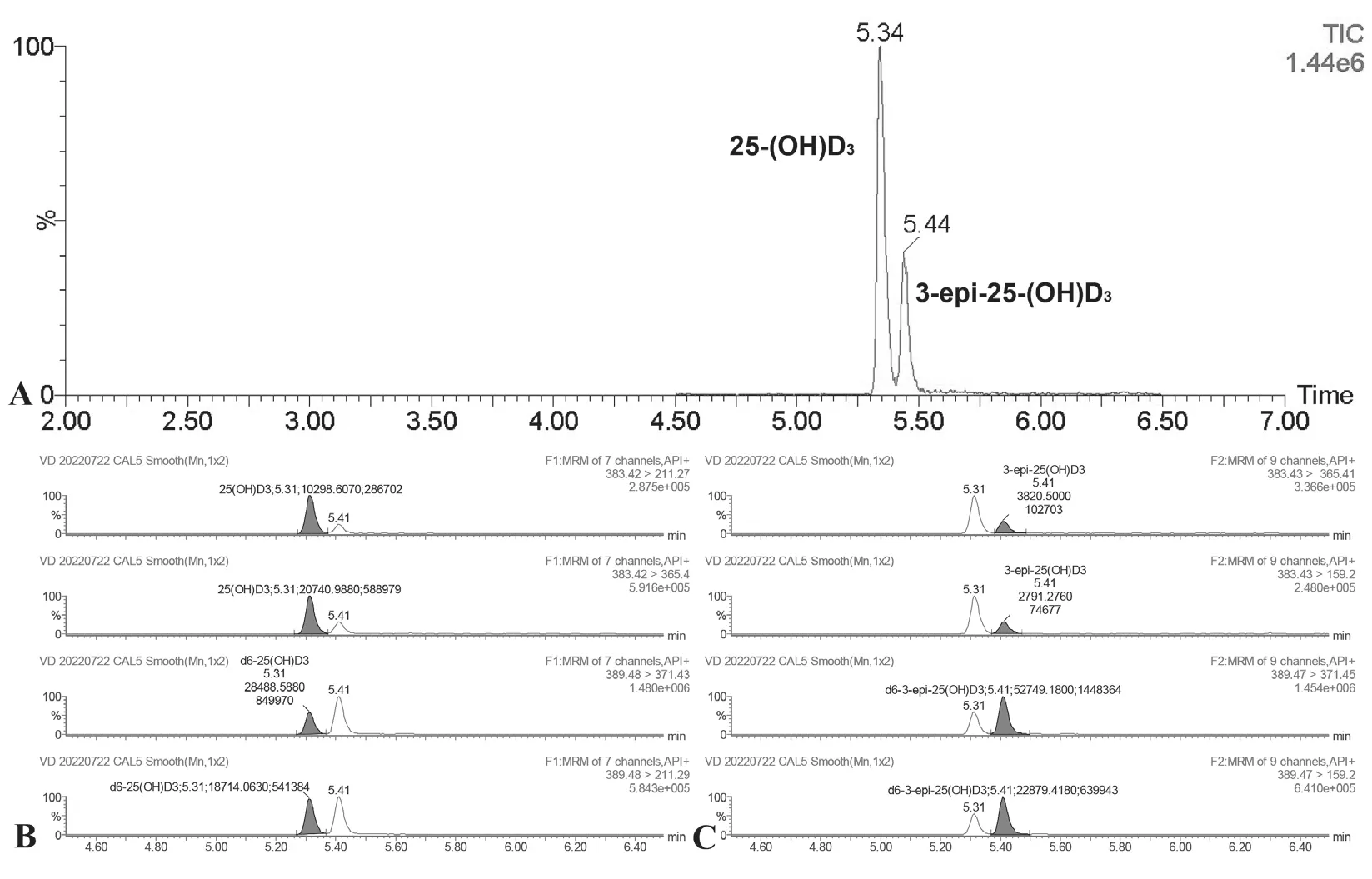
图1 25-(OH)D3,3-epi-25-(OH)D3 及其同位素内标的色谱图
2.2 方法学验证
2.2.1 LLOQ 及线性关系:25-(OH)D3与3-epi-25-(OH)D3的LLOQ 见表2。25-(OH)D3线性范围3.75~480.00 nmol/L,相关系数r2=0.991 1;3-epi-25-(OH)D3的线性范围1.00~128.00 nmol/L,相关系数r2=0.992 8。

表2 25-OH D3 与3-epi-25-(OH)D3 的最低定量限
2.2.2 日内精密度与日间精密度:见表3。25-(OH)D3低、中、高三个浓度质控品的日内及日间精密度均小于15.00%;3-epi-25-(OH)D3低、中、高三个浓度质控品的日内及日间精密度同样均小于15.00%。
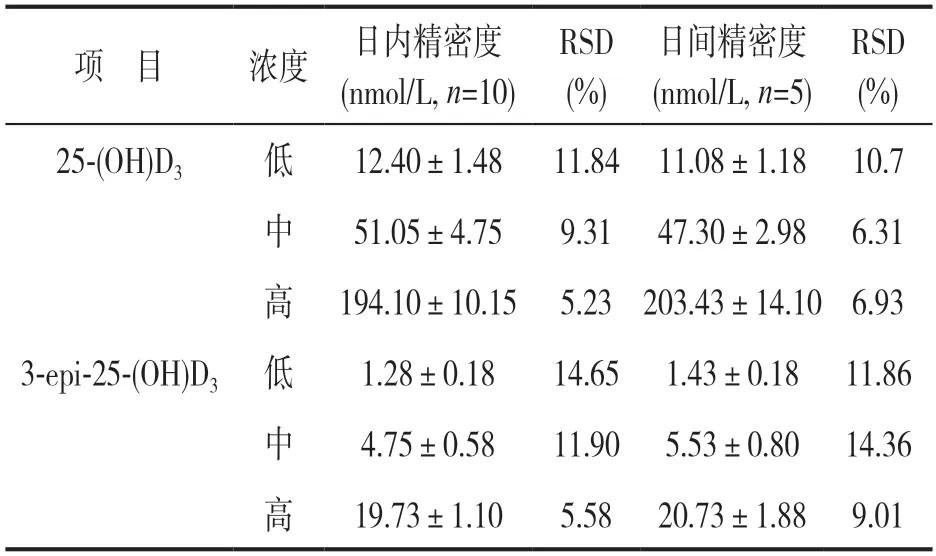
表3 25-(OH)D3 与3-epi-25-(OH)D3 的日内与日间精密度分析
2.2.3 准确度:见表4。25-(OH)D3低、中、高三个浓度质控品的回收率分别为109.92%,102.25%和98.76%;3-epi-25-(OH)D3低、中、高三个浓度质控品的回收率分别为97.75%,95.25% 和99.80%。
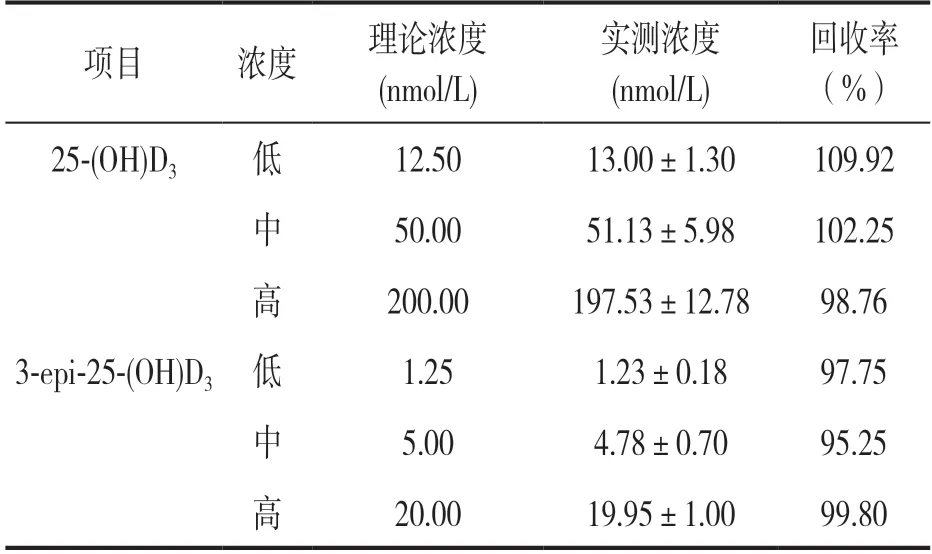
表4 25-(OH)D3 与3-epi-25-(OH)D3 的准确度分析
2.2.4 血清25-(OH)D3与3-epi-25-(OH)D3检测结果:早产儿血清25-(OH)D3与3-epi-25-(OH)D3检测结果见表5。分别以25-(OH)D3与总25-(OH)D3评估早产儿血清Vit D 水平,及二者Vit D 缺乏率与充足率的比较见表6。
表5 早产儿血清25-(OH)D3 与3-epi-25-(OH)D3 的浓度分析(n=134,±s,nmol/L)

表5 早产儿血清25-(OH)D3 与3-epi-25-(OH)D3 的浓度分析(n=134,±s,nmol/L)
类 别25-(OH)D33-epi-25-(OH)D3 总25-(OH)D33-epi-25-(OH)D3 /总25-(OH)D3(%)平均值20.28±12.555.68±4.8525.78±15.5521.94±12.86范围2.33~70.880.00~24.732.33~90.850.00~60.62

表6 早产儿Vit D 水平的评估分析
3 讨论
目前,临床上应用串联质谱技术检测血清Vit D 常采用C18 色谱柱进行色谱分离,然而C18 色谱柱存在无法分离25-(OH)D3及其差向异构体3-epi-25-(OH)D3的问题[10]。本研究采用五氟苯基丙基(pentafluorophenylpropyl,PFPP)色谱柱,在流动相甲醇的梯度作用下,8 min 内可对25-(OH)D3与3-epi-25-(OH)D3进行充分分离,从而达到准确检测血清25-(OH)D3与3-epi-25-(OH)D3浓度的目的。PFPP 色谱柱以五氟苯基丙基为键合基团,提供了与C18 固定相不同的结合方式,苯环上的氟原子可增强键合相与分析物之间的π-π 相互作用,从而提高对分析物的选择性和保留,使25-(OH)D3与3-epi-25-(OH)D3完全分离[11]。
本研究基于UPLC-MS/MS 技术,建立了准确定量检测血清25-(OH)D3与3-epi-25-(OH)D3的方法。该方法具有较广的线性范围和较低的定量限(1.48±0.20 ng/ml)。研究报道,采用液液萃取法,3-epi-25-(OH)D3的定量限可达3.50 nmol/L;采用蛋白沉淀法可达2.75 nmol/L;采用固相萃取法可达0.75 nmol/L[12]。本研究的定量限低于既往研究的液液萃取法与蛋白沉淀法,略高于固相萃取法,可能与近年来质谱仪灵敏度不断提高有关。精密度与准确度方面,其RSD 与回收率均小于15.00%,完全满足液相色谱串联质谱方法学验证的要求,具有良好的性能[7];同时,该方法能完全分离25-(OH)D3与3-epi-25-(OH)D3,排除了3-epi-25-(OH)D3干扰,达到了准确定量的目的。
采用新建方法,本研究对134 例早产儿血清25-(OH)D3与3-epi-25-(OH)D3进行检测,结果显示早产儿在未补充25-(OH)D3的情况下,其浓度水平较低,仅为22.35±13.28 nmol/L,Vit D 缺乏率高达78.36%,不足率19.40%,而充足率仅2.24%。原婷等[13]对大连市158 例早产儿在出生后24h 内采用化学发光法检测了25-(OH)D,25-(OH)D 的平均浓度43.00±18.50 nmol/L,66.50%的早产儿存在Vit D 缺乏(< 50.00 nmol/L)。黄丽密等[14]对温州市424 例早产儿出生后2 周的25-(OH)D 水平进行研究,发现35.80%的早产儿处于Vit D 缺乏(12.50 nmol/L~37.50 nmol/L),30.70%的早产儿处于Vit D 不足(37.50 nmol/L~50.00 nmol/L)。JUNG 等[15]对韩国早产儿在出生时检测了Vit D,发现25-(OH)D 的浓度为45.50±33.75 nmol/L,Vit D 缺乏率82.80%。可见,Vit D 缺乏或不足在早产儿中非常普遍,然而各个实验室检测的Vit D 平均浓度、Vit D 缺乏率与不足率却存在差异,这可能与纳入胎龄不同,Vit D 缺乏标准不一及是否补充Vit D 制剂等因素有关。此外,不同实验室所采用的检测方法同样存在差异,或为免疫法,或为采用C18 色谱柱的串联质谱法,而上述方法均不能排除3-epi-25-(OH)D3的干扰,从而导致研究结果产生差异。
本研究中的130 例(97.00%)早产儿血清中均检测到了3-epi-25-(OH)D3,4 例未检测到,最高值24.73 nmol/L,平均浓度5.68±4.85 nmol/L;3-epi-25-(OH)D3占总25-(OH)D3的比例为21.94%±12.86%,最高可达60.62%。OOMS 等[16]的研究发现,在出生时91.50%的早产儿体内均能检测到3-epi-25-(OH)D3浓度水平较低,平均3.00 nmol/L,浓度范围1.00 nmol/L~7.00 nmol/L,小于10.00%总25-(OH)D3;在补充了25-(OH)D3之后,3-epi-25-(OH)D3的占比增加为15.00%~55.00%。HANSON 等[5]的研究同样发现,新生儿出生时3-epi-25-(OH)D3的平均浓度较低,为3.25 nmol/L,仅占总25-(OH)D3的7.21%;在出生后第四周,随着25-(OH)D3浓度的增加,3-epi-25-(OH)D3的平均浓度升高至38.75±22.50 nmol/L,占比达到41.70%。总的来说,新生儿期3-epi-25-(OH)D3的血清浓度较低,但随着25-(OH)D3浓度的增加,3-epi-25-(OH)D3的生成与占比均会增加,这可能与早产儿或新生儿在生命早期时肝脏未完全发育成熟有关。本研究中,3-epi-25-(OH)D3的浓度略高于上述两项研究,可能与纳入早产儿的年龄较大,3-epi-25-(OH)D3随年龄逐渐增高有关。
在3-epi-25-(OH)D3影响下,本研究早产儿的Vit D 缺乏率下降了12.69%,Vit D 充足率升高了6.21%,差异具有统计学意义,对Vit D 的评估产生了误判。AGHAJAFARI 等[17]的研究发现,在排除3-epi-25-(OH)D3时,80.00%的新生儿Vit D 存在不足(<75.00 nmol/L);而没有排除3-epi-25-(OH)D3时,新生儿Vit D 的不足率显著下降至73.00%。MYDTSKOV等[18]同样发现在婴儿早期,如果不排除3-epi-25-(OH)D3的干扰,可导致对8.00%的婴儿Vit D 评估产生错误(<75.00 nmol/L),从而引起误判。本研究结果与上述报道相似,由此可见,评估新生儿Vit D 水平应当将3-epi-25-(OH)D3排除从而达到精准评估的目的。
综上所述,本研究基于LC-MS/MS 技术建立了同时准确定量检测血清25-(OH)D3与3-epi-25-(OH)D3浓度的新方法,避免了既往方法存在差向异构体3-epi-25-(OH)D3对25-(OH)D3造成干扰的不足,达到了准确检测早产儿Vit D 浓度的目的,对早产儿Vit D 精准评估具有十分现实的应用价值。

