LncRNA CCAT1调节miR-155表达增强CD8+T细胞对食管癌抗肿瘤活性的机制研究
周立远,叶玉祥,林 琳,王东阳
(中国人民解放军联勤保障部队第九〇〇医院仓山院区普通胸泌外科,福州 350002)
食管癌位居癌死亡第六位,大多患者发现时已出现淋巴结转移,其行手术切除患者术后复发率较高,五年生存率仅为5%~15%[1-2]。因此,研究食管癌发生发展的分子机制,寻找有效的分子靶标对食管癌的治疗具有重要意义。研究报道,肿瘤微环境中免疫状态失衡会限制T 细胞的抗肿瘤活性,促进肿瘤进展[3]。CD8+T 细胞是重要的T 淋巴细胞亚群,研究证实其与肿瘤细胞免疫及抗肿瘤效应相关,由效应体CD8+T 细胞介导的肿瘤相关抗原识别和细胞毒性杀伤在控制癌症发展中发挥重要作用[4]。CD8+T 细胞凋亡通常可导致肿瘤微环境中细胞数量减少,抑制肿瘤活性降低,与癌症进展有关[5]。研究发现,长链非编码RNA(long non-coding RNA,LncRNAs)广泛参与肿瘤微环境的各种免疫应答过程,同时还可募集多种免疫抑制因子,影响肿瘤微环境,促进肿瘤细胞免疫逃逸[6]。肿瘤细胞来源的miRNAs 可通过多种途径参与调控免疫抑制性微环境的形成[7]。结肠癌相关转录本1(colon cancerassociated transcript-1,CCAT1)是近年研究发现与多种癌症的发生发展及肿瘤细胞免疫逃逸有关的LncRNA[8]。miR-155 不仅是重要的肿瘤基因,还是免疫系统和T 淋巴细胞功能的调节因子[9],其通过增强CD8+T 细胞对稳态细胞因子的响应,可增强其抗肿瘤活性[10]。基于此,本研究探究了食管癌中LncRNA CCAT1 和miR-155 对CD8+T 细胞凋亡和抗肿瘤活性的影响及分子机制,以期为食管癌的研究及免疫治疗提供更多参考。
1 材料和方法
1.1 研究对象 收集2021年12月~2022年12月于中国人民解放军联勤保障部队第九〇〇医院仓山院区胸外科就诊的食管癌患者(n=30)和健康受试者(n=30)外周血。食管癌患者经病理学确诊,研究前未接受任何放化疗治疗,经过患者知情同意,无其它肿瘤疾病史。本研究经过本院伦理委员会批准。人食管癌细胞(Eca-109 细胞)来自中国科学院上海细胞库,在含10 mmol/ml FBS 的DMEM 培养基进行培养。
1.2 仪器与试剂 Lipofectamine2000(美国Invitrogen 公司);RIPA 缓冲液(中国Beyotime);SuperScript 逆转录试剂盒(美国Invitrogen);Annexin V-FITC/ PI 细胞凋亡检测试剂盒(美国Sigma);7500 Fast RT-PCR System 仪,SYBR Green Master Mix(美国Applied Biosystems);流式细胞仪(BD Biosciences 公司);靶向CCAT1 (si-CCAT1)或其阴性对照(si-control)的小干扰RNA,miR-155模拟物和抑制剂(中国上海GenePharma 有限公司);增强化学发光系统(Thermo Fisher);磁性珠细胞分选阴性选择试剂盒(Miltenyi Biotech 公司)。
1.3 方法
1.3.1 收集外周血单个核细胞(peripheral blood mononuclear cell,PBMC):采集研究对象新鲜外周血标本2 ml,加入Ficoll-Paque,密度梯度离心,2 500 r/min,15 min 后弃上清,收集PBMCs,以检测食管癌患者和健康受试者PBMCs 中相关蛋白及mRNA 表达。
1.3.2 食管癌患者和健康受试者PBMCs 中Cleaved Caspase 3 蛋白检测:用含有蛋白酶和磷酸酶抑制剂的RIPA 缓冲液对食管癌患者和健康受试者PBMCs进行Western blot 处理,离心获得含Cleaved Caspase 3 的蛋白处理液。使用BCA 蛋白检测试剂盒测定蛋白浓度,用十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,并转移到PVDF膜上,蛋白在室温下被封闭过夜,与特异性Cleaved Caspase 3-抗孵育过夜,PVDF 膜用常规 TBST 溶液洗涤,室温下与辣根过氧化物酶结合的二抗孵育2h。使用增强化学发光系统对膜进行可视化分析,以比较食管癌患者和健康受试者PBMCs 中Cleaved Caspase 3 蛋白的表达差异。
1.3.3 食管癌患者和健康受试者PBMCs 中CCAT1 mRNA,miR-155 mRNA,IL-2 mRNA 和IFN-γ mRNA 检测:使用RNA 提取试剂盒从PBMCs 中提取总RNA,用分光光度法检测其浓度和纯度;使用SuperScript 逆转录试剂盒进行cDNA 合成逆反应,使用SYBR Green Master Mix 在7500 Fast RT-PCR 仪上进行RT-qPCR 检测。由生工生物技术(中国上海)完成特定基因的寡核苷酸引物的设计和合成,见表1。反应体系为20μl:2xSYBR Green Master Mix 10 μl,上、下引物各0.5 μl,模板1 μl,H2O 8 μl。分析Ct值,并使用2-ΔΔCt方法计算相对定量,对比食管癌患者和健康受试者PBMCs 中CCAT1 mRNA,miR-155,IL-2 mRNA和IFN-γ mRNA 表达差异。

表1 PBMCs 中CCAT1 mRNA,miR-155 mRNA,IL-2 mRNA 和IFN-γ mRNA 引物序列
表1 CCAT1 与miR-155 共同作用对CD8+T 细胞凋亡、细胞杀伤活性及Cleaved Caspase 3 蛋白和IL-2 mRNA,IFN-γmRNA 表达的影响(±s)
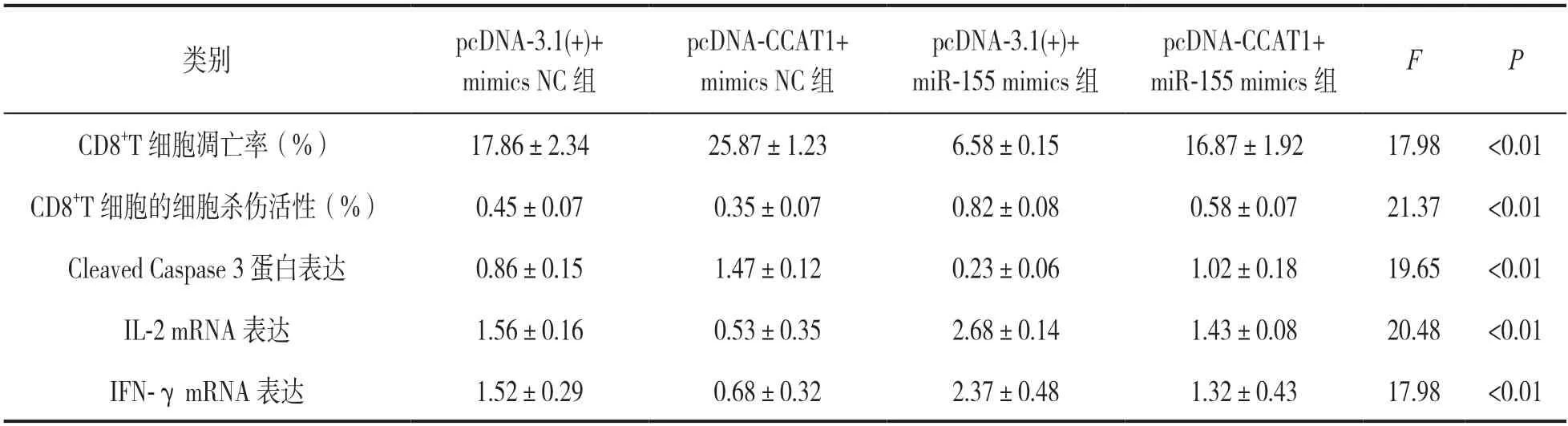
表1 CCAT1 与miR-155 共同作用对CD8+T 细胞凋亡、细胞杀伤活性及Cleaved Caspase 3 蛋白和IL-2 mRNA,IFN-γmRNA 表达的影响(±s)
类别pcDNA-3.1(+)+mimics NC 组pcDNA-CCAT1+mimics NC 组pcDNA-3.1(+)+miR-155 mimics 组pcDNA-CCAT1+miR-155 mimics 组FP CD8+T 细胞凋亡率(%)17.86±2.3425.87±1.236.58±0.1516.87±1.9217.98<0.01 CD8+T 细胞的细胞杀伤活性(%)0.45±0.070.35±0.070.82±0.080.58±0.0721.37<0.01 Cleaved Caspase 3 蛋白表达0.86±0.151.47±0.120.23±0.061.02±0.1819.65<0.01 IL-2 mRNA 表达1.56±0.160.53±0.352.68±0.141.43±0.0820.48<0.01 IFN-γ mRNA 表达1.52±0.290.68±0.322.37±0.481.32±0.4317.98<0.01
1.3.4 CD8+T 细胞分离、培养和转染分组:使用磁性珠细胞分选阴性选择试剂盒从两名健康供者的PBMCs 中分离出CD8+T 细胞,用anti-CD3(2μg/ml,BD Biosciences) 和anti-CD28 (1μg/ml,BD Biosciences)在添加了重组人白细胞介素-2(recombinant human interleukin-2,rhIL-2)(120 IU/ml,Chiron)的RPMI-1640 培养液中激活24 h。细胞分为三组:第一组分别转染:①下调CCAT1 的siRNA 序列(si-CCAT1 组);②下调阴性对照序列(si-control 组)。第二组分别转染:①miR-155抑制物(miR-155 inhibitor 组);②抑制阴性对照(inhibitor control 组)。第三组分别转染:①过表达对照质粒(pcDNA-3.1(+)+mimics NC 组);②CCAT1 过表达质粒+miR-155 过表达阴性对照(pcDNA-CCAT1+mimics NC 组);③CCAT1 过表达对照质粒+miR-155 过表达模拟物[pcDNA-3.1(+)+miR-155 mimics 组];④CCAT1 过表达质粒和miR-155 过表达模拟物(pcDNA-CCAT1+miR-155 mimics 组)。使用Lipofectamine2000 按照说明书将以上质粒转染到CD8+T 细胞中,用于分析CD8+T细胞凋亡率,CD8+T 细胞杀伤活性,Eca-109 细胞增殖活力,Eca-109 细胞划痕愈合率,Cleaved Caspase 3 蛋白及IFN-γ 和IL-2 表达。
1.3.5 下调CCAT1,miR-155 表达对CD8+T 细胞凋亡的影响:使用Annexin V-FITC/ PI 细胞凋亡检测试剂盒检测CD8+T 细胞凋亡,然后行流式细胞仪分析。将上述不同质料转染的CD8+T 细胞(1×106/孔)分别接种于6 孔板,用200 μl Annexin V-FITC 和10 μl PI 染色,用流式细胞仪和flow Jo V10 软件进行流式细胞分析,比较下调CCAT1 和miR-155 表达对CD8+T 细胞凋亡的影响。
1.3.6 CCAT1,miR-155 质粒转染CD8+T 细胞对Eca-109 细胞的杀伤作用:细胞杀伤实验以Eca-109 细胞为靶细胞。转染①si-CCAT1,si-control;②inhibitor control,miR-155 inhibitor;③pcDNA-3.1(+)+mimics NC,pcDNA-CCAT1+mimics NC,pcDNA-3.1(+)+miR-155 mimics,pcDNACCAT1+miR-155 mimics 后的CD8+T 细胞与Eca-109 细胞混合在96 孔培养板中孵育过夜。避光后每孔细胞分别加入20 μl MTS,2h 后在酶标仪490 nm 下检测细胞的吸光度(A值),重复三次。杀伤率(%)=[A靶细胞对照-(A实验孔-A效应细胞对照)]/A靶细胞对照×100%。分析CCAT1 和miR-155 质粒转染CD8+T 细胞对Eca-109 细胞的杀伤作用。
1.3.7 CCAT1 野生型、突变型对miR-155 的调节作用:miRcode 软件预测CCAT1 靶基因,将CCAT1 序列插入到psi-CHECKTM-2 载体下游,构建CCAT1 wt 表达载体,再利用点突变试剂盒构建CCAT1 mut 表达载体。将CCAT1 wt+mimics NC,CCAT1 wt+miR-155 mimics,CCAT1 mut+mimics NC,CCAT1 mut+miR-155 mimics 分别转染至Eca-109 细胞中,48h 后采用双荧光素酶试验分别检测相应Eca-109 细胞荧光素酶活性,以了解CCAT1野生型、突变型对miR-155 的调节作用。
1.3.8 CCAT1 与miR-155 质粒共转染对Eca-109 细胞增殖活力的影响:采用CCK-8 法检测Eca-109 细胞的增殖活力。取对数生长期Eca-109 细胞转染成功后以5×105细胞/孔的密度接种于96 孔板,如前所述将70%汇合的细胞转染重组质粒,48h 后在细胞中加入CCK-8 溶液,孵育4h 后应用酶标仪在450 nm 处测量每个孔的A值,分析CCAT1 与miR-155 共同作用对Eca-109 细胞增殖活力的影响。
1.3.9 CCAT1 与miR-155 质粒共转染对Eca-109 细胞迁移的影响:采用细胞划痕实验检测Eca-109 细胞迁移能力。取对数生长期Eca-109 细胞转染成功后以5×105细胞/孔的密度接种于6 孔板,在37 ℃,5%(v/v)CO2培养箱中培养48h,用无菌吸管尖刮单层细胞中心,用PBS 冲洗2 次,形成宽度恒定的直线无细胞区(间隙),37 ℃,5%(v/v) CO2放置0h 和48h,采用倒置显微镜观察创面闭合情况并拍照,图像采用ImageJ 软件进行分析。在显微镜视野中随机采集6 个部位,测量间隙之间的距离,并计算细胞划痕愈合率,分析CCAT1 与miR-155共同作用对Eca-109 细胞迁移的影响。
1.4 统计学分析 使用GraphPad Prism7.0 进行分析,符合正态分布的数据以均数±标准差(±s)表示,两组间差异比较采用t检验,多组间差异比较采用单因素方差分析,LSD 检验行多组间两两差异比较;不符合正态分布采用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 CCAT1 及miR 155 在食管癌患者外周血细胞中的差异表达 qRT-PCR 检测结果表明:食管癌患者PBMCs 中CCAT1 表达(2.58±0.28)高于健康受试者(1.35±0.34),miR-155 表达(0.53±0.09)低于健康受试者(1.54±0.29),组间比较差异具有统计学意义(t=12.04,21.05,均P<0.05)。
2.2 下调CCAT1 对CD8+T 细胞凋亡、细胞杀伤活性及Cleaved Caspase 3 蛋白及IL-2 mRNA,IFN-γ mRNA 表达的影响 qRT-PCR 结果显示,si-CCAT1组细胞内CCAT1 mRNA(0.47±0.08)表达明显低于si-control 组(1.17±0.27),差异具有统计学意义(t=23.12,P<0.05),提示下调CCAT1 表达细胞系构建成功。流式细胞术检测显示:下调CCAT1 后CD8+T 细胞凋亡率(12.05%±0.28%) 明显低于 si-control 组(19.86%±0.45%),CD8+T 细胞(0.49%±0.05%)的细胞杀伤活性明显高于si-control 组(0.34%±0.02%),差异具有统计学意义(t=9.82,-17.54,均P<0.05)。Western blot 和qRT-PCR检测结果显示,si-CCAT1 组细胞内Cleaved Caspase 3 蛋白(0.32±0.09)表达低于si-control 组(1.37±0.72),IL-2 mRNA(2.38±0.47)和IFN-γm RNA(3.28±0.26)表达高于si-control 组(1.12±0.23,1.28±0.37),差异具有统计学意义(t=-20.05,-18.29,-19.86,均P<0.05)。
2.3 CCAT1 野生型、突变型对miR-155 的调节作用见图1。生物信息学分析显示,CCAT1 和miR-155之间存在互补碱基对(图1A)。双荧光素酶实验检测CCAT1 与miR-155 的相互作用,结果显示:CCAT1 野生型和miR-155 模拟物共转染后miR-155 mimics 组细胞荧光素酶活性(0.41±0.08)显著低于对照组(1.24±0.18),差异具有统计学意义(t=17.92,P<0.01,图1B),而CCAT1 突变型和miR-155 模拟物共转染后荧光素酶活性与对照组比较无明显差异。
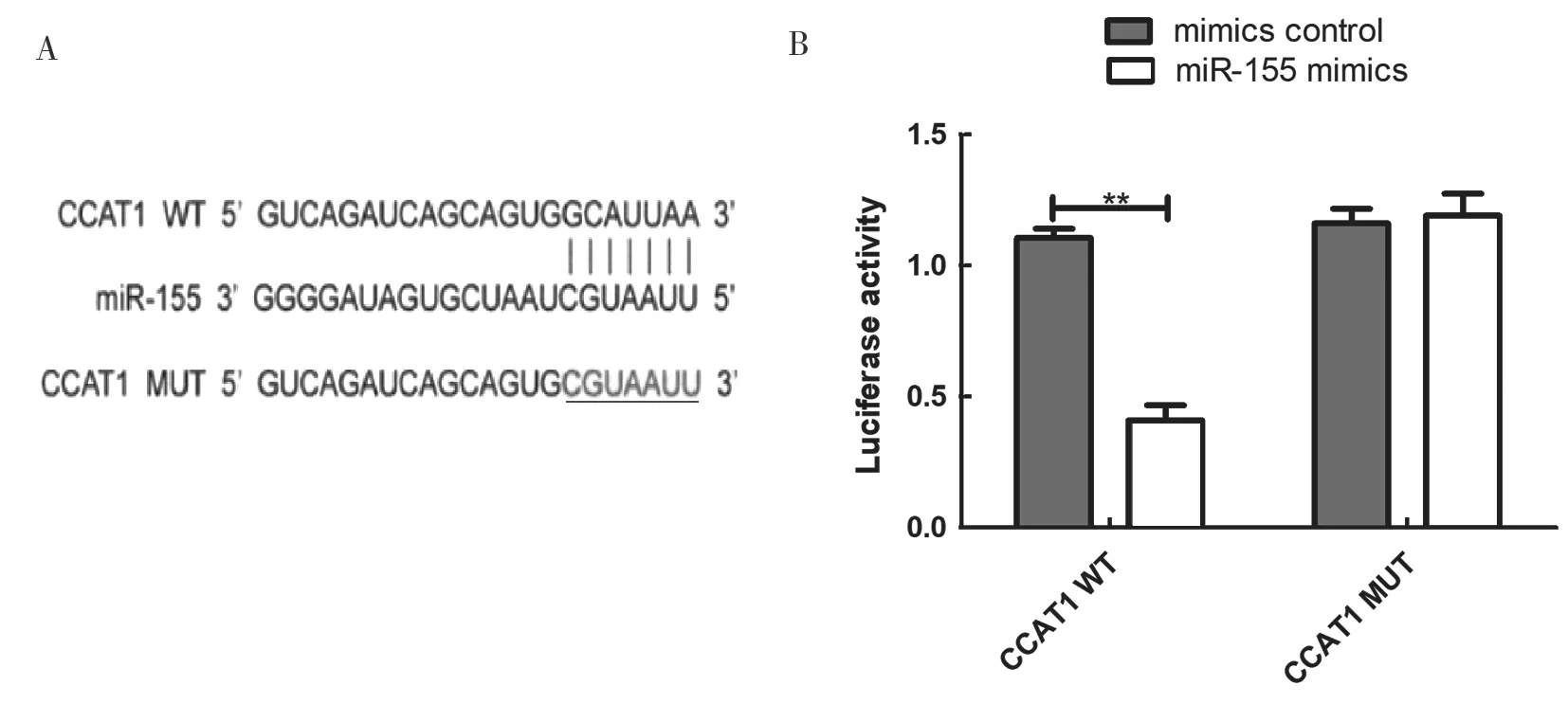
图1 CCAT1 与miR-155 的相互作用
2.4 下调miR 155 对CD8+T 细胞凋亡、细胞杀伤活性、Cleaved Caspase 3 蛋白、IL-2 mRNA 与IFNγmRNA 表达的影响 见表1。qRT-PCR 结果显示,miR-155 inhibitor 组细胞内miR-155 mRNA(0.73±0.18)表达明显低于inhibitor control 组(1.52±0.17),差异具有统计学意义(t=19.25,P<0.05),提示下调miR-155 表达细胞系构建成功。流式细胞术检测显示:下调miR-155 后CD8+T(24.87%±0.95%)细胞凋亡率明显高于inhibitor control 组(18.24%±1.25%),CD8+T 细胞(0.26%±0.06%)的细胞杀伤活性明显低于inhibitor control 组(0.43%±0.05%),差异具有统计学意义(t=10.03,20.06,均P<0.01)。Western blot 和qRT-PCR 检测结果显示,miR-155 inhibitor 组细胞内Cleaved Caspase 3 蛋白(1.07±0.23)表达高于inhibitor control 组(0.42±0.02),IL-2 mRNA(0.73±0.26)和IFN-γ mRNA(0.54±0.18)表达低于inhibitor control 组(1.39±0.08,1.16±0.24),差异均具有统计学意义(t=18.75,19.27,18.35,均P<0.01)。
2.5 CCAT1 与miR 155 共作用对CD8+T 细胞凋亡、细胞杀伤活性及Cleaved Caspase 3 蛋白和IL-2 mRNA,IFN-γ mRNA 表达的影响 见表1。流式细胞术检测显示:pcDNA-CCAT1+mimics NC 组CD8+T 细胞凋亡率明显高于pcDNA-3.1(+)+mimics NC 组,pcDNA-3.1(+)+miR-155 mimics 组CD8+T细胞凋亡率明显低于pcDNA-3.1(+)+mimics NC组,pcDNA-CCAT1+miR-155 mimics 组CD8+T 细胞凋亡率明显高于pcDNA-3.1(+)+miR-155 mimics 组;pcDNA-CCAT1+mimics NC 组CD8+T 细胞的细胞杀伤活性明显低于pcDNA-3.1(+)+mimics NC 组,pcDNA-3.1(+)+miR-155 mimics 组CD8+T 细胞的细胞杀伤活性明显高于pcDNA-3.1(+)+mimics NC组,pcDNA-CCAT1+miR-155 mimics 组CD8+T 细胞的细胞杀伤活性明显低于pcDNA-3.1(+)+miR-155 mimics 组,差异具有统计学意义(均P<0.01)。
Western blot 结果显示,pcDNA-CCAT1+mimics NC 组Cleaved Caspase 3 蛋白表达明显高于pcDNA-3.1(+)+mimics NC 组,pcDNA-3.1(+)+miR-155 mimics 组Cleaved Caspase 3 蛋白表达明显低于pcDNA-3.1(+)+mimics NC 组,pcDNACCAT1+miR-155 mimics 组Cleaved Caspase 3 蛋白表达明显高于pcDNA-3.1(+)+miR-155 mimics 组,差异具有统计学意义(均P<0.01)。qRT-PCR 检测显示,pcDNA-CCAT1+mimics NC 组IL-2 和IFNγmRNA 表达明显低于pcDNA-3.1(+)+mimics NC组,pcDNA-3.1(+)+miR-155 mimics 组IL-2 和IFNγmRNA 表达明显高于pcDNA-3.1(+)+mimics NC组,pcDNA-CCAT1+miR-155 mimics 组IL-2 和IFN-γmRNA 表达明显低于pcDNA-3.1(+)+miR-155 mimics 组,差异均有统计学意义(均P<0.01)。
2.6 CCAT1 与miR 155 共同作用对Eca 109 细胞增殖和迁移的影响 CCK-8 法和细胞划痕愈合实验检测显示:pcDNA-CCAT1+mimics NC 组细胞增殖活力和细胞划痕愈合率明显高于pcDNA-3.1(+)+mimics NC 组(80.30%±1.98% vs 58.29%±2.18%,75.26%±1.36% vs 52.43%±1.48%)。pcDNA-3.1(+)+miR-155 mimics 组细胞增殖活力和细胞划痕愈合率明显低于pcDNA-3.1(+)+mimics NC 组,pcDNA-CCAT1+miR-155 mimics 组细胞增殖活力和细胞划痕愈合率明显高于pcDNA-3.1(+)+miR-155 mimics 组(57.92%±3.24% vs 37.54%±1.23%,50.29%±1.68% vs 31.92%±1.02%),差异具有统计学意义(F=19.86,20.26,均P<0.01)。
3 讨论
近年研究发现,LncRNA CCAT1 具有诱导上皮-间充质细胞转化和调节细胞生长、侵袭和迁移的作用,被认为是一种普遍的肿瘤启动子[11-13]。本研究初步强调了CCAT1对免疫细胞抗肿瘤功能的影响,发现抑制CCAT1 可通过调节miR-155 表达抑制CD8+T 细胞凋亡并增强细胞的抗肿瘤活性,这些发现为食管癌治疗提供了一个有效的治疗靶点,并为提高免疫治疗的结果提供了新的见解。
大量证据表明,LncRNAs 在各种癌症中普遍存在异常表达,参与了癌症的发生进展,这意味着LncRNAs 可能成为一种新的潜在的癌症生物标志物[14]。此外最新研究表明,LncRNAs 可以作为ceRNA,通过与miRNA 竞争性结合,可调控基因转录[4]。在数百种LncRNAs 中,CCAT1 在细胞周期调控中发挥作用,通过调控肿瘤细胞凋亡,参与调控肿瘤的恶性发展进程。现有研究表明,LncRNA CCAT1 在多种人类癌症中表达上调,作为致癌基因存在,如HU 等[15]发现,LncRNA CCAT1/miR-143/PLK1/BUBR1 轴是食管癌增殖和耐药的生物标志物。LÜ 等[16]人也曾指出,LncRNA CCAT1 通过抑制miR-33a 表达促进了黑色素瘤细胞的增殖和侵袭。以上研究均表明LncRNA CCAT1在肿瘤发展过程中发挥了至关重要的作用。此外研究证实,LncRNAs 与肿瘤细胞免疫逃逸有关[17]。然而,CCAT1 在食管癌发生发展中的作用以及是否和食管癌免疫逃逸之间存在关系尚未被研究报道。
本研究首先检测了食管癌患者与健康受试者PBMCs 细胞中CCAT1 的表达,结果发现食管癌患者PBMCs 中CCAT1 表达显著上调,提示CCAT1的异常表达可能与食管癌的进展有关系。进一步探究发现,下调CCAT1 表达增强了CD8+T 细胞的抗肿瘤功能,提示CCAT1 具有诱导食管癌细胞免疫逃逸的能力。鉴于CD8+T 细胞在控制癌症发展中的普遍作用,CCAT1 可能与许多其他癌症免疫反应有关,在免疫治疗中作为免疫检查点具有广阔的前景,因此深入研究CCAT1 的作用机制具有重要意义。研究发现,CCAT1 通过作用不同的靶点参与了肿瘤的发展,如LncRNA CCAT1 负向调控miR-181a-5p 促进子宫内膜癌细胞增殖和迁移[18]。LncRNA CCAT1 通过抑制miR-218/ZFX 信号通路促进三阴性乳腺癌进展[19]。LncRNA CCAT1 通过与DDX5 和MIR-28-5P 相互作用促进了前列腺癌细胞的增殖[20]。而本研究经生物信息学方法分析发现,miR-155 是CCAT1 的下游作用靶点,两者之间存在互补碱基对;双荧光素酶实验证实了CCAT1与miR-155 的相互作用。有证据表明,miR-155 与乳腺癌、直肠癌、肝癌、肺癌和膀胱癌的发生有关[8,21-22]。miR-155 通过靶向H3F3A 激活CDK2 加速人肝癌细胞的生长[23]。除了参与癌症,miR-155还是免疫系统和T 淋巴细胞功能的调节因子[9]。陈倩云等[10,24]研究报道,miR-155 通过增强CD8+T细胞对稳态细胞因子的响应增强其抗肿瘤活性。而本研究证实了食管癌患者PBMCs 细胞中miR-155表达下调,下调miR-155 表达诱导了CD8+T 细胞凋亡,抑制了CD8+T 细胞的抗肿瘤功能,进一步表明其在食管癌中的抗肿瘤作用。本实验从新的角度揭示了CCAT1 与食管癌细胞免疫逃逸之间的关系,为防控食管癌进展提供了理论基础,然而本文也存在一定的局限之处,如本文未进行裸鼠成瘤实验检测CCAT1 的临床效果,CCAT1 调控miR-155的具体作用机制还需要进一步深入探讨。
综上所述,LncRNA CCAT1 在食管癌患者中表达显著上调,敲低CCAT1 通过调节miR-155 表达抑制CD8+T 细胞凋亡并增强细胞的抗肿瘤活性,为食管癌癌发病机制的复杂调控网络提供了新的思路和借鉴。

