LncRNA NEAT1通过调节miR-125b-5p/IGFBP5轴对血管瘤内皮细胞增殖、凋亡、迁移的实验研究
廖 烘,刘 伟,龙运峰(邵阳学院附属第一医院儿科,湖南邵阳 417000)
血管瘤是婴儿时期常见的一种良性血管肿瘤[1]。婴儿血管瘤始于内皮细胞的增生,随后经历一段时间的增殖期后过渡到退化期[2]。在增殖性生长阶段,血管瘤会出现多种临床症状,包括溃疡、出血、身体功能受损和皮肤表面破裂,退化期阶段大多数血管瘤停止生长并开始缩小,目前的治疗方法主要包括药物治疗、激光治疗和手术切除[3]。然而,在临床上严重的血管瘤难以治愈。因此,需要进一步了解血管瘤进展的机制。越来越多的证据表明,长链非编码RNA(long noncoding RNA,LncRNA)在癌症进展中具有多种调节功能,包括增殖、凋亡和迁移[4]。核富集转录本1(nuclear enriched abundant transcript 1,NEAT1)是一种致癌LncRNA,已有研究报道,沉默NEAT1可抑制人血管瘤内皮细胞HemECs 增殖、迁移与侵袭[5]。但沉默NEAT1 抑制血管瘤进展的分子机制尚不完全明确。LncRNA 作为海绵可通过竞争性结合miRNA 进而调节mRNA 表达,该作用是其发挥调控作用的常见方式之一[6]。本研究通过生物信息学分析发现NEAT1 与微小RNA(micro RNAs,miR)-125b-5p,miR-125b-5p 与胰岛素样生长因子结合蛋白5(insulin-like growth factor binding protein 5,IGFBP5)存在靶向关系。相关研究显示,miR-125b-5p 在血管瘤组织和细胞中低表达,过表达miR-125b-5p 可抑制HemECs 细胞增殖、促进细胞凋亡[7];下调IGFBP5 可抑制血管瘤的进展[8]。而NEAT1 能否通过调节miR-125b-5p/IGFBP5 轴影响血管瘤进展尚不清楚。因此,本研究主要探究NEAT1 对血管瘤内皮细胞增殖、凋亡、迁移的影响以及其作用机制。
1 材料与方法
1.1 研究对象 收集2016年3月~2019年3月在邵阳学院附属第一医院接受手术切除血管瘤的婴儿血管瘤组织和瘤旁组织,共18 对。标本立即冷冻于-80℃中。所有参与者的法定监护人均已签署知情同意书。人脐静脉内皮细胞HUVES(上海拜力生物公司);人血管瘤内皮细胞HemECs,HDEC(上海泽叶生物公司)。将HUVES,HemECs,HDEC细胞在补充有10g/dl 胎牛血清的DMEM 培养液中培养。
1.2 试剂与仪器 siRNA NEAT1(si-NEAT1)及其阴性对照(si-NC),miR-125b-5p 抑制物(miR-125b-5p inhibitor)及其阴性对照(inhibitor-NC)(上海美轩生物公司);CCK-8 试剂盒(深圳市纽邦生物公司,货号:CK04);Annexin V-FITC 细胞凋亡试剂盒(温州科淼生物公司,货号:KMR0212222);兔源一抗IGFBP5,增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)(货号:ab29),B 细胞淋巴瘤/白血病-2(B cell lymphoma/lewkmia-2,Bcl-2)(货号:ab32124),基质金属蛋白酶-9(Matrix metalloproteinase-9,MMP-9)(货号:ab 76003),GAPDH(货号:ab9485)及辣根过氧化物酶(HRP)标记的羊抗兔二抗(货号:ab109489)(美国Abcam 公司)。FK-SY96A 多功能酶标仪(山东方科仪器有限公司);奥林巴斯BX53 光学显微镜[奥林巴斯(中国)有限公司];Agilent NovoCyte Quanteon 流式细胞仪[安捷伦科技(中国)有限公司]。
1.3 方法
1.3.1 细胞培养及分组:取对数生长期的HemECs 细胞,分为Ct组、si-NC 组、si-NEAT1 组、si-NEAT1+i nhibitor-NC 组和si-NEAT1+miR-125b-5p inhibitor 组。si-NC 组、si-NEAT1 组、si-NEAT1+inhibitor-NC组和si-NEAT1+miR-125b-5p inhibitor 组分别转染si-NC,si-NEAT1,si-NEAT1 和inhibitor-NC,si-NEAT1和miR-125b-5p inhibitor 于HemECs 细胞中,Ct组为未转染的HemECs 细胞,转染48 h 后进行后续实验。
1.3.2 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测组织和细胞中NEAT1,miR-125b-5p 表达:使用Trizol 试剂提取组织和细胞的总RNA。将1μg RNA 逆转录为cDNA 后,使用Power SYBR™ Green PCR master mix 在ABI 7500 PCR 系统上分析基因表达。使用2-ΔΔCt方法计算基因的相对表达量。引物序列见表1。

表1 qRT-PCR 引物序列
1.3.3 细胞活力检测试剂盒(cell counting kit-8,CCK-8)及台盼蓝染色检测细胞增殖:在96 孔板的每个孔中接种大约1×104个HemEC 细胞。接种48 h 后,每孔加入10 μl CCK-8 溶液,37 °C 培养2 h。通过使用酶标仪测量450 nm处吸光度来确定细胞增殖能力。将接种于96 孔板中的细胞培养2h 后,弃上清、PBS 洗涤、0.4g/dl 台盼蓝溶液染色2 min,染色呈蓝色的细胞为死细胞,显微镜观察细胞生长情况。
1.3.4 流式细胞术检测细胞凋亡:收集各组细胞并将细胞浓度调整为1×106个/ml。取200 µl 细胞悬液重悬于300 µl 结合缓冲液中,与5µl Annexin V-FITC/PI 轻轻混匀,避光15 min,流式细胞仪观察细胞凋亡情况。
1.3.5 划痕试验检测细胞迁移:将HemECs 细胞以1×106个/孔接种到6 孔板中,达到100%融合后,使用移液器吸头对HemECs 细胞单层进行划痕。用显微镜观察划痕后0,24 h 的划痕面积,分别记录划痕面积为M0,M24,划痕愈合率(%)=(1-M24/M0)×100%。
1.3.6 蛋白免疫印迹(Western blot)检测IGFBP5,PCNA,Bcl-2,MMP-9 蛋白表达:使用RIPA 裂解缓冲液提取组织和细胞的总蛋白。在12g/dl SDSPAGE 上分离约30 μg 蛋白质样品并转移到PVDF膜上。用5g/dl 脱脂牛奶封闭后,将膜与抗IGFBP5(1∶1 000),PCNA(1∶1 000),Bcl-2(1∶2 000),MMP-9(1∶2 000),GAPDH(1∶2 000)的一抗在4℃孵育过夜。再将膜暴露于HRP 偶联的二抗(1∶2 000)2 h。使用ECL 试剂检测蛋白信号,Image J 软件分析蛋白灰度值。
1.3.7 双荧光素酶报告基因实验:构建NEAT1 野生型质粒(NEAT1-WT)和突变型质粒(NEAT1-MUT),将NEAT1-WT 和NEAT1-MUT 分别与mimic NC 或miR-125b-5p mimic共转染于HemECs细胞,48 h 后,观察荧光素酶活性变化。构建IGFBP5 野生型质粒(IGFBP5-WT)和突变型质粒(IGFBP5-MUT),将IGFBP5-WT 和IGFBP5-MUT 分别与mimic NC或miR-125b-5p mimic 共转染于HemECs 细胞,48 h后,监测荧光素酶活性变化。
1.4 统计学分析 使用SPSS 19.0 进行统计分析,符合正态分布的数据表示为均值±标准差(±s),独立样本t检验用于测试两组之间的差异,单因素方差分析用于评估多组之间的差异,进一步两组间的比较采用SNK-q检验。瘤旁组织及血管瘤组织中的差异比较采用配对t检验,P< 0.05 为差异具有统计学意义。
2 结果
2.1 NEAT1,miR-125b-5p,IGFBP5 蛋白在血管瘤组织和细胞中的表达 见表2。与瘤旁组织比较,血管瘤组织中NEAT1,IGFBP5 蛋白表达水平升高,miR-125b-5p 表达水平降低,差异具有统计学意义(均P<0.05)。与HUVES 细胞比较,HemECs,HDEC 细胞中NEAT1,IGFBP5 蛋白表达升高,miR-125b-5p 表达降低,差异具有统计学意义(t=17.963,17.320,99.204;14.697,20.914,33.680,均P<0.05);与HemECs 细胞比较,HDEC细胞中NEAT1,IGFBP5 蛋白表达降低,miR-125b-5p 表达升高,差异具有统计学意义(t=8.795,8.036,14.241,均P<0.05);且HemECs 细胞中NEAT1,IGFBP5 蛋白表达量最高,miR-125b-5p 表达量最低,因此,选取HemECs 细胞为研究对象。
表2 NEAT1,miR-125b-5p,IGFBP5 蛋白在组织、细胞中的表达(±s,n=18)

表2 NEAT1,miR-125b-5p,IGFBP5 蛋白在组织、细胞中的表达(±s,n=18)
组织细胞FP瘤旁组织血管瘤组织HUVES 细胞HemECs 细胞HDEC 细胞NEAT11.00±0.002.87±0.2236.062<0.0011.00±0.002.76±0.241.78±0.13187.909<0.001 miR-125b-5p1.00±0.000.24±0.02161.220<0.0011.00±0.000.19±0.020.45±0.041539.300<0.001 IGFBP5/GAPDH0.27±0.021.45±0.1435.400<0.0010.24±0.021.31±0.150.78±0.06194.423<0.001项目tP
2.2 各转染组HemECs 细胞中IGFBP5 蛋白、NEAT1,miR-125b-5p 表达比较 见表3。与si-NC组比较,si-NEAT1 组NEAT1,IGFBP5 蛋白表达降低,miR-125b-5p 表达升高,差异具有统计学意义(t=13.893,10.809,11.549,均P<0.05);与si-NEAT1+inhibitor-NC 组比较,si-NEAT1+miR-125b-5p inhibitor 组NEAT1 表达量变化差异无统计学意义(t=0.577,P>0.05),miR-125b-5p 表达降低,IGFBP5 蛋白表达量升高,差异具有统计学意义(t=9.218,13.188,均P<0.05)。
表3 NEAT1,miR-125b-5p,IGFBP5 蛋白在HemECs 细胞中的表达(±s,n=6)

表3 NEAT1,miR-125b-5p,IGFBP5 蛋白在HemECs 细胞中的表达(±s,n=6)
注:与Ct 组比较*t=83.283,14.207,11.690,均P<0.05;与si-NC 组比较#t=13.893,11.549,10.809,均P<0.05;与si-NEAT1 组比较&t=8.955,13.145,均P<0.05;与si-NEAT1+inhibitor-NC 组比较@t=9.218,13.188,均P<0.05。
项 目Ct 组si-NC 组 si-NEAT1 组 si-NEAT1+inhibitor-NC 组si-NEAT1+miR-125b-5p inhibitor 组FP NEAT11.00±0.00 1.01±0.12 0.32±0.02*#0.34±0.030.33±0.03247.139<0.001 miR-125b-5p1.00±0.00 1.02±0.10 1.87±0.15*#1.86±0.141.19±0.11&@91.154<0.001 IGFBP5/GAPDH1.29±0.18 1.31±0.20 0.41±0.04*#0.43±0.030.89±0.08&@71.542<0.001
2.3 沉默NEAT1 对HemECs 细胞增殖、凋亡的影响 见表4。与si-NC 组比较,si-NEAT1 组A值、细胞生长率降低,细胞凋亡率升高,差异均有统计学意义(t=14.231,58.755,23.201,均P<0.05);与si-NEAT1+inhibitor-NC 组比较,si-NEAT1+miR-125b-5p inhibitor 组A值、细胞生长率升高,细胞凋亡率降低,差异均有统计学意义(t=13.830,13.644,9.818,均P<0.05),
表4 沉默NEAT1 对HemECs 细胞A 值、细胞生长率及凋亡率的影响(±s,n=6)

表4 沉默NEAT1 对HemECs 细胞A 值、细胞生长率及凋亡率的影响(±s,n=6)
注:与Ct 组比较*t=12.066,58.607,23.358,均P<0.05;与si-NC 组比较#t=14.231,58.755,23.201,均P<0.05;与si-NEAT1 组比较&t=12.761,14.278,9.365,均P<0.05;与si-NEAT1+inhibitor-NC 组比较@t=13.830,13.644,9.818,均P<0.05。
类别Ct 组si-NC 组 si-NEAT1 组 si-NEAT1+inhibitor-NC 组si-NEAT1+miR-125b-5p inhibitor 组FP A 值1.12±0.13 1.13±0.11 0.45±0.04*#0.44±0.030.87±0.07&@96.486<0.001细胞生长率(%) 99.37±0.28 99.41±0.22 32.28±2.79*#33.45±2.9469.77±5.82&@659.897<0.001细胞凋亡率(%) 12.25±1.03 12.36±1.07 45.58±3.34*#46.03±3.2530.14±2.27&@289.741<0.001
2.4 沉默NEAT1 对HemECs 细胞迁移的影响 与si-NC 组比较,si-NEAT1 组(20.33±1.23 vs 49.24±2.43)细胞划痕愈合率降低(t=26.001,P<0.05);与si-NEAT1+inhibitor-NC 组比较,si-NEAT1+miR-125b-5p inhibitor 组(35.58±2.36 vs 21.04±1.21)细胞划痕愈合率升高(t=13.429,P<0.05),差异均有统计学意义。
2.5 沉默NEAT1 对各组HemECs 细胞中增殖、凋亡、迁移相关蛋白表达的影响 见表5。与si-NC组比较,si-NEAT1 组PCNA,Bcl-2,MMP-9 蛋白表达降低(t=15.309,13.516,21.137,均P<0.05),与si-NEAT1+inhibitor-NC 组比较,si-NEAT1+miR-125b-5pinhibitor 组PCNA,Bcl-2,MMP-9 蛋白表达升高(t=13.188,11.182,15.010,均P<0.05),差异具有统计学意义。
表5 沉默NEAT1 对HemECs 细胞中PCNA,Bcl-2,MMP-9 蛋白表达的影响(±s,n=6)

表5 沉默NEAT1 对HemECs 细胞中PCNA,Bcl-2,MMP-9 蛋白表达的影响(±s,n=6)
注:与Ct 组比较*t=16.028,15.141,18.842,均P<0.05;与si-NC 组比较#t=15.309,13.516,21.137,均P<0.05;与si-NEAT1 组比较&t=12.324,12.187,15.465,均P<0.05;与si-NEAT1+inhibitor-NC 组比较@t=13.188,11.182,15.010,均P<0.05。
类别Ct 组si-NC 组si-NEAT1 组 si-NEAT1+inhibitor-NC 组 si-NEAT1+miR-125b-5p inhibitor 组FP PCNA/GAPDH1.25±0.131.27±0.14 0.36±0.04*#0.35±0.030.81±0.08&@135.344<0.001 Bcl-2/GAPDH1.38±0.141.39±0.16 0.48±0.04*#0.50±0.050.97±0.09&@104.807<0.001 MMP-9/GAPDH1.07±0.111.09±0.10 0.21±0.02*#0.22±0.020.55±0.05&@223.252<0.001
2.6 NEAT1 与miR-125b-5p,miR-125b-5p 与IGFBP5存在靶向调控关系 Starbase 网站预测NEAT1 与miR-125b-5p,miR-125b-5p 与IGFBP5 的结合位点,见图1。与mimic NC 和NEAT1-WT 共转染组比较,miR-125b-5p mimic 和NEAT1-WT 共转染组的荧光素酶活性降低(P<0.05);与mimic NC 和NEAT1-MUT 共转染组比较,miR-125b-5p mimic 和NEAT1-MUT 共转染组荧光素酶活性差异无统计学意义(P>0.05)。与mimic NC 和IGFBP5-WT 共转染组比较,miR-125b-5p mimic 和IGFBP5-WT 共转染组的荧光素酶活性降低(P<0.05);与mimic NC 和IGFBP5-MUT 共转染组比较,miR-125b-5p mimic 和IGFBP5-MUT 共转染组荧光素酶活性差异无统计学意义(P>0.05),见表6。

图1 Starbase 网站预测NEAT1 与miR-125b-5p,miR-125b-5p 与IGFBP5 的结合位点
表6 荧光素酶活性比较(±s,n=6)
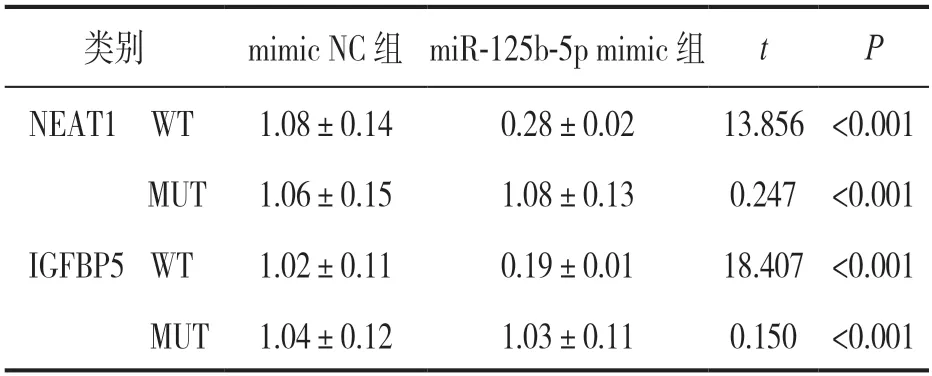
表6 荧光素酶活性比较(±s,n=6)
类别mimic NC 组 miR-125b-5p mimic 组tP NEAT1 WT1.08±0.140.28±0.0213.856<0.001 MUT1.06±0.151.08±0.130.247<0.001 IGFBP5 WT1.02±0.110.19±0.0118.407<0.001 MUT 1.04±0.121.03±0.110.150<0.001
3 讨论
作为婴儿期最常见的血管性肿瘤,血管瘤病变的位置和大小可能对婴儿视力甚至生命构成威胁[9]。目前,如何制定有效的血管瘤治疗策略在近年来受到极大关注,这可能取决于对婴儿血管瘤发病机制的充分了解[10]。因此探究婴儿血管瘤进展的分子机制具有重要意义。
LncRNA 属于长度超过200 nt 的非编码RNA家族。虽然缺乏蛋白质编码潜力,但LncRNA 作为基因表达网络中的重要调节因子,其在细胞增殖、发育和分化中发挥重要作用[11]。越来越多的研究表明LncRNA 在调控肿瘤进展中发挥重要的作用。NEAT1 作为一种LncRNA,参与癌症的不同生物学过程。如敲除NEAT1 后,胃癌细胞增殖和转移受到抑制,而细胞凋亡速度加快[12];NEAT1 在胶质瘤组织和细胞中高表达,敲低NEAT1 可抑制胶质瘤进展[13];NEAT1 的下调显著抑制了HemECs 细胞活力和细胞迁移,但增加了凋亡细胞数量[14];沉默NEAT1 表达能够抑制胰腺癌细胞增殖,并诱导细胞凋亡[15];转染si-NEAT1 可抑制口腔鳞癌细胞增殖,促进细胞凋亡[16]。表明NEAT1 在胃癌、胶质瘤、血管瘤、胰腺癌、肝癌等肿瘤中具有促癌的作用。本研究结果与其是一致的,本研究显示,NEAT1 在血管瘤组织和细胞中均高表达,且NEAT1 在血管瘤细胞HemECs 中的表达量最高,因此,选择HemECs 细胞为研究对象。此外,本研究还发现沉默NEAT1 可抑制HemECs 细胞增殖、迁移,促进细胞凋亡,表明沉默NEAT1 抑制血管瘤的进展。提示NEAT1 可能成为治疗血管瘤的潜在有效靶点。
LncRNA 可通过海绵化miRNA 来发挥作用。为了进一步探究沉默NEAT1 抑制血管瘤的进展的分子机制,本研究通过starBase 数据库预测NEAT1可能充当miR-125b-5p 的海绵。miR-125b-5p 作为众多miRNAs 中的一种,已有研究报道,过表达miR-125b-5p 可抑制非小细胞肺癌细胞增殖和血管生成[17];上调miR-125b-5p 抑制了肝癌细胞的生长和转移[18];上调miR-125b 的表达可抑制婴儿血管瘤细胞的生长并促进细胞凋亡[19];过表达miR-125b-5p 可减弱胃癌细胞恶性表型[20];下调miR-125b-5p 可促进宫颈癌的进展[21]。以上研究表明miR-125b-5p 在多种肿瘤中发挥肿瘤抑制因子的作用。此外,已有研究表明,抑制NEAT1 通过上调miR-125b-5p 来抑制高糖诱导的人视网膜微血管内皮细胞增殖、迁移和血管生成[22]。本研究结果与其是一致的,本研究显示,NEAT1 与miR-125b-5p存在靶向关系,沉默NEAT1 可上调HemECs 细胞中miR-125b-5p 表达,推测沉默NEAT1 可能通过上调miR-125b-5p 表达抑制HemECs 细胞增殖、迁移,促进细胞凋亡。为了验证该推测,本研究在沉默NEAT1 的基础上再进行miR-125b-5p inhibitor 干预HemECs 细胞,结果显示,miR-125b-5p inhibitor减弱了沉默NEAT1 对HemECs 细胞增殖、迁移的抑制作用,以及细胞凋亡的促进作用。证实了沉默NEAT1 可能通过上调miR-125b-5p 抑制HemECs 细胞增殖、迁移,促进细胞凋亡。
miRNA 可通过与其靶基因的3’-UTR 结合来调控癌症的进展[23]。为了进一步探究NEAT1/miR-125b-5p 轴抑制血管瘤进展的分子作用机制,本研究通过双荧光素酶报告基因证实miR-125b-5p 可靶向调控IGFBP5 表达。IGFBP5 是生长促进肽胰岛素超家族的成员,已被证实是最丰富的多肽生长因子。其在肿瘤中的作用已被广泛研究,如IGFBP5在结直肠癌组织中高表达,其高表达与血管生成和血管内皮生长因子等多种促癌机制有关[24];抑制IGFBP5 可抑制膀胱癌转移[25];IGFBP5 在HemECs细胞中高表达,沉默IGFBP5 可抑制HemECs 细胞增殖、迁移和侵袭[8]。本研究与其是一致的,本研究显示IGFBP5 在血管瘤组织和HemECs 细胞中高表达,沉默NEAT1 后,miR-125b-5p 表达上调,IGFBP5 蛋白表达下调,在沉默NEAT1 的基础上再加miR-125b-5p inhibitor 干预HemECs 细胞,结果显示,HemECs 细胞中miR-125b-5p 表达降低,IGFBP5 蛋白表达升高,提示沉默NEAT1 可能通过海绵化miR-125b-5p 进而下调IGFBP5 来抑制HemECs 细胞增殖、迁移,促进细胞凋亡。NEAT1/miR-125b-5p/IGFBP5 是一条介导HemECs 细胞增殖、迁移、凋亡发生的全新调控通路,本研究首次阐明了通路中各分子之间的调控机制。这对于进一步完善血管瘤发生的分子机制具有重要意义。
综上所述,沉默NEAT1 可能通过海绵化miR-125b-5p 进而下调IGFBP5 表达来抑制HemECs 细胞增殖、迁移,促进细胞凋亡。NEAT1 可能成为治疗血管瘤的潜在靶点。未进行体内动物实验进行验证是本研究的不足之一,后期将会进一步深入探究。

