参附注射液对阿尔茨小鼠认知功能的改善作用及机制
宋志勇 穆亚敏 汪勇 李芳芳
阿尔茨海默病(Alzheimer disease,AD)以记忆能力下降和行为异常等为主要临床表现,其主要病理机制为脑组织的氧化性应激导致神经元细胞丢失或凋亡,进而引发脑组织结构改变,导致患者记忆功能障碍[1]。目前临床主要采用西药(如盐酸多奈哌齐)治疗,虽能缓解患者临床症状,但患者可出现心血管以及胃肠道等系统的不良反应。研究显示中医药在改善AD患者的记忆和学习障碍方面显示了较为满意疗效[2]。参附注射液是由人参、黑附子等中药提取而成的中成药注射剂,在临床上广泛用于慢性心衰、心肌梗死、失血性休克等心血管疾病的治疗[3]。近年来研究结果显示参附注射液对神经细胞具有良好的保护作用,但具体机制尚未阐明[4]。胚胎发育相关音速波状蛋白(sonic hedgehog,SHH)通路在细胞生长、分化、凋亡以及衰老等生物学过程中发挥重要作用,参与组织损伤的修复、炎性反应与氧化应激等病理生理过程[5]。Yu等[6]研究发现,激活SHH通路能明显抑制大脑中动脉闭塞/再灌注大鼠模型神经元的异常凋亡,改善大鼠神经功能缺损。SHH信号是否参与AD进展尚不清楚。本研究参照Xiong等[7]制备AD小鼠,从SHH 信号入手,以SHH信号特异性抑制剂环巴胺(cyclopamine,CPA)行挽救实验,探讨参附注射液对AD小鼠脑组织的保护作用及可能机制,为疾病的临床治疗提供新的角度。
1 材料和方法
1.1 动物雄性7~8周龄SPF级C57BL/6小鼠60只,平均体重为(28±3)g,购自上海泰槿生物技术有限公司湘潭分公司〔动物生产许可证号SCXK(湘)2022-0004〕。小鼠经适应性喂养1周后用于实验。喂养条件:12 h明/暗交替,相对湿度(50±5)%,温度(23±2)℃,标准饲料,自由饮水与摄食。按照随机数字表法将小鼠分为正常组、AD模型组、参附注射液(低、中、高剂量)干预组、参附注射液+CPA干预组(以下简称CPA干预组),每组10只。本研究经医院动物伦理委员会审批通过(2022-0725-6M188)。
1.2 主要试剂和仪器参附注射液(10 mL/支,国药准字Z20043117;雅安三九药业有限公司),D-半乳糖(山东富禾生物科技有限公司),CPA(美国Sigma公司),兔抗小鼠SHH、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、B细胞白血病-淋巴瘤-2相关蛋白(Bcl-2 associated X protein,Bax)、β淀粉样蛋白(amyloid-beta peptide,Aβ)、甘油醛三磷酸脱氢酶(glyc-eraldehyde-3-phosphate dehydroge-nase,GAPDH)单克隆抗体(美国Santa Cruz公司),苏木精-伊红染色(hematoxylin-eosin staining,HE)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)ELISA试剂盒、TUNEL染色试剂盒(南京建成生物技术有限公司),TRIzol试剂、逆转录试剂盒、实时荧光定量反转录-PCR(rRT-PCR)试剂盒(大连TaKaRa公司),免疫组化、蛋白质免疫印迹(Western blot)试剂盒(北京中杉金桥有限公司),PBS(上海碧云天生物技术有限公司)。低温石蜡切片机(德国徕卡公司),光学显微镜(日本 Olympus公司),凝胶成像系统、电泳槽、PCR扩增仪(美国Bio-Rad公司),超净工作动台(江苏荣华仪器制造有限公司),JEM-3300透射电镜(日本电子株式会社),BXS-201小鼠跳台实验仪(北京北广精仪仪器设备有限公司),BA-200避暗自动测试仪(成都泰盟科技有限公司)。
1.3 方法
1.3.1AD模型制备及分组:参考Xiong等[7]方法制备AD小鼠模型。按体重0.14 g/(kg·d)给予小鼠皮下注射1% D-半乳糖,连续3周;随后按体重2 mg /(kg·d)腹腔注射东莨菪碱,持续注射2周后对小鼠进行评估,行走时出现原地转圈或无法行走等现象视为造模成功。正常组小鼠以相同方法给予生理盐水。低、中、高剂量参附注射液组小鼠于造模开始后分别按体重10、15、20 mL/(kg·d)接受参附注射液灌胃,CPA干预组小鼠于造模开始后按体重20 mL/kg接受参附注射液灌胃,同时按体重5 mg/kg给予腹腔注射CPA,连续给药8周;正常组和AD模型组小鼠按相同方法给予生理盐水替代。
1.3.2记忆功能检测[8]:结束给药后,所有小鼠进行小鼠跳台实验和避暗自动测试仪检测,记录小鼠的潜伏时间(小鼠第一次跳下跳台后进入暗室的时间)和错误次数(小鼠5 min内跳下跳台的次数)。
1.3.3小鼠脑组织病理检测:记忆功能检测完毕后,处死各组小鼠,并剪取每只小鼠1 g脑组织,将脑组织置10%(质量浓度)中性甲醛进行固定并切片(片厚约为4 μm),行HE染色、封片,置显微镜下观察小鼠脑组织的病理改变。
1.3.4小鼠脑组织细胞凋亡检测:剪取每只小鼠1 g脑组织,置10%(质量浓度)中性甲醛缓冲液固定后包埋、切片(片厚约为4 μm),行TUNEL染色、孵育,置荧光显微镜下观察细胞凋亡情况。
1.3.5脑组织SOD和MDA测定:剪取每只小鼠1 g脑组织,经裂解、离心后按ELISA试剂盒步骤测定各组小鼠脑组织SOD和MDA水平。
1.3.6小鼠脑组织Aβ表达检测:采用免疫组化法进行检测。剪取每只小鼠1 g脑组织,常规固定、脱水、包埋、切片,封闭玻片,加入已稀释好的兔抗小鼠Aβ抗体(1∶500),置于4℃下,孵育24 h,PBS洗涤,加入二抗(1∶1500),用苏木精复染,显微镜下观察,视野中出现棕黄色颗粒表示Aβ阳性细胞表达。
1.3.7各组小鼠脑组织SHH通路蛋白mRNA表达检测[9]:采用rRT-PCR法进行检测。剪取每只小鼠1 g脑组织,TRIzol法提取总RNA,并逆转录成cDNA。采用SYBR® Premix Ex TaqTMⅡ试剂盒在ABI 7500 Fast系统上进行qPCR扩增。U6用作加载对照参照,通过2-ΔΔCt计算跨膜蛋白受体1(Patched1,Ptch1)、跨膜蛋白(Smoothened,SMO)、锌指转录因子1(glioma-associated oncogene family zinc finger1,GLI1)基因相对表达水平。qPCR扩增引物序列见表1。

表1 RNA的引物序列
1.3.8Western blot检测:剪取每只小鼠1 g脑组织,常规提取总蛋白,电泳分离,转膜,清洗,封闭,置室温下孵育2 h,加入一抗(1∶500),孵育过夜,加入二抗(1∶1 000),显色,以GAPDH作为内参。检测各组小鼠脑组织SHH、Ptch1、SMO、GLI1、Bax、Bcl-2蛋白的表达。
1.4 统计学处理采用SPSS16.0软件进行统计分析,采用Shapiro-Wilk法和Brown-Forsythe法分别对数据进行正态性和方差齐性检验,符合正态分布的计量资料以均数±标准差表示,多组均数间比较采用单因素方差分析,两两比较采用Dunnett法。以P<0.05表示差异具有统计学意义。
2 结果
2.1 各组小鼠记忆功能比较与正常组相比,AD模型组、参附注射液(低、中、高剂量)干预组、CPA干预组小鼠的记忆潜伏时间下降(均P<0.05),错误次数增多(均P<0.05);与AD模型组相比,参附注射液(低、中、高剂量)干预组、CPA干预组小鼠的记忆潜伏时间升高(均P<0.05),错误次数下降(均P<0.05),且具有明显的剂量依赖性(均P<0.05);与参附注射液高剂量干预组相比,CPA干预组小鼠的记忆潜伏时间下降,错误次数升高(均P<0.05),见表2。
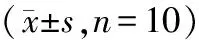
表2 各组小鼠跳台实验和避暗实验检测结果比较
2.2 各组小鼠脑组织病理检测HE染色结果显示,正常组小鼠脑组织细胞结构清晰可辨,胞膜完整,细胞质内细胞器未见异常;AD模型组小鼠脑组织细胞排列紊乱,胞膜或凹陷或缺损,胞间质中大量炎性细胞浸润,胞核明显缩小,核膜破裂,线粒体呈现空泡样变性,染色体固缩严重;与AD模型组相比,参附注射液(低、中、高剂量)干预组小鼠脑组织病理损伤明显改善,炎性浸润明显减轻,染色体固缩明显缓解,其中高剂量组小鼠脑组织的细胞状态趋于正常;而CPA干预组小鼠脑组织病理损伤较参附注射液高剂量干预组明显加重,细胞界限趋于模糊,核质界限不明朗。结果见图1。
2.3 各组小鼠脑组织细胞凋亡率和Aβ表达与正常组比较,AD模型组、不同浓度参附注射液干预组及CPA干预组小鼠脑组织细胞凋亡率和Aβ表达升高(均P<0.05);与AD模型组比较,CPA干预组以及参附注射液低、中、高剂量干预组小鼠脑组织细胞凋亡率和Aβ表达降低(均P<0.05),且具有明显的剂量依赖性(均P<0.05);与参附注射液高剂量干预组小鼠比较,CPA干预组脑组织细胞凋亡率和Aβ表达明显升高(均P<0.05)。结果见图2~3,表3。
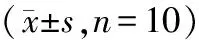
表3 各组小鼠脑组织细胞凋亡及SOD、MDA及Aβ表达情况比较
2.4 各组小鼠脑组织SOD和MDA水平比较与正常组相比,AD模型组、CPA干预组、参附注射液低、中、高剂量干预组小鼠脑组织SOD水平明显降低,MDA水平明显升高(均P<0.05);与AD模型组相比,CPA干预组以及参附注射液低、中、高剂量组小鼠脑组织SOD水平明显升高,MDA水平降低(均P<0.05),且具有明显的剂量依赖性(均P<0.05);与参附注射液高剂量组相比,CPA干预组小鼠脑组织SOD水平明显降低,MDA水平明显升高(均P<0.05)。结果见表3。
2.5 各组小鼠脑组织Ptch1、SMO、GLI1表达与正常组相比,AD模型组、CPA干预组以及不同剂量参附注射液干预组小鼠脑组织Ptch1、SMO、GLI1 mRNA表达明显降低(均P<0.05);与AD模型组相比,CPA干预组以及不同剂量参附注射液干预组小鼠脑组织Ptch1、SMO、GLI1 mRNA表达明显升高(均P<0.05),且具有明显的剂量依赖性(均P<0.05);与参附注射液高剂量组相比,CPA干预组小鼠脑组织Ptch1、SMO、GLI1 mRNA表达降低(P<0.05)。结果见表4。
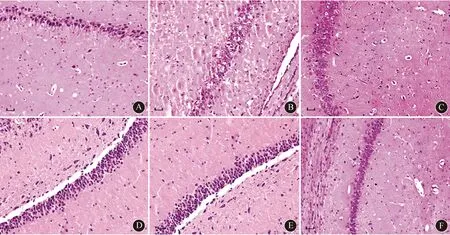
注:AD:阿尔茨海默病;CPA:环巴胺;A:正常组;B:AD模型组;C:参附注射液低剂量组;D:参附注射液中剂量组;E:参附注射液高剂量组;F:CPA干预组
注:AD:阿尔茨海默病;CPA:环巴胺;A:正常组;B:AD模型组;C:参附注射液低剂量组;D:参附注射液中剂量组;E:参附注射液高剂量组;F:CPA干预组
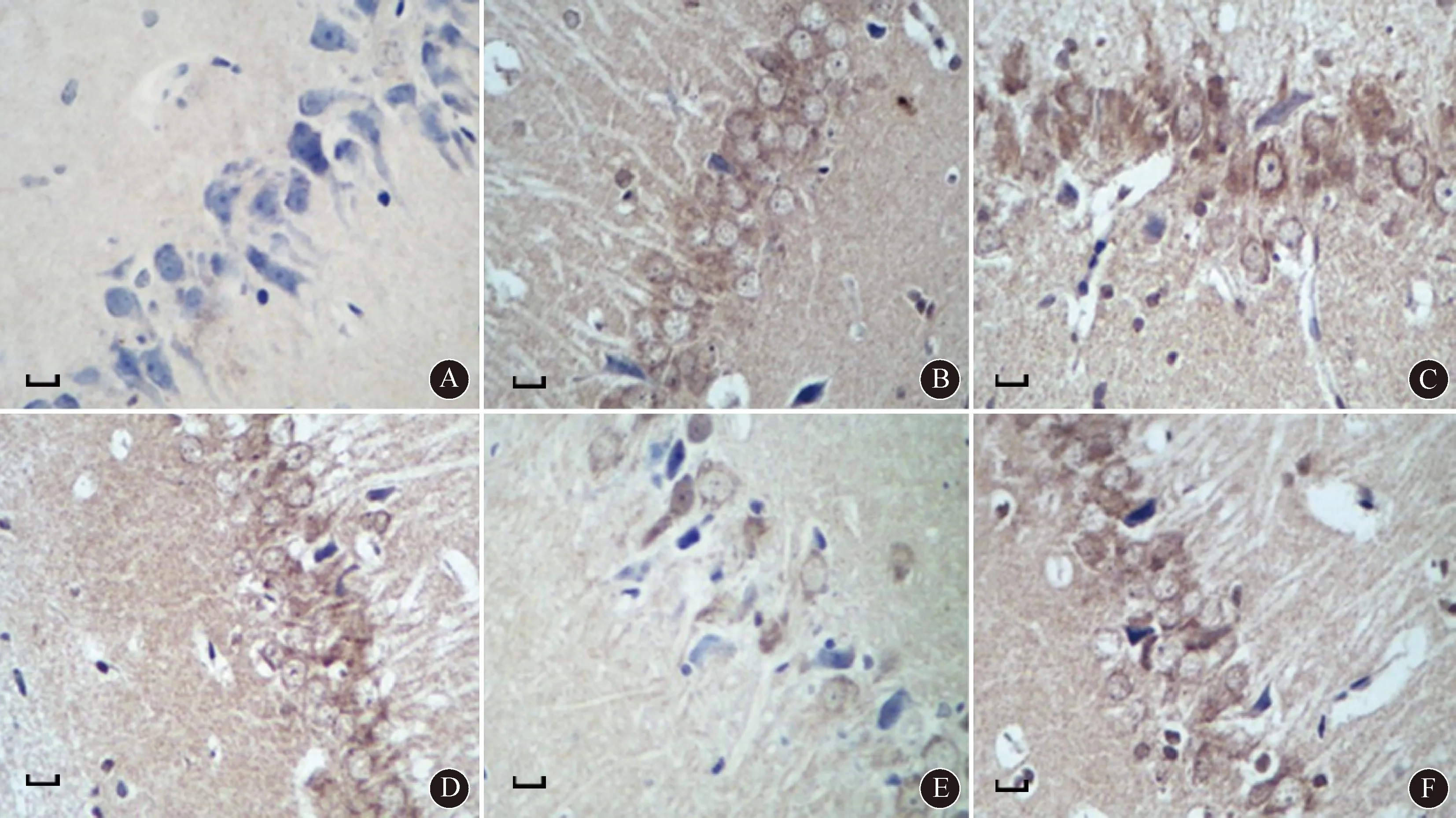
注:AD:阿尔茨海默病;CPA:环巴胺;A:正常组;B:AD模型组;C:参附注射液低剂量组;D:参附注射液中剂量组;E:参附注射液高剂量组;F:CPA干预组
表4 各组小鼠脑组织Ptch1、SMO、GLI1mRNA相对表达水平比较
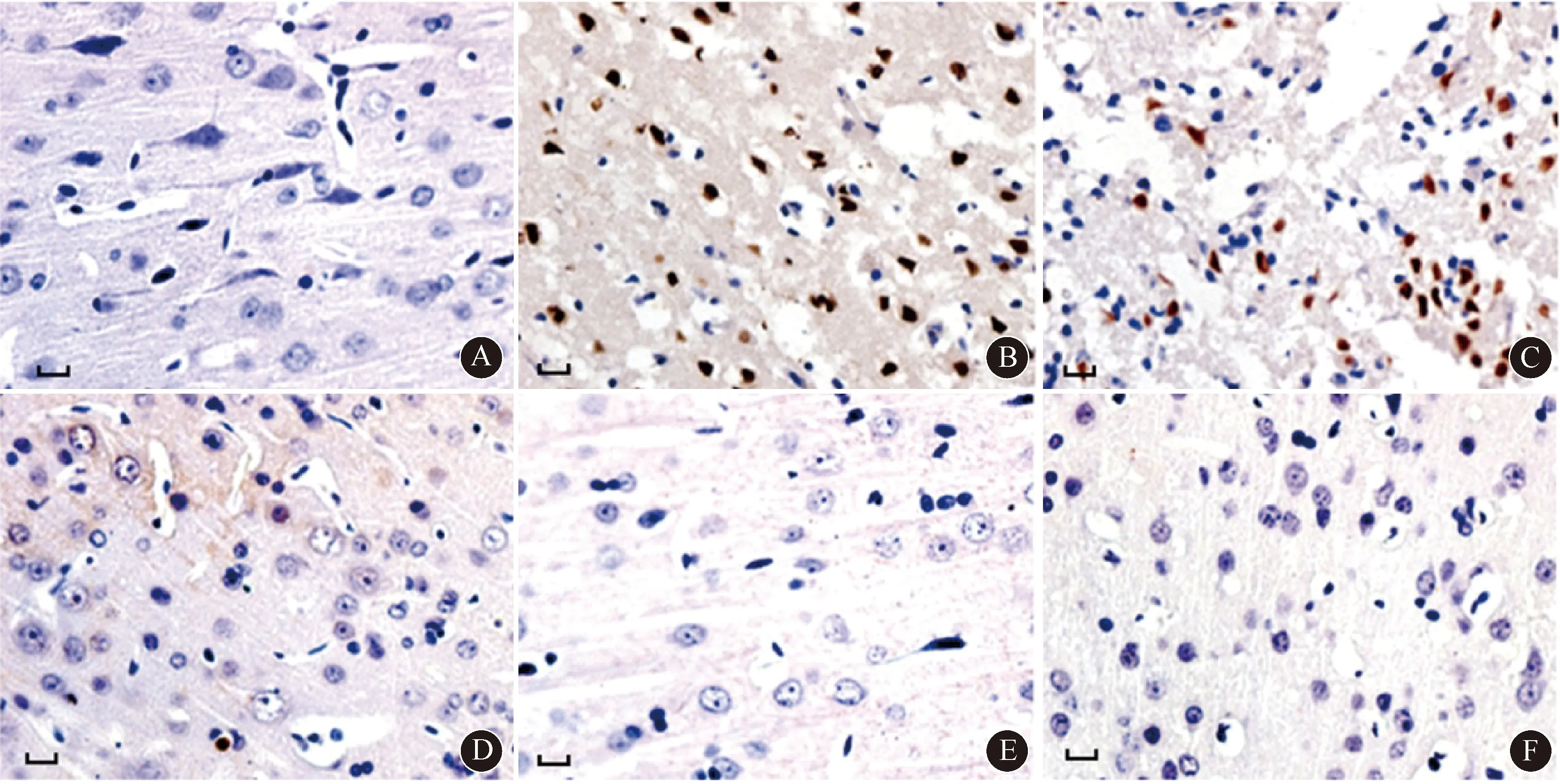
2.6 各组小鼠脑组织SHH、Ptch1、SMO、GLI1、Bcl-2、Bax蛋白表达与正常组相比,AD模型组、CPA干预组以及不同剂量参附注射液干预组小鼠脑组织SHH、Ptch1、SMO、GLI1、Bcl-2表达降低,Bax 表达明显升高(均P<0.05);与AD模型组相比,CPA干预组以及不同剂量参附注射液干预组小鼠脑组织SHH、Ptch1、SMO、GLI1、Bcl-2表达升高,Bax 表达降低(均P<0.05),且具有明显的剂量依赖性(P<0.05);与参附注射液高剂量组相比,CPA干预组小鼠脑组织SHH、Ptch1、SMO、GLI1、Bcl-2表达降低,Bax 表达升高(均P<0.05)。结果见图4、5。

注:SHH:胚胎发育相关音速波状蛋白;Ptch1:跨膜蛋白受体1;SMO:跨膜蛋白;GLI1:锌指转录因子1;Bcl-2:B淋巴细胞瘤-2;Bax:B细胞白血病-淋巴瘤-2相关蛋白;AD:阿尔茨海默病;CPA:环巴胺;1、2、3:分别为参附注射液低、中、高剂量干预组
3 讨论
AD患者具有智力低下、情感障碍以及日常生活不能自理等特点,目前尚无有效的治疗方案。随着我国老龄化社会的进展,该病发病率逐年升高,给患者家庭带来沉重负担,给我国公共卫生事业的可持续发展带来严峻的挑战[10]。因此,寻找一种可靠的有效的治疗方案具有重要意义。
本研究参考文献[7]方法制备AD模型,给予小鼠皮下注射1%D-半乳糖可导致小鼠出现亚急性衰老状态,接着给予腹腔注射东莨菪碱来损伤胆碱能受体,进而制备AD小鼠,更加贴合机体内AD复杂而又有步骤的病理变化过程。本研究结果显示,AD模型组小鼠较正常组小鼠记忆功能明显下降,脑组织病理损伤明显加重,脑组织Aβ富集,表明AD造模成功。

注:SHH:胚胎发育相关音速波状蛋白;Ptch1:跨膜蛋白受体1;SMO:跨膜蛋白;GLI1:锌指转录因子1;Bcl-2:B淋巴细胞瘤-2;Bax:B细胞白血病-淋巴瘤-2相关蛋白;AD:阿尔茨海默病;CPA:环巴胺;与正常组相比,aP<0.05;与AD模型组相比,bP<0.05;与参附注射液低剂量组相比,cP<0.05;与参附注射液中剂量组相比,dP<0.05;与参附注射液高剂量组相比,eP<0.05
AD的病理机制尚处在实验探究阶段,其中自由基富集、胰岛素相关糖代谢异常、淀粉样蛋白(如Aβ表达骤增)积聚、氧化以及炎性应激均在AD的病理进展中发挥作用。毋庸置疑的是,AD患者脑组织中神经元细胞的异常凋亡或丢失可导致患者出现记忆功能障碍[11]。目前,西药疗效的不稳定性、肝肾毒作用以及对胃肠道的刺激作用成为AD临床治疗的困扰。中药中某些具有特异性结构的药物前体或提取物因其作用靶点明确、副反应小、来源广泛成为国内外研究学者的聚焦点。参附注射液是参照传统益气固脱名方参附汤结合现代中药制药工艺研制而成,其主要活性组分是人参皂苷和乌头碱类生物碱,具有降血脂、抗血栓、延缓动脉粥样硬化、抗氧化以及稳定斑块的作用[12]。Gu等[13]研究表明,参附注射液能够抑制心肌细胞的氧化应激,改善心脏停搏复苏猪的心功能障碍。陈瑞娟等[14]研究显示,参附注射液能够下调血管内皮细胞的氧化应激程度,抑制由此导致的细胞凋亡,缓解血管内皮损伤。卢玺宇等[15]研究证实将参附注射液用于辅助治疗急性重型脑外伤的临床干预中,有助于帮助患者恢复神经功能,缩短住院时间,提升治疗效果。目前有关参附注射液在AD中的治疗研究报道较少。本研究结果显示,与模型组相比,参附注射液低、中、高剂量组小鼠记忆功能明显好转,脑组织中Aβ的表达明显降低,脑组织病理损伤明显减轻,细胞的凋亡率明显下降,脑组织中抗氧化酶SOD的含量明显升高,物质过氧化产物MDA的含量明显降低,细胞的凋亡率明显下降,这些指标的变化均具有明显剂量依赖性,表明参附注射液可通过抑制氧化应激和细胞凋亡来干预AD疾病进展,缓解脑组织病理损伤,进而改善实验小鼠记忆功能。
深入揭示药物的作用靶点,不仅有助于阐明疾病进展的分子机制,还有助于药物在临床治疗领域的推广应用。研究表明,AD是多基因调控下多种靶细胞协同作用的共同结果,此过程中还涉及许多信号通路的参与[16]。SHH基因定位在染色体7q36,其编码的蛋白是一种具有种属特异性的糖蛋白。SHH信号主要由SHH、Ptch1以及其系列蛋白因子、SMO、胶质转录因子GLI1以及其系列蛋白等组成。AD病理进展中Aβ的大量聚集导致脑组织出现较为严重的氧化应激,脑组织中SOD和MDA水平失调,导致SHH的转录以及合成受阻,进而其跨膜受体Ptch1的表达下调,偶联受体跨膜蛋白SMO以及下游核转录因子GLI1的转导受限,SHH通路的传导受阻,细胞核内抗凋亡Bcl-2与促凋亡Bax蛋白的表达失衡,脑组织产生大量的神经元细胞凋亡[17]。Zhao等[18]研究显示,在大脑中动脉闭塞大鼠模型中,激活SHH通路能明显改善实验动物的记忆缺损,缓解动物脑组织的病理和超微结构损伤。本研究结果显示,与AD模型组相比,不同剂量参附注射液干预组小鼠脑组织Ptch1、SMO、GLI1 mRNA表达升高,SHH蛋白表达升高,以及Bcl-2和Bax 表达失衡明显缓解,经SHH特异性抑制剂CPA干预后显示,CPA能部分逆转参附注射液对脑组织的神经保护作用,表明参附注射液能够激活SHH通路的传导。
综上所述,参附注射液能明显降低AD模型小鼠脑组织的氧化应激,下调脑组织神经元的凋亡,缓解AD小鼠的脑损伤,其作用机制可能与激活SHH信号有关。但是将参附注射液引入AD的临床治疗时,仍需结合患者个体病情进展的状况,给予合适的剂量以及频次。

