苦草对沉积物-水界面不同形态砷的削减
燕文明, 蒋 超,陈 红,陈 翔,王小林,吴 斌,宋勇锋
(1.河海大学水文水资源与水利工程科学国家重点实验室,江苏 南京 210098; 2.河海大学实验与分析测试中心,江苏 南京 210098)
砷(As)是一种象牙色的类金属,能在270℃时转变为金属样形式[1],被广泛应用于医学、畜牧养殖、电子和冶金等领域[2]。早在2003年,中国地方性砷中毒分布调查协作组发现,中国受砷中毒影响人口达234万,高砷暴露人口52万;此外,智利的3个州有43万人受到砷污染的危害[3];石臼湖中砷的浓度超过了江苏省的土壤重金属背景值[4]。近年来,砷污染已成为全球性问题,砷被国际癌症研究机构认定为致癌物质[5]。环境中的砷以三价砷(As(Ⅲ))、五价砷(As(Ⅴ))和有机砷的形态存在,以As(Ⅲ)和As(Ⅴ)为主。砷形态极易受氧化还原条件、pH值、Fe(Ⅱ)/Fe(Ⅲ)、有机物、悬浮颗粒和微生物活动等环境因素的影响[6]。形态不同的As所产生的生态效应也不同,As(Ⅲ)的毒性是As(V)的60倍,是甲基砷的70倍[7]。As(Ⅲ)和As(Ⅴ)易被地表广泛存在的铁、锰化合物吸附聚集,污染土壤和沉积物[8],目前我国沿海区域沉积物中As的平均质量分数已接近10 mg/kg[9]。As(Ⅲ)比较活跃,沉积物间隙水中的As(Ⅲ)可释放进入上覆水中[10],而进入水环境的As污染物可通过食物链最终影响人体健康[11]。
沉积物-水界面中的As去除效果取决于复杂的物理、化学和生物作用,影响因素众多,作用机制复杂,一直是重金属内源污染研究和治理的难点。砷污染是可治理的,如淮河干流中的砷就得到了控制[12]。目前砷去除方法有生物炭吸附、离子交换、植物修复、膜技术和沉淀絮凝等[1,13-15]。生物炭/铁酸锰能对Zn2+和Cu2+两种重金属离子起到较好的吸附效果[16],铁锰可能在砷的吸附上也会有较好的效果。崔晓倩等[17]发现莱茵衣藻能够影响自由金属离子的溶出;刘爱荣等[18]指出,纳米零价铁可以有效去除废水中的砷。砷还可以通过植物光合作用和呼吸作用调节次级代谢产物[1],五价砷酸盐与磷酸盐有相似的化学性质,能共用高等植物中的转运蛋白被植物一同吸收,有些耐砷植物可通过改变转运蛋白的表达来控制砷的吸收[8,19]。陈同斌等[20]率先在中国境内找到并发现了蜈蚣草对砷的高富集性;Kumar等[21]证实了胭脂树叶生物吸附剂能够去除水中的As;陈国粱[22]通过培养试验对比研究了苦草、狐尾藻、黑藻、菹草、金鱼藻等沉水植物对沉积物砷的富集能力,发现苦草的富集能力最强。一般而言,水生植物对水环境中重金属去除效果的顺序为:沉水植物大于漂浮植物、浮叶植物大于挺水植物[23]。可见,植物的同化吸收作用可以从土壤和沉积物中移除As。研究植物对沉积物中砷的去除对人体健康和生态安全具有重要意义。本文以富营养化底泥和常见沉水植物苦草为研究对象,基于微电极分析技术和高分辨率扩散平衡式间隙水采集(HR-Peeper)技术,从微尺度精准评估苦草对沉积物-水界面中As形态的影响。
1 材料与方法
1.1 研究区域概况
本文所用水样和沉积物样品均采集于太湖梅梁湾。梅梁湾位于太湖北部区域,面积约123km2,多年平均水深介于1.8~2.3 m之间。近年梅梁湾长期存在水体富营养化及与富营养化相关的问题。
1.2 室内试验设计与试验材料
底泥样品用重力取样器(直径9cm、长50cm)采集在同一地点柱芯深度25cm左右的柱状样。湖水用5L采水器采集,并暂存于25L塑料桶中。样品采集完成后尽快运至实验室。随后,将沉积柱每2cm切割,并将相同的沉积层放在一起搅拌混匀。然后,使用100目的筛网从沉积物中去除大颗粒和大型底栖动物。根据原深度回填规则混匀过筛后的底泥,将8层(约16cm)的底泥装入6根有机玻璃管(内径9cm、长度30cm)。向每个沉积柱中注入过滤后的湖水,确保上覆水的深度在10cm左右。最后,将所有沉积柱放入水箱中(长70cm、宽50cm、高65cm)培养2周。
过滤后的湖水水质指标如下:湖水As质量浓度为1.22μg/L,TOC、TN、TP、磷酸根分别为7.43mg/L,0.93mg/L,0.04mg/L,0.02mg/L,pH值为7.57。用离心法得到过筛混匀后分层底泥的间隙水,测定间隙水中溶解态As、As(Ⅲ)和As(Ⅴ)的质量浓度(表1)。
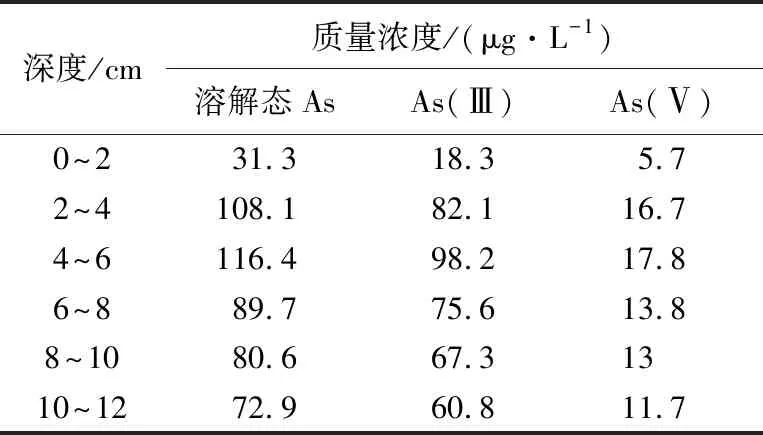
表1 过筛混匀后的间隙水中溶解态As、As(Ⅲ)和As(Ⅴ)质量浓度
稳定两周后,取出沉积柱,在其中3根沉积柱中种植苦草,作为苦草组,苦草的种植密度为157.2株/m2;剩余3根不处理,作为对照组。分别将苦草组和对照组置于2个水箱中淹没培养,并用LED灯补充光照,在前15d对两个水箱进行曝气,以确保苦草的成活率,15d后取消曝气。
1.3 样品采取和分析
对苦草的生长初期,快速生长期以及稳定生长期内沉积物变化进行观察,分别在第15天、第35天、第66天进行取样观测。在每个采样时间点,先用微电极(OXO -50,Unisense,丹麦)测量苦草组和对照组沉积物-水界面中的pH值和DO浓度。然后,投入HP-Peeper装置(购自南京智感环境科技有限公司),平衡时间为48 h。移除HR-Peeper装置后,从每个HR-Peeper小室收集大约400 uL的水样,用邻菲咯啉比色法在多功能酶标仪(M2e,Molecular Devices,美国)上测定可溶性Fe(Ⅱ)[24]。取一定量样品添加3%HNO3酸化后,用ICP-MS(NEXION350 X,PerkinElmer,美国)测量溶解态As和溶解态Mn的质量浓度。本试验中所用的化学试剂均为分析纯。
1.4 数据分析
采用SPSS 25.0软件(US SPSS)和Excel 2013进行统计分析,图形均用Origin 2019软件绘制。
2 结果与分析
2.1 沉积物pH值和DO浓度变化
对照组和苦草组沉积物-水界面pH值和DO浓度变化如图1所示。对照组与苦草组沉积物-水界面的pH值介于7~8.5之间,整体为弱碱性。试验过程中,苦草组的pH平均值低于同期对照组。在种植苦草后的第15天、第35天、第66天,苦草组的pH平均值分别降低了2.20%、2.64%、0.77%。从图1可知,整个试验阶段,沉积物-水界面中DO浓度平均值苦草组高于同期对照组:前2个试验阶段(第15天和第35天),苦草组略高于同期对照组;而到第66天时,苦草组显著高于同期对照组,高约137%。这可能是因为在第66天时,苦草的植株和根系较幼苗时期(第15天、第35天)深长,光合作用更强,进而提升了根际区间的DO浓度。在种植苦草后的第15天、第35天、第66天,苦草组的溶解氧渗透深度(OPD)分别为40mm、17mm、31mm,对照组的OPD分别为23mm、11mm、19mm。可见,试验过程中苦草组的OPD均高于同期对照组。
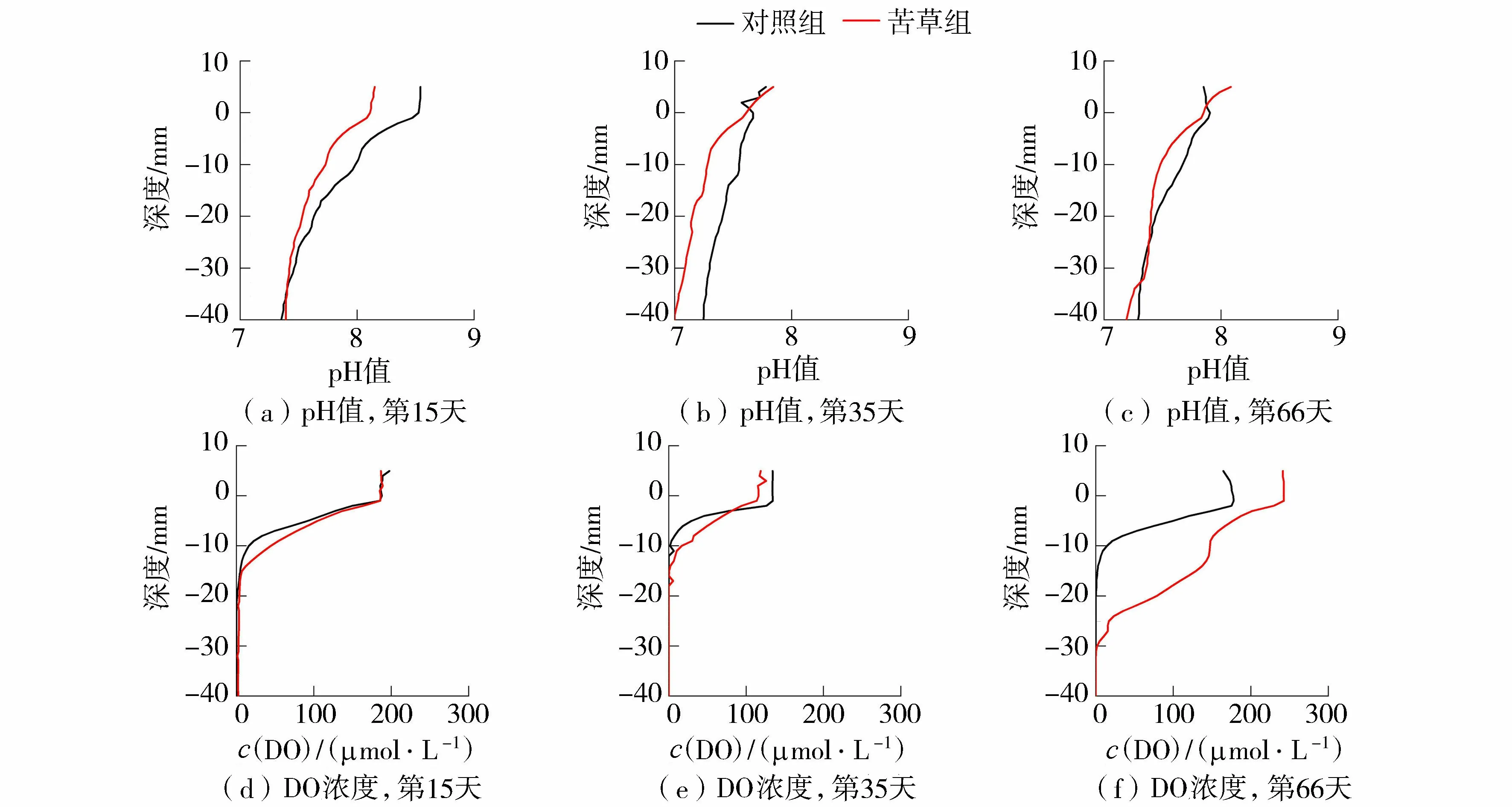
图1 沉积物-水界面pH值与DO浓度的垂向变化特征
2.2 沉积物间隙水中溶解态Fe(Ⅱ)/溶解态Mn质量浓度和UV254的变化
沉积物间隙水中的溶解态Fe(Ⅱ)质量浓度变化如图2所示。在3个试验阶段,苦草组的溶解态Fe(Ⅱ)质量浓度平均值都小于同期对照组。在试验开始后的第15天、第35天、第66天,苦草组的溶解态Fe(Ⅱ)质量浓度分别是同期对照组的40.51%、75.80%、68.93%。苦草组与对照组溶解态Fe(Ⅱ)质量浓度平均值的最大差异出现在试验初期的第15天。在3次取样结果中,苦草组与对照组中溶解态Fe(Ⅱ)在表层0~-20mm范围内差异较小,而在-20~-80mm范围内出现显著差异,苦草组Fe(Ⅱ)质量浓度显著降低。
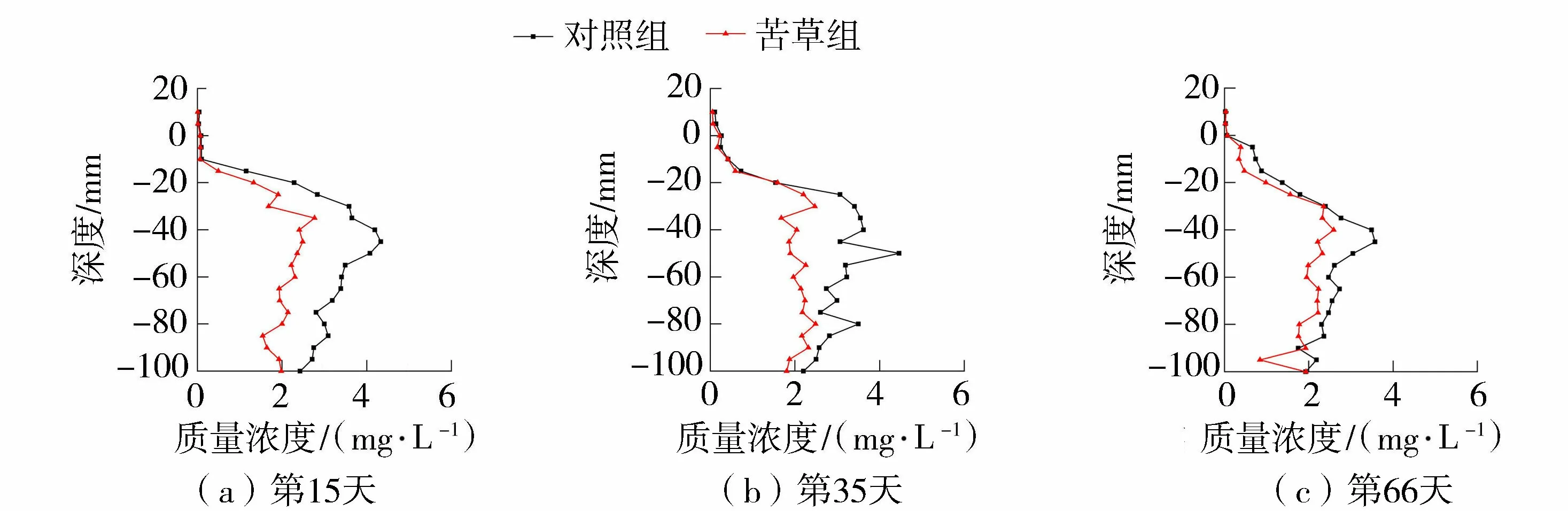
图2 沉积物溶解态Fe(Ⅱ)质量浓度变化趋势
在试验开始后的第15天、第35天、第66天,苦草组沉积物间隙水中溶解态Mn质量浓度平均值都小于同期对照组(图3),苦草组溶解态Mn质量浓度分别是同期对照组的65.83%、82.37%、94.56%。可见,随着试验的进行,两组之间的溶解态Mn质量浓度差异逐渐减小。
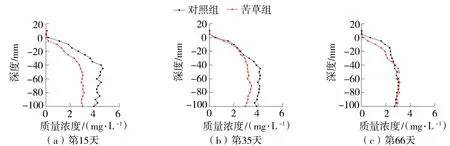
图3 沉积物溶解态Mn质量浓度变化趋势
沉积物UV254的变化如图4所示。在3个试验阶段,苦草组的UV254平均值都小于同期对照组,且随着试验的开展,苦草组与对照组UV254平均值差别越来越小。在试验开始后的第15天、第35天、第66天,苦草组的UV254分别是同期对照组的71.92%、84.81%、90.45%。苦草组与对照组UV254平均值的最大差异出现在试验初期的第15天。
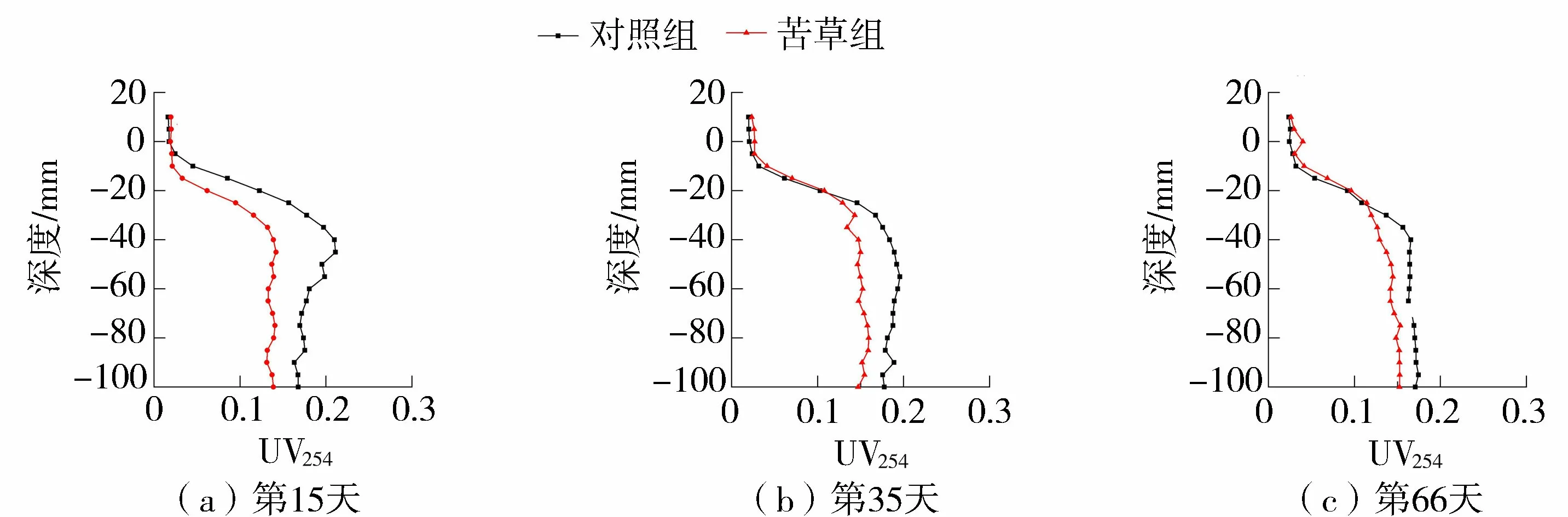
图4 沉积物UV254变化趋势
2.3 沉积物间隙水中溶解态As、As(Ⅲ)和As(Ⅴ)质量浓度变化
沉积物间隙水中的溶解态As质量浓度变化如图5所示。在3个试验阶段,苦草组溶解态As质量浓度小于对照组,苦草组对溶解态As的去除率始终大于同期对照组(表2)。在试验开始后的第15天、第35天、第66天,苦草组的溶解态As质量浓度分别是同期对照组的68.89%、54.49%、51.19%,呈现逐步递减与递减速度变缓的规律,可能是逐步达到了苦草吸收As的阈值,或者是因为As对苦草造成了损伤[22]。
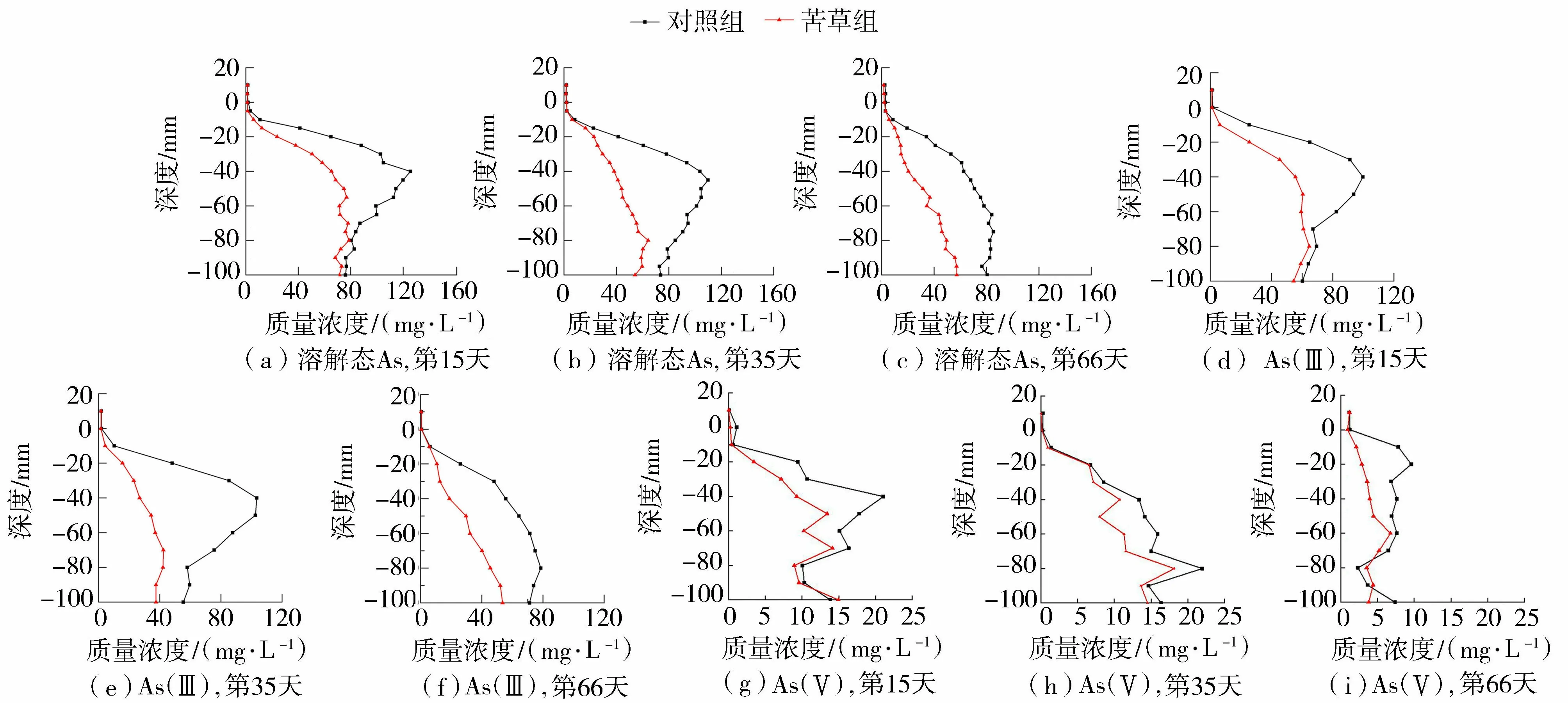
图5 苦草对沉积物剖面中溶解态As、As(Ⅲ)和As(V)质量浓度的影响
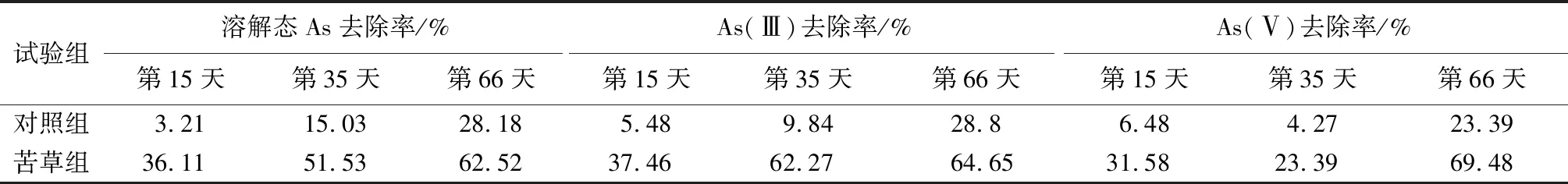
表2 苦草对间隙水中溶解态As、As(Ⅲ)和As(Ⅴ)的去除率
如图5所示,在3个试验阶段,苦草组的As(Ⅲ)和As(Ⅴ)质量浓度均低于同期对照组。在第15天、第35天、第66天,苦草组溶解态As(Ⅲ)质量浓度分别是同期对照组的68.38%、44.09%、52.88%(表2);苦草组溶解态As(Ⅴ)质量浓度分别是同期对照组的76.07%、82.32%、49.46%。3个试验时段,对照组和苦草对As(Ⅲ)的平均去除率分别为14.7%和54.8%,As(Ⅴ)的平均去除率分别为11.38%和41.48%。可见,苦草对As(Ⅲ)的去除效果优于其对As(Ⅴ)的去除效果。试验过程中,As(Ⅲ)平均质量浓度的最小值出现在第35天,As(Ⅴ)平均质量浓度的最小值出现在第66天,这可能是因为苦草对As(Ⅲ)和As(Ⅴ)的同化吸收机制不同[25]造成的。
2.4 相关性分析
苦草种植后的第15天、第35天和第66天,苦草组与对照组沉积物间隙水中溶解态As、溶解态Fe(Ⅱ)、溶解态Mn、UV254、As(Ⅲ)以及As(Ⅴ)之间的相关关系如图6所示,图中左上为对照组,右下为枯草组。3个试验阶段,苦草组和对照组沉积物间隙水中的溶解态As、As(Ⅴ)、As(Ⅲ)与溶解态Mn和UV254显著相关。对照组的溶解态As、As(Ⅴ)、As(Ⅲ)与溶解态Fe(Ⅱ)有较好的相关性,而苦草组溶解态As、As(Ⅴ)、As(Ⅲ)与溶解态Fe(Ⅱ)相关性较差或不存在相关性。
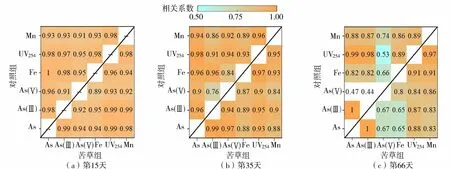
图6 沉积物间隙水中As与Fe、Mn、UV254的相关性分析
2.5 苦草对沉积物As迁移转化的影响机制
氧化还原作用制约着砷在环境中的存在形态,随着DO浓度的下降,As(Ⅴ)逐步被还原成As(Ⅲ)[26]。沉积物-水界面中的DO浓度越低,砷越易从五价被还原为三价[19]。苦草通过光合作用和根系泌氧使得苦草组沉积物-水界面DO浓度增加(图1),As(Ⅲ)被氧化为As(Ⅴ),砷酸盐沉淀增加,沉积物间隙水中溶解态As、As(Ⅲ)与As(Ⅴ)质量浓度减小(图5)。可见苦草有利于削减沉积物中的As,这与DO浓度增加促进沉积物磷去除的机制相似[27]。
沉积物间隙水中的pH值和UV254含量影响着沉积物As的存在形态和迁移转化过程[28-31]。苦草组和对照组中溶解态As、As(Ⅲ)、As(Ⅴ)含量变化均与UV254及Mn含量呈显著正相关关系(图6),表明存在耦合释放的现象。苦草组中溶解态Mn在DO浓度较高的情况下被氧化,并与间隙水中的砷酸根离子反应生成难溶的锰砷化合物,释放H+,降低苦草组的pH值(图1),且新生成的锰砷化合物与铁砷化合物可吸附UV254和溶解态As,形成络合物沉淀,砷的氧化和吸附能力增强,有效性降低[32-36]。本文3个试验时段,苦草组溶解态As、As(Ⅲ)与As(Ⅴ)的平均去除率呈现先增后减的趋势,可见受到了该组pH值降低的影响。
此外,植物的根系可以通过螯合作用、表面形成氧化铁/锰化合物胶体、区隔化作用等机制降低重(类)金属的吸收[37]。苦草根系分泌的有机酸能够有效促进沉积物中磷、铁在根系周边形成铁锰胶膜[38]。随着试验的进行,苦草对间隙水中溶解态As、As(Ⅲ)与As(Ⅴ)质量浓度的平均值与同期对照组的差异越来越小(图3),苦草对As的同化吸收效果降低。因此,苦草通过根系泌氧提升了表层沉积物的DO,促进了铁砷化合物和锰砷化合物的形成,有效去除了沉积物间隙水中的溶解态As、As(Ⅲ)与As(Ⅴ)。
3 结 论
a.苦草通过根系泌氧增加了沉积物-水界面的OPD,降低了间隙水中的pH值,UV254以及溶解态As、As(Ⅴ)、As(Ⅲ)、溶解态Fe(Ⅱ)和溶解态Mn的质量浓度。
b.苦草组和对照组沉积物间隙水中的溶解态As、As(Ⅴ)、As(Ⅲ)与溶解态Mn和UV254显著相关,与溶解态Fe(Ⅱ)相关性较差。
c.苦草对沉积物间隙水中的溶解态As、As(Ⅲ)和As(Ⅴ)有较好的去除效果,去除率分别为62.5%、64.6%、69.5%。苦草对As(Ⅲ)的去除效果优于其对As(Ⅴ)的去除效果。

