枸杞多糖对去势C57BL/6J 小鼠小脑的神经保护作用
王晓爽, 刘艺洁, 丁 雪, 李林隆, 李海林, 赵 薇, 王 银,丁玉梅, 苗珍花
(1.宁夏医科大学,银川 750004; 2.宁夏医科大学总医院中医科,银川 750004)
阿尔茨海默病(Alzheimer’s disease,AD)是以进行性痴呆为特征的中枢神经系统退行性变疾病,其患病率不仅与年龄增长密切相关,而且呈现性别差异[1];女性绝经后AD 的发病率是同龄男性的1.5~3 倍[2-3]。卵巢切除术已被提出作为手术绝经的实验模型[4]。AD 发病机制复杂,目前提出了有关AD 的若干学说,如β-淀粉样蛋白级联假说、胆碱能假说、自由基学说、免疫学说、细胞衰老学说等[5],但无一假说能完整解释AD的发病机制。由此,对于AD 的治疗,目前观点认为针对单一靶点的防治策略难以取得满意疗效,多靶点综合干预才是提高AD 防治水平的重要策略[6]。中药具有通过多途径、多环节和多靶点发挥作用的特点,因此其在防治AD 这类多因素复杂疾病方面具有明显的优势。研究[7]表明,枸杞多糖(lycium barbarum polysaccharides,LBP)具有增强免疫、抗衰老、抗氧化等多种生物学活性,尤其在中枢神经系统的应用日益受到重视。
长期以来,AD 的病理改变研究主要集中在海马、前额叶等端脑区域,小脑不仅与运动有关,而且参与了认知加工,包括注意转换、语言、图像、决策和推理以及认知控制[8-10]。LBP 对AD 动物模型的学习记忆行为和海马炎性因子表达有改善作用[11],LBP 对AD 小脑的作用目前报道较少。因此本研究在前期实验结果的基础上,选用12 周龄C57BL/6J 去势小鼠进行干预,观察LBP对其小脑及学习记忆能力改变的影响,旨在为枸杞多糖防治女性AD 方面提供实验依据。
1 材料与方法
1.1 材料
LBP 购自宁夏沃福百瑞生物食品工程有限公司;旷场实验、新物体识别实验及Morris 水迷宫实验所用仪器和分析系统均由深圳瑞沃德生物科技有限公司提供;雌二醇(estradiol,E2)酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒购自上海酶联生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSHPx)试剂盒均购自南京建成生物工程研究所;胆碱乙酰转移酶(choline acetyltransferase,ChAT)抗体购自江苏亲科生物研究中心有限公司;白细胞介素(interleukin)-1β 抗体购自武汉三鹰生物技术有限公司;IL-6 抗体购自北京博奥森生物技术有限公司;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)抗体购自武汉爱博泰克生物科技有限公司;辣根过氧化酶标记的二抗购自碧云天生物技术有限公司;BCA 蛋白含量检测试剂盒购自江苏凯基生物技术股份有限公司;PAGE 凝胶快速制备试剂盒购自上海雅酶生物科技有限公司。
1.2 实验动物及分组
雌性C57BL/6J 小鼠均由宁夏医科大学实验动物中心提供[实验动物生产许可证号:SCXK(宁)2020-0001],经宁夏医科大学伦理审查委员会批准(伦理编号:2014-017)。喂养于昼夜12 h交替、湿度45%、室温(23±1)℃环境中,自由进食。实验前选取11 周龄雌性未孕C57BL/6J 小鼠45 只,适应性喂养1 周后,随机分为假手术组、模型组和LBP 干预组,每组15 只。
1.3 模型制备及给药
将各组C57BL/6J 小鼠用4%水合氯醛溶液(10 mL·kg-1)腹腔注射麻醉,俯卧位固定小鼠。小鼠背部备皮,切口区域用乙醇及碘伏消毒,于肋下1 cm 水平做长约1 cm 的纵向切口,切开筋膜,钝性分离肌肉及腹膜,在肠系膜脂肪中找到红色颗粒样腺体即卵巢,在子宫角上用丝线结扎输卵管,LBP 干预组和模型组完整切断输卵管及卵巢,使用同样的方法切除对侧卵巢及输卵管;假手术组仅去除与卵巢大小相当的卵巢周围的脂肪。使用可吸收线依次缝合肌肉及皮肤。术后每只小鼠每天给予10 万单位青霉素腹腔注射3 d,防止感染。依据文献及本实验前期的研究结果[11-12]确定药物浓度。术后1 周,LBP 干预组灌胃给予LBP 灌胃0.1 g·kg-1;假手术组和模型组灌胃等量蒸馏水,每天1 次,连续12 周。在12 周的灌胃期间,假手术组15 只小鼠全部进入实验,模型组与LBP 干预组各死亡1 只小鼠(小鼠打架撕咬受伤感染所致),分别有14 只小鼠进入实验。
1.4 小鼠去势模型鉴定
各组小鼠去势手术后,每周进行体质量记录;行为学检测结束后,取血清检测E2含量;按公式计算:子宫系数=子宫湿重/每100 g 体质量。
1.5 行为学指标检测
1.5.1 旷场实验 旷场实验由长、宽、高各50 cm的灰色行为箱、摄像头和图像采集系统组成。应用Smart 3.0 软件将行为箱底面定义为中央区域和外周区域。中央区域长宽为外周区域长宽的一半。实验开始时将小鼠放入行为箱中央区域,让其在行为箱内自由探索10 min。记录其活动轨迹,比较各组小鼠在中央区域停留时间和总运动距离。每只小鼠实验结束后,用75%乙醇擦拭行为箱,以消除遗留的气味和粪便对后续实验结果的影响。
1.5.2 新物体识别实验 该实验由适应阶段、熟悉阶段及测试阶段组成。1)适应阶段:将小鼠放入40 cm×40 cm×40 cm 没有放任何物体的实验敞箱中自由活动10 min。2)熟悉阶段:敞箱中呈对角线且对称放置两个相同的物体(A、B)。将小鼠从两个物体连线的中点处面向箱壁放入。小鼠自由活动10 min,记录其运动轨迹及探索A、B两个物体的时间。3)测试阶段:把B 物体换成颜色形状不同、材质相同、大小相似的C 物体,将小鼠放入实验敞箱,记录其10 min 的运动轨迹及对A、C 两个物体的探索时间。计算新物体识别指数(new object index,NOI)。NOI=探索新物体的时间/(探索新物体的时间+探索旧物体的时间)×100%。
1.5.3 Morris 水迷宫行为学检测 Morris 水迷宫由圆形水池(直径90 cm)、逃生平台(直径10 cm)和图像采集分析软件构成。图像采集系统将水池分为4 个象限,每个象限池壁贴有不同参考物。水池中水面高于逃生平台1 cm 并加入白色染料以隐蔽逃生平台,水温控制在(22±1)℃。该实验由定位航行实验、空间探索实验和可视平台实验组成。1)定位航行实验:于每天上午进行,持续5 d,从小鼠入水至找到逃生平台的时间为逃避潜伏期。若小鼠60 s 未找到逃生平台,则记录逃避潜伏期为60 s。2)空间探索实验:第6 天撤去逃生平台,任选一个入水点将小鼠放入水中,记录小鼠在120 s 内的游泳轨迹。3)可视平台实验:将逃生平台移至原象限的对面象限,逃生平台高于水面1 cm,选取2 个象限将小鼠放入水中,记录其寻找逃生平台的时间及轨迹。
1.6 标本采集与处理
行为学检测结束后,各组小鼠采用4%水合氯醛溶液(10 mL·kg-1)进行腹腔麻醉。1)打开小鼠胸腔,心脏取血,收集并分装血清后置于-80 ℃冰箱中保存;2)打开小鼠腹腔,取出子宫,剥离附着的脂肪,并精密称重;3)各组均取小鼠8 只,打开颅腔,快速取出小脑,将其左、右半球分别置于-80 ℃冰箱中保存,用于生化及分子生物学检测。
1.7 E2 含量检测
ELISA 检测血清E2含量。具体操作步骤按照试剂盒说明书进行。
1.8 氧化应激相关指标测定
取各组小鼠血清和右侧小脑半球,采用TBA法检测MDA 的含量;采用羟胺法检测SOD 活力;采用比色法测定GSH-Px 活力;严格按照说明书进行具体操作。
1.9 胆碱乙酰转移酶及炎性因子检测
蛋白免疫印迹法(Western blot)检测各组小鼠右侧小脑半球ChAT 和炎性因子的相对表达量。从-80 ℃冰箱取出小鼠右侧小脑半球称重,按比例加入全蛋白提取液研磨并离心,吸取上清液备用。BCA 法测定蛋白质含量。每组取30 μg蛋白进行SDS-PAGE 电泳分离,转至PVDF 膜,5% 脱脂牛奶封闭2 h,加入一抗(ChAT、IL-1β、IL-6、TNF-α 及β-Tubulin 均1∶1 000 稀释)4 ℃于摇床孵育过夜,TBST 缓冲液洗膜3 次,每次10 min。加入二抗(1∶2 000 稀释)常温下摇床孵育1 h,TBST 缓冲液洗膜3 次,每次10 min,ECL法显色,采用Image J 图像分析软件测定各电泳条带的灰度值。
1.10 统计学方法
数据采用SPSS 25.0 和GraphPad Prism 8.0.1统计学软件进行分析与作图。计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析;Morris 水迷宫定位航行实验阶段所获得的逃避潜伏期采用重复测量方差分析。P≤0.05 为差异有统计学意义。
2 结果
2.1 小鼠体质量观察结果
LBP 干预前,各组小鼠体质量差异无统计学意义(P>0.05);LBP 干预12 周后,与假手术组比较,模型组小鼠体质量增加(P<0.01);与模型组比较,LBP 干预组体质量差异无统计学意义(P>0.05),见图1。
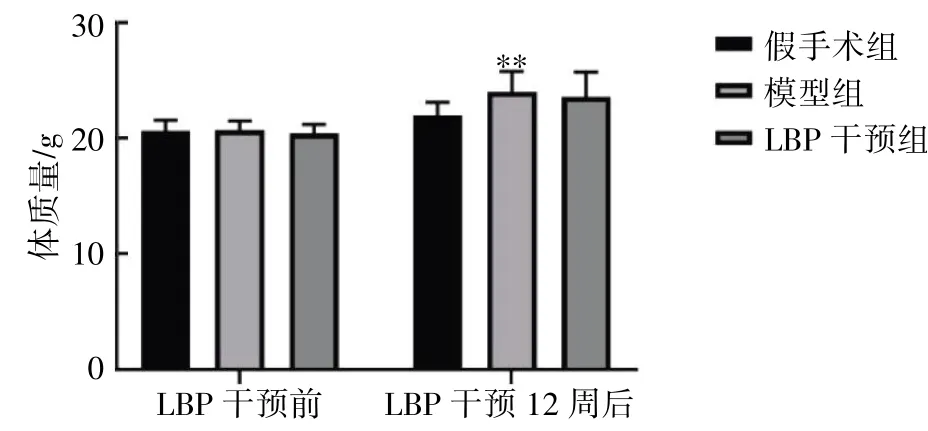
图1 LBP 对去势小鼠体质量的影响
2.2 小鼠子宫系数检测结果
LBP 干预12 周后,与假手术组比较,模型组子宫系数减小(P<0.01);与模型组比较,LBP 干预组子宫系数差异无统计学意义(P>0.05),见图2。
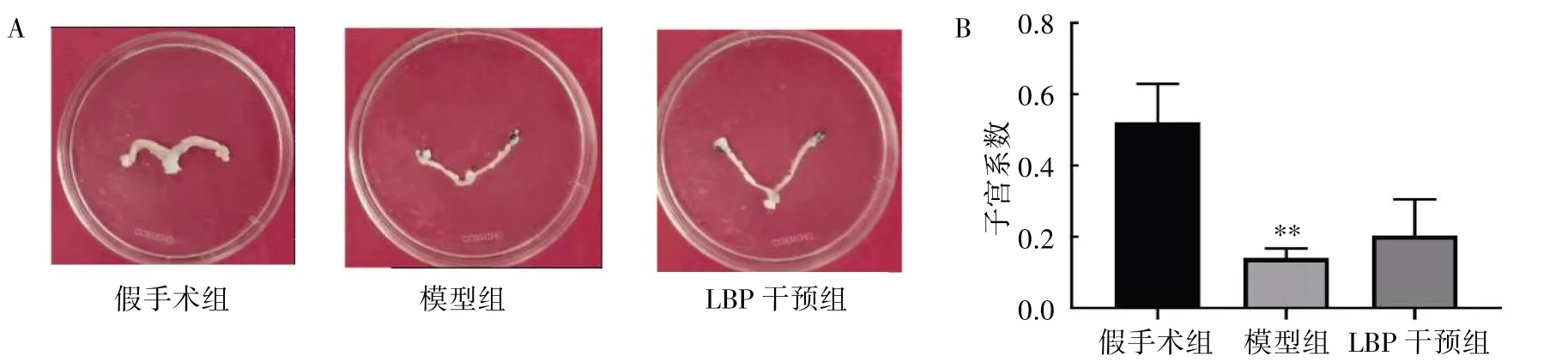
图2 LBP 对去势小鼠子宫系数的影响
2.3 行为学指标检测结果
2.3.1 旷场实验检测结果 LBP 干预12 周后,与假手术组比较,模型组小鼠行动轨迹简单,中央区域停留时间减少,总运动距离缩短(P均<0.01);与模型组比较,LBP 干预组行动轨迹复杂,中央区域停留时间增加,总运动距离增加(P均<0.05),见图3。

图3 LBP 对去势小鼠旷场实验的影响
2.3.2 新物体识别实验检测结果 LBP 干预12周后,与假手术组比较,模型组NOI 降低(P<0.01);与模型组比较,LBP 干预组NOI 增高(P<0.01),见图4。
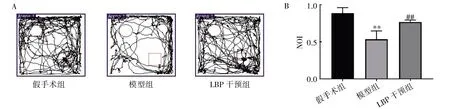
图4 LBP 对去势小鼠新物体识别的影响
2.3.3 Morris 水迷宫行为学检测结果 LBP 干预12 周后,定位航行阶段各组小鼠随着训练天数的增加,逃避潜伏期均缩短。与假手术组比较,模型组第3~5 天逃避潜伏期延长(P<0.01);与模型组比较,LBP 干预组第4、5 天逃避潜伏期缩短(P<0.01),见图5。空间探索阶段,与假手术组比较,模型组穿越目标象限次数减少(P<0.01);与模型组比较,LBP 干预组穿越目标象限次数增多(P<0.05),见图6。可视平台实验阶段,各组小鼠到达新平台所用的时间差异无统计学意义(P>0.05),见图7。
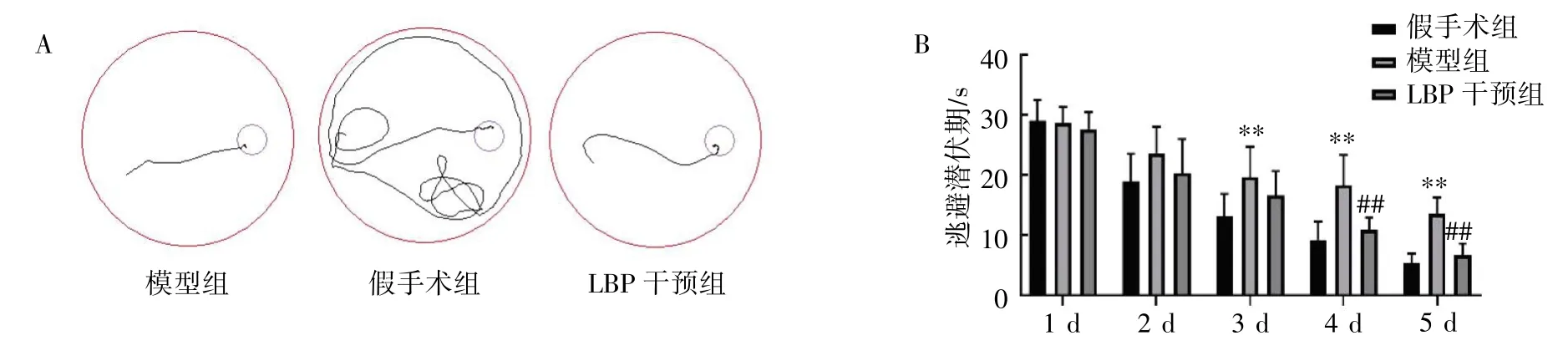
图5 LBP 对去势小鼠定位航行的影响
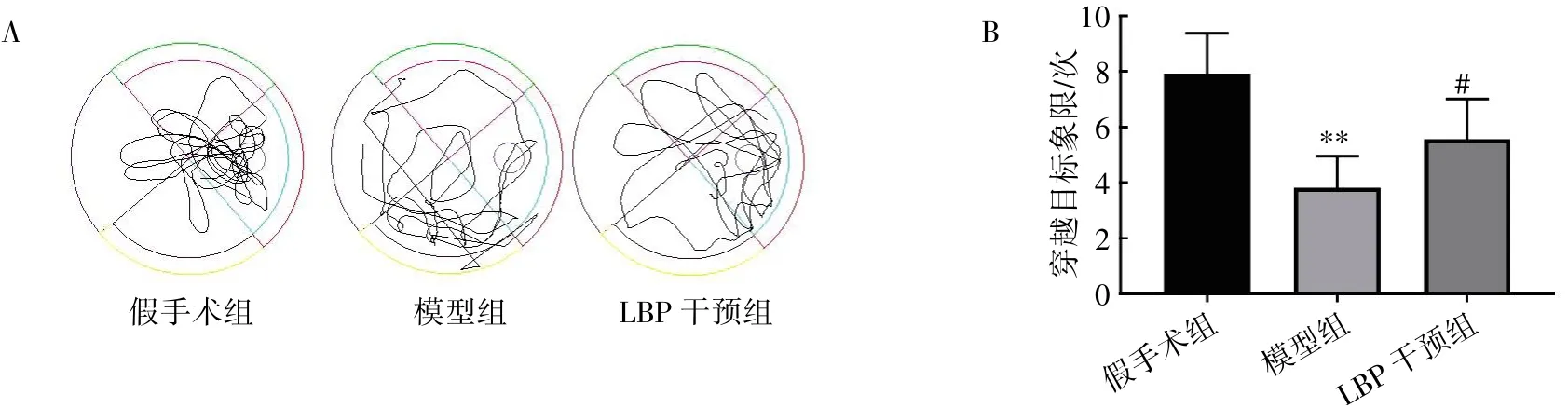
图6 LBP 对去势小鼠空间探索的影响

图7 LBP 对去势小鼠可视平台的影响
2.4 E2 检测结果
LBP 干预12 周后,与假手术组比较,模型组血清E2含量减少(P<0.01);与模型组比较,LBP 干预组血清E2含量差异无统计学意义(P>0.05),见图8。
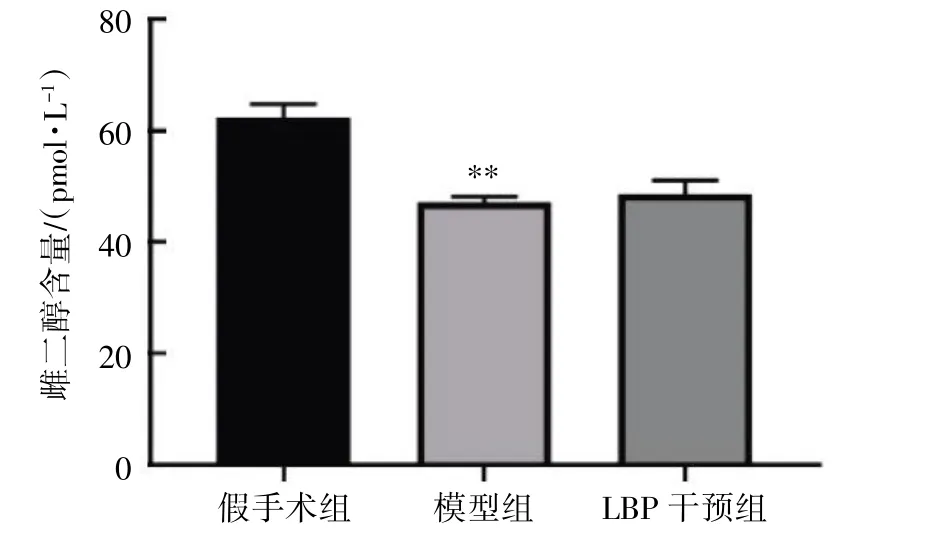
图8 LBP 对去势小鼠血清E2 含量的影响
2.5 氧化应激相关指标检测结果
LBP 干预12 周后,与假手术组比较,模型组血清及小脑半球MDA 含量增高,SOD、GSH-Px活力降低(P均<0.05);与模型组比较,LBP 干预组血清及小脑半球MDA 含量降低,SOD、GSHPx 活力增加(P均<0.05),见图9、图10。
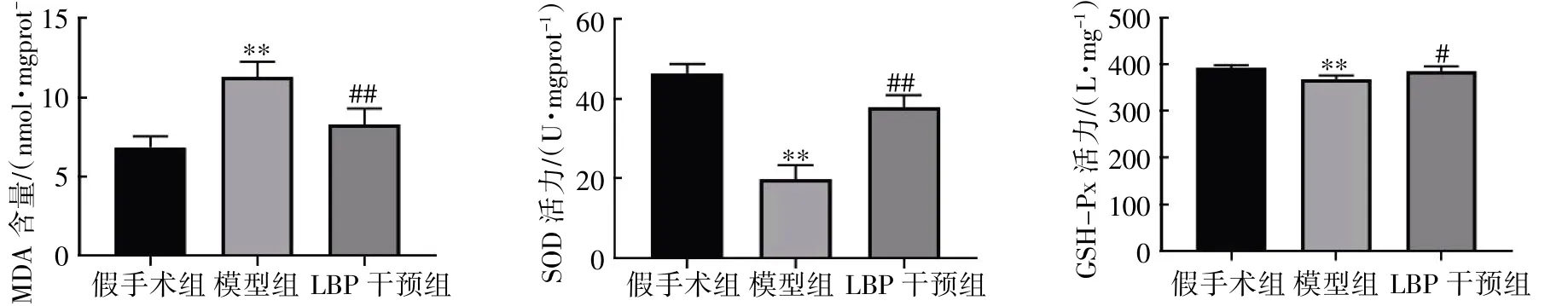
图9 LBP 对去势小鼠血清氧化应激相关指标的影响
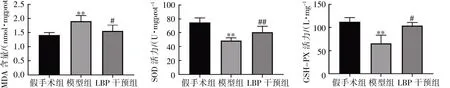
图10 LBP 对去势小鼠小脑半球氧化应激相关指标的影响
2.6 小脑半球ChAT 检测结果
Western blot 结果显示,LBP 干预12 周后,与假手术组比较,模型组ChAT 的相对表达量下调(P<0.05);与模型组比较,LBP 干预组ChAT 的相对表达量上调(P<0.05),见图11。
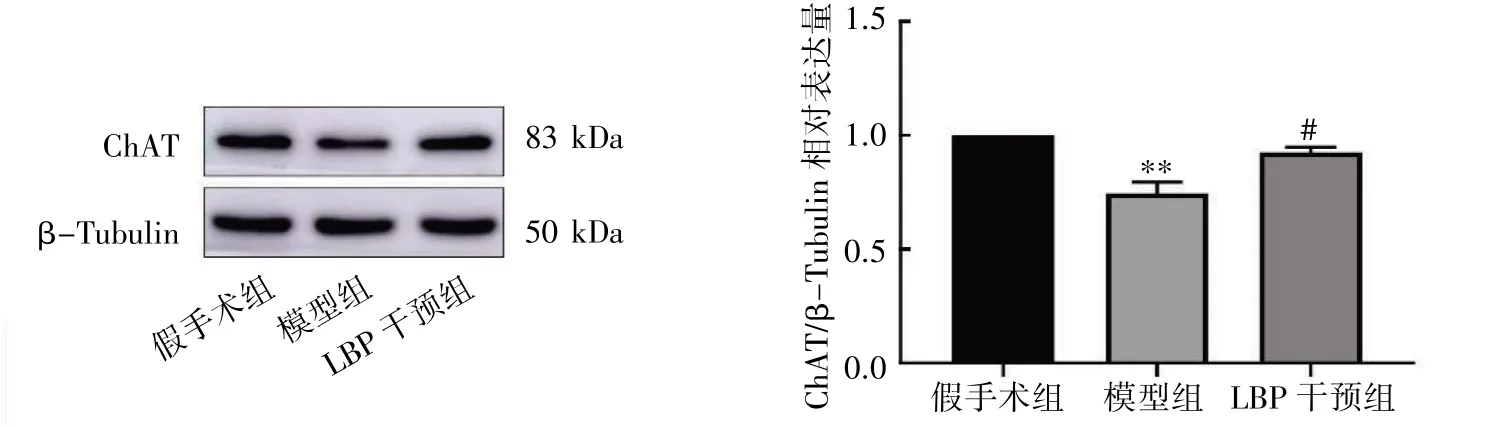
图11 LBP 对去势小鼠小脑半球ChAT 蛋白相对表达量的影响
2.7 小脑半球炎性因子检测结果
Western blot 结果显示,LBP 干预12 周后,与假手术组比较,模型组IL-1β、IL-6、TNF-α 的相对表达量均上调(P均<0.05);与模型组比较,LBP 干预组IL-1β、IL-6、TNF-α 的相对表达量均下调(P均<0.05),见图12。
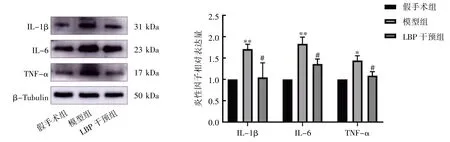
图12 LBP 对去势小鼠小脑半球炎性因子蛋白相对表达量的影响
3 讨论
AD 的临床症状主要表现为记忆丧失、认知障碍、行为异常等,其大多数研究集中在内侧颞叶,特别是海马的受损,其功能障碍被认为是AD记忆丧失的主要原因[13]。近年来小脑在认知方面的研究成为热点,即小脑除了在运动调节方面的传统作用外,也参与了工作记忆、空间工作记忆、时间的感知处理等认知过程[14]。研究[15-16]表明,小脑亦是AD 发病过程中的易感区域。小脑影响认知功能的基础是大脑-小脑环路[17],即大脑与小脑间广泛的纤维联系,这解释了小脑如何参与影响认知功能。
本研究结果显示,C57BL/6J 小鼠去势后,模型组小鼠体质量增加、子宫系数降低以及血清E2含量下降,LBP 干预并未发生改变,结果符合更年期妇女肥胖发生率增高的现象,推测肥胖的发生可能与去势诱导低雌激素水平有关。旷场实验结果表明LBP 干预可以改善去势引起的小鼠运动能力损伤及焦虑行为。新物体识别实验与Morris 水迷宫实验结果表明LBP 干预可以增强去势小鼠的非空间及空间学习记忆能力。
在对AD 病理机制的研究中,乙酰胆碱能系统对认知学习功能起到重要作用。ChAT 由于稳定性高且仅存在于胆碱能神经元内而被广泛认为是胆碱能神经元活性状态的最佳标记物[18-19]。本实验结果显示,LBP 干预后上调去势小鼠小脑半球ChAT 的相对表达量,表明LBP 在去势小鼠胆碱能神经环路ChAT 蛋白的表达方面有调控作用,能有效改善其记忆能力。去势可诱导啮齿类动物大脑中的神经炎症,导致学习、记忆和认知功能障碍。本实验结果显示,LBP 干预后上调去势小鼠小脑半球IL-1β、IL-6 和TNF-α 的相对表达量,表明LBP 可减轻去势小鼠小脑半球的神经炎症。
氧化应激已被证明是AD 进展的主要因素[20]。氧化应激被定义为由于过量的活性氧(reactive oxygen species,ROS)水平[21]导致大分子(如核酸、蛋白质、脂类等)的翻译后化学修饰引起细胞损伤[22],从而导致氧化剂和保护性抗氧化系统之间的失衡。在AD 患者萎缩的大脑中,往往存在显著的神经元组织氧化损伤[23]。ROS 通常具有高反应性、不稳定性和极短的半衰期,因此很难直接测量。ROS 的氧化生物分子产物更加稳定,常用作ROS 的标记物。此外,ROS 还可以通过测定抗氧化水平或抗氧化酶活性来间接评估。本研究结果显示,对C57BL/6J 雌鼠去势后,模型组小鼠的血清及小脑半球表现出脂质过氧化物MDA 含量增高、抗氧化酶SOD 和GSH-Px 活力降低,而LBP 干预后此状况有所改善,提示LBP 干预可以改善去势小鼠的氧化应激损伤情况。
在AD 病理中,越来越多的研究[24-25]将年龄和性别作为两个独立的生物学变量,但它们之间是存在相互作用的,性别差异可能是AD 疾病特异性、药物特异性、年龄特异性或这些特异性的任何组合。鉴于此,本实验中仅纳入了雌性小鼠为研究对象。女性卵巢切除术或更年期后雌激素的丧失会增加患AD 风险、晚年情绪障碍以及年龄相关的认知能力下降[26-27]。因此,在AD 的实验研究和临床治疗策略中,探寻雌激素发挥其神经保护作用的“关键窗口期”尤为重要[28]。
AD 发病机制复杂,筛选开发治疗药物困难,近年来人们从草药中寻找治疗AD 的新药。枸杞是中国传统的中药材和补品,研究[7]表明,LBP 具有抗肿瘤、抗氧化、抗衰老、抗炎、神经保护、生殖保护、护眼、免疫调节等作用。鉴于此,本研究选择了LBP 作为干预药物,并将其干预窗口期的开始时间选择在C57BL/6J 小鼠去势后1 周,通过为期12 周的干预,表现出了一定的干预效果,提示选择的干预“窗口期”可能是“关键窗口期”。
目前枸杞抗衰老和防治AD 的基础研究进展较迅速,本研究在将性别作为重要、独立的影响因素的基础上,初步引用了“围绝经期”和“关键窗口期”等临床概念,由于去势动物模型的局限性以及“窗口期”的不确定性,可能影响了实验效果。因此今后需科学、合理、规范地开展枸杞的相关临床研究,制备更加符合“围绝经期”的动物模型,并围绕“围绝经期”进行防治。

