深海真菌Penicillium sp.Z13次级代谢产物的研究
张佳 ,李钦
河南大学 药学院,河南 开封475004
0 前言
近些年通过科学家们对陆源微生物的研究表明,从陆源微生物获得新化合物的几率比之从前已经大大降低[1]。而海洋微生物物种丰富,生物量约为地球生物总量的87%,有着巨大的开发潜力[2]。由于海洋微生物次生代谢产物的产生通常与周围特定的环境有关,而海洋环境具有高盐,高压,寡营养等特点,为适应这样的环境,海洋微生物进化出独特的生存方式和代谢途径,从而能够产生与陆地微生物完全不同的次级代谢产物[3],因此海洋微生物已经成为天然活性物质的研究热点[4]。根据对海洋来源的天然产物的调查,科学家们从海洋真菌中分离得到了大量的结构新颖且具有良好生物活性的天然产物,它们结构类型丰富,其中包括萜类,生物碱类,甾体,聚酮等[5],具有细胞毒性,抗炎,抗病毒,抗菌或抗真菌等良好的生物活性[6]。其中从青霉真菌中分离到的天然产物占所有海洋真菌来源的22%[7],青霉菌已经成为一种具有新颖结构和生物活性的有前途的天然产物库[8]。
本实验对真菌Penicilliumsp.Z13 的大米培养基的发酵产物进行了研究,通过1H-NMR 和13CNMR 谱图数据与文献中已报道的化合物波谱信息进行对比,最终确定了分离得到的10个化合物的结构。化合物1-10结构见图1。
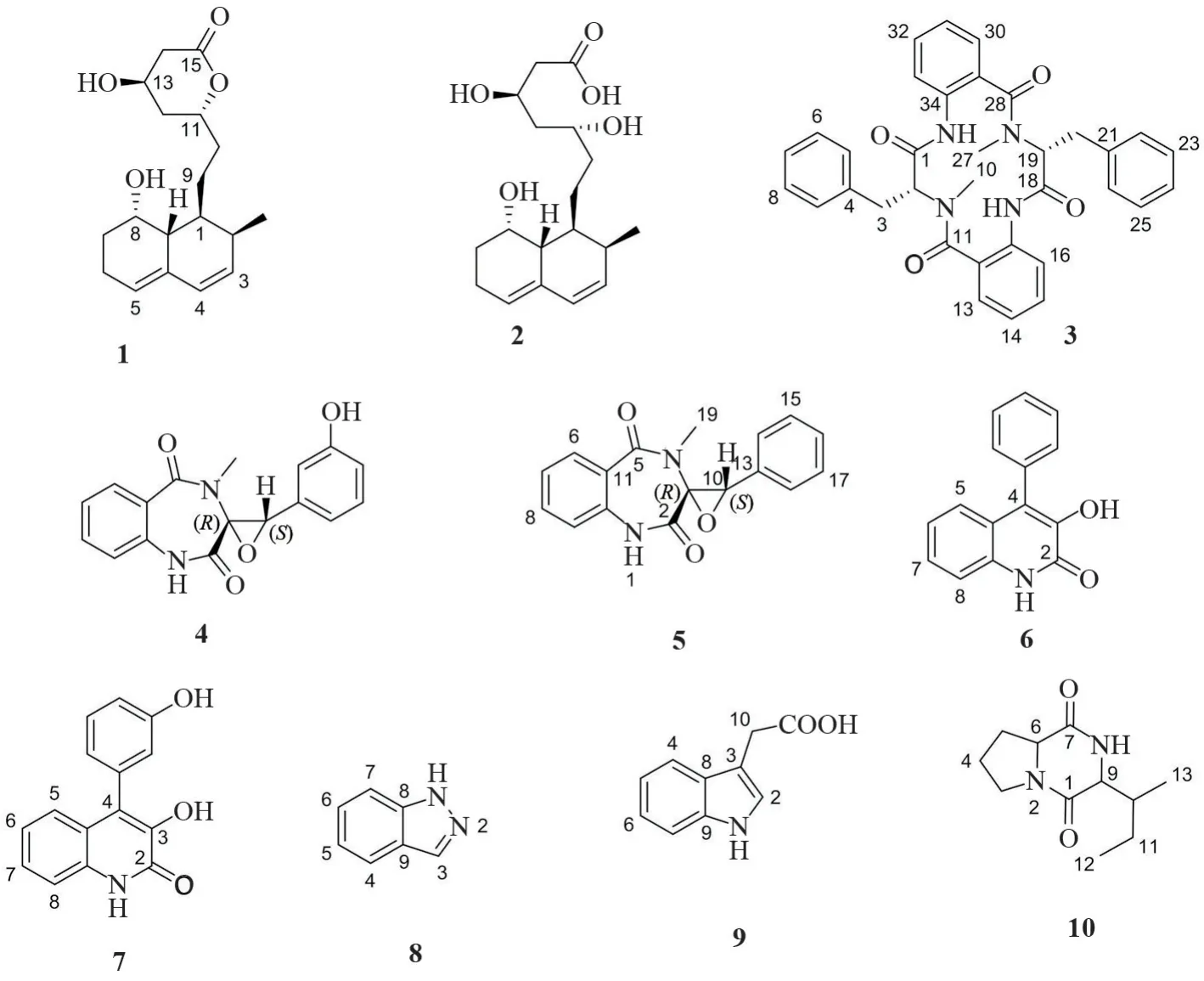
图1 从海洋真菌Penicillium sp.Z13中分离到的化合物1-10的结构
1 仪器与材料
仪器:Rotavapor R-210旋转蒸发仪(瑞士步琪有限公司),LC-20A 制备型高效液相色谱仪(日本岛津企业管理有限公司),AVANCE III HD 核磁共振波谱仪(瑞士Brock光谱仪器有限公司),FYLYS-280L恒温箱(北京福意电器有限公司),GV-2L超声波清洗仪(深圳市够威科挤有限公司),MLS-3750高压蒸汽灭菌锅(松下健康医疗器械有限公司),ZHJH-C1112B 超净工作台(上海智城分析仪器有限公司),MINI-10K+微型离心机(杭州米欧仪器有限公司),ME 104E 分析天平(梅特勒-托利多仪器上海有限公司)。
材料与试剂:马铃薯葡萄糖琼脂培养基(取37 g马铃薯葡萄糖琼脂粉,加入1 000 mL 蒸馏水溶解,高压蒸汽灭菌30 min。),大米发酵培养基(取80 g大米于500 mL锥形瓶中,加入100 mL人工配制海水,p H 7.4~7.8,浸泡2 h,高压蒸汽灭菌30 min。人工配制海水:33 g海盐配比1 000 mL超纯水),乙酸乙酯(济南源茂化工有限公司),石油醚(天津市福晨化学试剂有限公司),分析甲醇(天津市富宇精细化工有限公司),分析二氯甲烷(天津市德恩化学试剂有限公司),甲酸(北京红星化工厂),色谱乙腈(天津康科德科技有限公司),色谱甲醇(天津市四友精细化学品有限公司),娃哈哈纯净水(杭州娃哈哈集团有限公司),香草醛浓硫酸显色试剂(5.0 g香草醛,80 mL 浓硫酸,200 mL 超纯水,100 mL Et OH)。
菌株:本实验的供试菌株Penicilliumsp.Z13是从西太平洋雅浦海沟(Yap Trench)深层海水(-4 500 m)中分离得到的,用马铃薯葡萄糖琼脂培养基摇床培养该菌株1 个星期,通过测试ITS 序列,并与genbank 数据库进行对比,鉴定了该菌株属于Penicillium属,不能确定其种,因此将此菌株命名为Penicilliumsp.Z13。在超净工作台上,将菌种接种到马铃薯葡萄糖琼脂培养基(PDA)上,生长5天后在超净工作台上将长有菌丝的培养基块接种于灭菌了的大米固体培养基中。用大米固体培养基对该菌株进行放大发酵,大米固体培养基用高压灭菌锅121 ℃灭菌30 min,于30 ℃下静置发酵30 d,共发酵40瓶。
2 提取与分离
用玻璃棒将锥形瓶中发酵好的的大米捣碎,向其中加入乙酸乙酯200 mL。浸泡充分后,将其转移至2 000m L锥形瓶中。用保鲜膜封口,超声清洗30 min。用乙酸乙酯提取三次,合并提取液。将提取液用旋蒸仪浓缩,共获得20 g 浸膏。将浸膏溶于100 mL 90%甲醇中,加入100 mL 石油醚萃取,共萃取3次,收集下层部分浓缩,共得浸膏8 g。将浸膏过MCI柱,采用甲醇∶水(30∶70→100∶0)梯度洗脱,每个浓度冲300 mL。利用薄层层析硅胶板的检测结果将样品进行合并并浓缩,将样品粗分为7段,P1~P7。其中,P2,P4经过结构鉴定分别确认为4和5,其中P5用ODS柱进行甲醇∶水梯度洗脱(40%、50%、60%、70%、80%、90%、100%),每个浓度冲300 mL,利用薄层层析硅胶板合并样品并浓缩得到九个组分,P5-1-P5-9。将P5-8用ODS 柱进行乙腈∶水梯度洗脱(30%、35%、40%、45%、50%、55%、60%、65%),每个浓度冲300 mL,得 到八个组份P5-8-1-P5-8-8。其中组分P5-8-1经HPLC(ODS柱:4.6 mm×150 mm,5μm;紫外灯波长210 nm,254 nm;乙腈∶水=15∶85,3 ml/min)分离纯化得到化合物10(2.0 mg,tR=15.8 min)。组分P5-8-8经HPLC(ODS柱:4.6 mm×150 mm,5μm;紫外灯波长:210nm,254nm;乙腈∶水=37∶63,3m L/min)分离纯化得到化合物2(34.3 mg,tR=28.5 min)和化合物3(10.5 mg,tR=15.2 min)。将P5-9用ODS 柱进行乙腈:水梯度洗脱(30%、35%、40%、45%、50%、55%、60%),每 个 浓度冲300 mL,得到六个组份P5-9-1-P5-9-6。组分P5-9-1经HPLC(乙腈∶水=47∶53,3 mL/min)分离纯化得到化合物8(1.7 mg,tR=8.5 min),9(3.7 mg,tR=10.5 min)和6(3.6 mg,tR=42.4 min)。组分P5-9-5经HPLC(乙腈∶水=40∶60,3 mL/min)分离纯化得到化合物1(2.0 mg,tR=32.0 min)。组分P5-9-6经HPLC(乙腈∶水=47∶53,3 mL/min)分离纯化得到化合物7(2.0mg,tR=11.8 min)。
3 波谱数据
化合物1:无色固体,1H-NMR 中显示有1个甲基信号δH0.89(d,3 H,J=7.0 Hz,2-Me),δH(1.31~2.38)处有CH 和CH2的多重信号,δH5.93(d,1H,J=9.5 Hz,H-4),5.75(m,1 H,H-3)和5.49(brs,1 H,H-5)均为环内烯烃质子信号,δH3.79为醇羟基质子信号。13C-NMR 中显示出18 个碳信号,其中δC135.0(C-4a),133.4(C-3),129.9(C-4)和124.7(C-5)为4 个sp2杂化碳信号,δC78.4(C-11),65.1(C-8)和63.3(C-13)为3个连氧碳信号,δC14.3(2-Me)为1 个甲基碳信号,δC(21.4-39.8)为10个亚甲基碳信号。氢谱和碳谱数据归属如下:1H-NMR(400 MHz,CD3OD):δH5.93(d,1H,J=9.5 Hz,H-4),5.71(m,1 H,H-3),5.49(brs,1H,H-5),4.71(m,1H,H-11),4.22(m,1H,H-8),3.68(s,1 H,H-13),2.73(m,1H,H-14),2.54(m,1 H,H-14),2.38(m,2H,H-6,H-2),2.19(m,2H,H-6,H-8),1.96(m,2 H,H-7,H-12),1.82-1.69(m,5 H,H-1,H-7,H-9,H-10,H-12),1.55-1.41(m,2H,H-9,H-10),0.89(d,3 H,J=7.0 Hz,2-Me);13C-NMR (100 MHz,CD3OD):δC173.8(C-15),135.0(C-4a),133.4(C-3),129.9(C-4),124.7(C-5),78.4(C-11),65.1(C-8),63.3(C-13),39.8(C-8a),39.1(C-14),37.8(C-1),36.6(C-7),34.0(C-9),32.2(C-2),30.6(C-12),25.0(C-10),21.6(C-6),14.3(2-Me)以上数据与文献报道[9]基本一致,因此鉴定化合物1 为6-desmethylmonacolin-J-15。
化合物2:无色固体,1H-NMR 中δH5.48(1 H,s,H-5),5.71(1 H,dd,J=6.2,3.6 Hz,H-3)和5.92(1H,d,J=9.8 Hz,H-4)为环内烯烃质子信号,δH4.18-4.23(2H,m)和3.8(1H,m),为醇羟基质子信号,δH0.89(3 H,d,J=7.1 Hz,2-CH3)为甲基质子信号。13C-NMR 中显示18个碳信号,δC170.0(C-15)为羰基碳信号,δC135.0(C-4a),133.7(C-3),129.8(C-4)和124.5(C-5)为4个sp2杂化碳信号,δC71.3(C-11),68.5(C-13)和65.2(C-8)为3个连氧碳信号,δC14.3(2-Me)为甲基碳信号,δC(21.6~44.8)为9个亚甲基碳和次甲基碳信号。氢谱和碳谱数据归属如下:1H-NMR(CD3OD,400MHz):δH5.92(1H,d,J=9.8 Hz,H-4),5.71(1 H,dd,J=6.2,3.6 Hz,H-3),5.48(1 H,s,H-5),4.18(1H,m,H-13),4.22(1H,m,H-8),3.8(1 H,m,H-11),2.49(1H,d,J=9.8 Hz,H-14),2.39(3H,m,H-6,H-2),2.18(1H,m,H-8a),2.07(1H,m,H-6),1.94(1H,m,H-7),1.81(2 H,m,H-1,H-9),1.66(1 H,m,H-7,H-12),1.55(1 H,m,H-10),1.41(1 H,m,H-10),1.34(1 H,m,H-9),0.89(3 H,d,J=7.1 Hz,2-CH3)。13C-NMR (100M Hz,CD3OD):δC170.0(C-15),135.0(C-4a),133.7(C-3),129.8(C-4),124.5(C-5),71.3(C-11),68.5(C-13),65.2(C-8),44.8(C-12),43.7(C-14),40.0(C-8a),37.8(C-1),35.5(C-10),32.2(C-2),30.6(C-7),25.0(C-9),21.6(C-6),14.3(2-Me)。以上数据与文献报道[10]基本一致,因此鉴定化合物2为 3,5-dihydroxy-7-(8-hydroxy-2-met-hy-hexahydronap H-thalen-1-yl)heptanoicacid。
化合物3:淡黄色粉末,在1H-NMR 的芳香区显示有4套苯环系统,δH3.06(s,3H,H-27)和2.90(s,3 H,H-10)均为甲基峰信号。在13C-NMR 中,δC172.2(C-1),171.1(C-18),170.7(C-28)和168.2(C-11)为4 个酰胺碳信号,δC(138.1~121.7)均为sp2杂化碳信号,δC39.8(C-10)和29.6(C-27)为N-CH3信号,δC35.2(C-3)和32.9(C-20)为亚甲基碳信号,氢谱和碳谱数据归属如下:1H-NMR(400 MHz,CD3OD):δH7.96(d,1H,J=7.8 Hz,H-13),7.82(d,1H,J=7.8 Hz,H-30),7.59(t,1H,J=7.8 Hz,H-15),7.50(t,1H,J=7.8 Hz,H-32),7.33(t,1H,J=7.3 Hz,H-14),7.28-7.18(m,10 H,H-6~8,16,22~26,31),7.07(d,1H,J=8.5 Hz,H-33),7.02(d,1H,J=7.0 Hz,H-5),4.42(t,1 H,J=7.3 Hz,H-19),4.33(dd,1H,J=7.0,4.0 Hz,H-2),3.39(m,1 H,H-20),3.24(dd,1 H,J=7.4,7.3 Hz,H-20),3.06(s,3H,H-27),2.90(s,3H,H-10),2.78(dd,1H,J=7.0,7.4 Hz,H-3),2.66(m,1 H,H-3);13C-NMR (100 MHz,CD3OD):δC172.2(C-1),171.1(C-18),170.7(C-28),168.2(C-11),138.1(C-21),137.9(C-34),137.1(C-4),137.0(C-17),134.2(C-15),133.75(C-32),132.3(C-13),131.8(C-30),130.0(C-5),130.0(C-9),130.0(C-22),130.0(C-26),129.8(C-6),129.6(C-8),129.6(C-23),129.6(C-25),128.3(C-7),128.3(C-29),127.8(C-24),127.7 (C-12),125.9(C-31),125.9(C-14),122.0(C-33),121.7(C-16),69.7(C-2),57.9(C-19),39.8(C-10),35.2(C-3),32.9(C-20),29.6(C-27)。以上数据与文献报道[11]基本一致,因此鉴定化合物3为penicopeptide A。
化合物4:白色晶体,1H-NMR 中芳香区显示含有两套苯环系统,δH3.10(s,3 H,H-19)为NCH3信 号,在13C-NMR 中,δC168.7 (C-2),168.4(C-5)为两个酰胺碳信号,δC158.5(C-15)为酚羟基芳香碳信号,δC71.7(C-3)和66.0(C-10)为连氧碳信号,δC31.7(C-19)为N-CH3信号,其余碳均为sp2杂化碳信号,氢谱和碳谱数据归属如下:1HNMR(400 MHz,CD3OD):δH7.56(m,1H,H-8),7.15(m,3 H,H-6,7,9),7.01(t,1 H,H-17),6.71(dd,1H,H-16),6.15-6.10(dd,2 H,J=7.8 Hz,H-14,18),4.03(s,1H,H-10),3.10(s,3 H,H-19);13C-NMR (100 M Hz,CD3OD):δC168.7(C-2),168.4(C-5),158.5(C-15),136.5(C-12),134.0(C-13),133.5(C-7),132.2(C-6),130.3(C-17),128.0(C-11),126.1(C-8),122.3(C-9),118.5(C-18),117.1(C-16),113.9 (C-14),71.7(C-3),66.0(C-10),31.7(C-19)。以上数据与文献报道[12]基本一致,因此鉴定化合物4为cyclopenol。
化合物5:白色晶体,对比化合物5和化合物4的氢谱和碳谱数据,发现化合物5中少了一个连氧的芳香碳信号(δC158.5),但多了1 个芳香碳信号(δC130.1),又因为C14(δC122.4)与C18的化学位移相同,C15(δC130.1)与C17化学位移相同,由此可以推断化合物5中含有一个单取代苯环,又因其氢谱并未显示羟基信号,推断化合物5比化合物4的C15位少一个羟基,氢谱和碳谱数据归属如下:1H-NMR(400MHz,DMSO-d6):δH7.57 (m,1H,H-7),7.30(m,1 H,H-16),7.24-7.13(m,4 H,H-6,8,15,17),7.07(m,1H,H-9),6.70(m,2H,H-14,18),4.18(s,1H,H-10),3.35(s,3H,H-19);13C-NMR(100 MHz,DMSO-d6):δC168.6(C-2),168.4(C-5),136.6(C-15),134.1(C-12),132.2(C-13),132.1(C-7),130.1(C-6),130.1(C-17),129.2 (C-11),128.0 (C-8),127.3 (C-9),126.1(C-18),122.4(C-16),122.4(C-14),71.7(C-3),66.0(C-10),31.7(C-19)。以上数据与文献报道[12]基本一致,因此鉴定化合物5为cyclopenin。
化合物6:无色棱状结晶,1H-NMR 芳香区显示有9个芳环氢信号,其中包括苯环二取代的4个氢信号δH(7.04~7.32),和苯环单取代的5个氢信号δH(7.36~7.53),低场区显示活泼氢信号δH12.23(s,1 H,NH),δH9.23(s,1 H,OH-3)。13C-NMR 显示有15 个碳信号,包括1 个内酰胺羰基碳信号δC158.45,14个sp2杂化碳信号δC(133.9~115.28)。氢谱和碳谱数据归属如下:1H-NMR (400 MHz,CD3OD):δH12.23(s,1 H,NH),9.23 (s,1 H,OH-3),7.53~7.34(m,5H,H-1′~H-5′),7.32~7.29(m,2 H,H-8,H-7),7.09~7.04(m,2 H,H-6,H-5);13C-NMR (100 MHz,CD3OD):δC158.5(C-2),142.8(C-8a),133.9(C-1′),133.1(C-3),128.4(C-3′),128.4(C-5′),127.6(C-4′),126.3(C-7),124.3(C-5),123.8(C-4),122.1(C-6),122.1(C-6′),121.0(C-4a),115.3(C-8),12.9(C-2′)。以上数据与文献报道[13]中的基本一致,因此鉴定化合物6为viridicatol。
化合物7:无色结晶,1H-NMR 数据显示有2套芳环系统,在低场区δH12.20(s,1 H,NH)处显示有含氮的活泼氢信号,δH9.52(s,1H,OH-3′)和9.15(s,1H,OH-3)表示有酚羟基的活泼氢信号,13CNMR 数据显示化合物7中有15个碳,其中δC158.3(C-2)为酰胺羰基碳信号,δC157.3(C-3′)为酚羟基碳信号,其余13根碳δC(114.6~142.2)均为sp2杂化碳信号,推测化合物7含有喹啉环结构,氢谱和碳谱数据归属如下:1H-NMR (400 MHz,DMSOd6):δH12.20(s,1 H,NH),9.52(s,1H,OH-3′),9.15(s,1H,OH-3),7.33~7.27(m,3H,H-8,H-5,H-5′),7.09~7.06(m,2H,H-7,H-6),6.82(m,1 H,H-4′),6.71(m,2 H,H-6′,H-2′);13C-NMR (100 MHz,DMSO-d6):δC158.3(C-2),157.3(C-3′),142.2(C-8a),134.9(C-1′),133.1(C-4),129.4(C-5′),126.4(C-5),124.5(C-7),124.1(C-3),122.1(C-6),120.9(C-4a),120.4(C-6′),116.7(C-2′),115.2(C-8),114.6(C-4′)。以上数据与文献报道[14]中的基本一致,因此鉴定化合物7为viridicatin。
化合物8:白色无定型粉末,根据1H-NMR 中芳香区的信号可知化合物8中含有二取代苯环,在13C-NMR 中,δC(112.8~138.2)均为sp2杂化碳信号。氢谱和碳谱数据归属如下:1H-NMR(CD3OD,400 MHz):δ8.07(1H,m,H-4),7.93(1H,s,H-3),7.43(1H,m,H-7),7.20(1H,m,H-6),7.17(1H,m,H-5);13C-NMR(CD3OD,100 MHz):δ 138.2(C-8),133.2(C-3),127.7(C-6),123.5(C-9),122.3(C-4),122.1(C-5),112.8(C-7)。波谱数据与文献报道[15]一致,因此确定为吲唑。
化合物9:黄色粉末,根据1H-NMR δH(7.04~7.59)的信号可知化合物9中含有邻二取代的苯环。在13C-NMR 谱中,δC176.8(C-11)为羧基碳信号,δC(109.11~138.02)为sp2杂化碳信号,δC32.2(C-10)为亚甲基碳信号。氢谱和碳谱数据归属如下:1HNMR(CD3OD,400 MHz):δH7.54(1H,d,J=8.13 Hz,H-4),7.16(1 H,s,H-2),7.33(1 H,d,J=8.01 Hz,H-7),7.09(1H,t,H-6),7.01(1H,t,H-5),3.72 (2H,s,H-10);13C-NMR(CD3OD,100 MHz):δC176.8(C-11),138.0(C-9),128.7(C-8),124.6(C-2),122.4(C-5),119.8(C-4),119.5(C-6),112.2(C-7),109.1(C-3),32.2(C-10)。波谱数据与文献报道[16]一致,因此确定为吲哚乙酸。
化合物10:白色粉末,1H-NMR 谱δH4.30(1H,m,H-9)和δH4.14(1H,m,H-6)处有CH 的多重峰信号,高场区δH(0.9~2.45)可见系列的CH2和CH 多重峰信号,氢谱和碳谱数据归属如下:1HNMR(CD3OD,400 MHz):δH4.30(1 H,m,H-9),4.14(1H,m,H-6),3.74(2H,m,H-3),3.61(2 H,m,H-4),2.44(1 H,m,H-10),1.69(1H,m,H-11),1.50(1H,m,H-11),1.15(3H,m,H-13),0.92(3H,m,H-12)。波普数据与文献报道[17]基本一致,因此确定为环(异亮氨酸-脯氨酸)。
4 总结
本文对深海真菌Penicilliumsp.Z13的次级代谢产物进行了研究,对其大米发酵物的乙酸乙酯浸膏进行分离得到了10个化合物,其中有8个为生物碱,2个为莫纳可林类化合物。1,2,8,9和10均为首次从深海真菌Penicillium中得到。查阅文献得知,化合物3,4,5,7均有不尽相同的活性。其中化合物3有良好的生理活性,它在体外对11β-羟基类固醇脱氢酶1型(11β-HSD1)表现出显著的抑制活性,并与11β-HSD1 表现出较强的结合亲和力[11]。化合物7对大肠杆菌、枯草芽孢杆菌和黄体微球菌表现出了中等抗菌活性[18]。化合物4之前报道它有强大的细胞毒性[19],但在研究中发现,当浓度为10m M 时,它对HL60和A549细胞系没有活性[20]。另外在文献[21]报道中化合物4具有抑制酶活性和脾淋巴细胞增殖的作用,值得继续研究它的其他生物活性的,如抗菌和抗病毒活性。除此之外,化合物4和5还被报道为具有植物生长调节剂和抗菌特性[18]。上述情况说明该菌株的次级代谢产物具有丰富的生物活性,青霉菌属的研究价值进一步被有力的证明,这为海洋资源的开发和有良好活性的先导化合物的发现及研究奠定了一定的基础。

