IL6对细胞连接相关基因介导的肾癌患者生存影响
李鸿昊,李慧琳,许鸣
广东省第二人民医院民航院区 内二科,广州510000
细胞与细胞之间、细胞与细胞外基质之间相互作用是维持机体内环境的重要保障,是促进细胞间相互交流的枢纽,细胞连接是细胞间发生关联的结构基础和基本方式,故细胞连接异常是细胞异常生长的重要原因。细胞连接包括三种主要的类型:紧密连接(Tight junction),黏着连接(Adherens junction),间隙连接(Gap junction)[1-4]。紧密连接蛋白家族成员Claudin-4、PALS1蛋白、紧密连接相关蛋白闭锁小带蛋白-1、CLND6的异常表达均会导致肾癌的发生[5-8];黏着连接在生命体活动过程中通过膜整合蛋白、肌动蛋白将细胞与细胞之间或细胞与细胞外基质连接起来,传递细胞信号,在细胞交流过程中发挥重要作用[9]。研究表明,紧密连接和黏着连接组成的顶端连接复合物对于肿瘤的诊断和治疗具有重要意义[10]。在胃癌、肾癌等类型中,黏着连接与上皮间质转化(EMT)之间紧密关联,促进肿瘤的进展,此外有关黏着连接在肾癌中的作用也尚未有明确共识[11-14]。间隙连接是可直接连接两个细胞的细胞质的一种特殊细胞间连接,是多种分子、离子在细胞间传递信号的直接通道,是多种器官正常发育的重要保障[15-16]。研究表明,通过改变间隙连接或可对肿瘤药物治疗产生直接影响[17-19]。由此可见,三种细胞连接均与肿瘤的发生密切关联。目前,多数研究主要针对其中一种连接类型为主要探讨对象。
白细胞介素在传递信息、激活与调节免疫细胞及在炎症反应中起到至关重要作用,故在研究领域中颇受关注。其中,IL-6在疾病包括肿瘤中的研究应用相对较多[20-23],有关IL-6在肾癌中的研究分析也相对较多,但对于IL6是如何促进肾癌发生发展的研究尚无明确定论[24-25]。我们从MsigDB数据库下载三种细胞连接的相关基因,结合TCGA 肾癌转录组数据,通过Lasso-Cox回归分析构建了细胞连接通路的风险模型,并分别从临床相关性及功能富集分析、免疫相关性、药物敏感性等多方面进行分析。此外,经计算筛选出影响细胞连接通路的关键基因IL6,经分析发现IL6表达仅对高风险组肾癌患者的生存预后造成影响,而对低风险组患者生存预后无影响,并构建了包含IL6及肾癌临床特征的列线图。
1 资料与方法
1.1 筛选差异基因
从TCGA 官网(https://www.cancer.gov/)下载肾癌转转录组数据(包括肾乳头状癌、透明细胞癌、嫌色细胞癌)和肾癌患者的临床信息;从MSig-DB 官网(https://www.gsea-msigdb.org/gsea/msigdb)下载三种类型细胞连接通路基(KEGG_ADHERENS_JUNCTION,KEGG _ TIGHT _JUNCTION,KEGG_GAP_JUNCTION)。基于TCGA 肾癌基因表达数据矩阵,筛选细胞连接通路差异基因。设置条件为|LogFC|>1,FDR 矫正后的P值<0.05。单因素Cox回归筛选预后相关基因,对具有预后价值的差异基因进行Lasso-Cox回归分析,用于构建风险模型。
1.2 构建风险基因预后模型
R 软件包运行Lasso-Cox回归分析,风险模型通过下式计算:
式中,h(t)和h0(t)分别为时间t的风险函数和基线危险函数,Xn和bn分别为基因n的表达量和偏回归系数。
1.3 临床应用分析及功能分析
根据风险模型,对每个肾癌病人进行风险评分,以风险评分中位数为临界值将肾癌患者分为高风险组和低风险组。由Kaplan-Meier绘制生存曲线比较组间总生存率(OS);从UCSC XENA 数据库(www.genome.ucsc.edu)下载肾癌生存数据,验证风险模型的可行性。受试者工作特征(ROC)曲线评估风险模型预测患者生存率的敏感性和特异性;运用PCA 分析观察风险基因模型区分高低风险病人的准确性。进一步探究风险模型与临床特征之间的相关性,采用R 软件GSVA 包探索高低风险组间的差异通路。
1.4 免疫分析与药物敏感性
CIBERSORT 方法计算免疫浸润水平在高低风险组的病人分布情况,采用R 包不同的计算方法分析风险基因与免疫细胞之间的相关性;用TIDE 数据库(https://cistrome.shinyapps.io/timer/)比较高低风险组对免疫治疗的反应效果。基于风险基因模型,用Cell Miner 数据库(https://discover.nci.nih.gov/cellminer)筛选潜在的肾癌治疗药物。
1.5 核心基因在肾癌中的临床应用分析
基于高低风险组筛选差异基因,用String数据库(https://string-db.org)绘制PPI蛋白互作网络图,用Cytoscape(https://cytoscape.org)筛选核心基因,分析核心基因的表达对肾癌生存预后的影响以及与临床特征之间的相关性。基于高低风险组进行分层分析,分别在高低风险亚组中将核心基因表达值中位数作为临界点,分为核心基因高低表达组,K-M 法绘制生存曲线比较核心基因表达对患者生存预后的影响。
1.6 核心基因与风险基因的相关性
用TIMER 数据库分析核心基因与风险基因的相关性。
1.7 统计学分析
所有的统计学分析基于R 软件包与数据库计算,P<0.05具有统计学意义。
2 结果
2.1 数据特征及差异基因
从TCGA 中下载肾癌的转录组数据(包括肾乳头状癌、透明细胞癌、嫌色细胞癌)及临床信息(见表1),得到899例肾癌组织及129例正常组织样本基因表达矩阵。从MSigDB 数据库中下载三种细胞连接主要类型通路相关基因共计295个。与正常组织相比,在肾癌组织中共筛选出109个细胞连接通路相关差异基因(|LogFC|>1,FDR<0.05),31个下调基因,78个上调基因。
在传统行业的冰洗空方面,大部分家电产品都已经融入了智能化的功能,例如冰箱产品能够鉴别冰箱内食材的质量情况,辅助用户在线购买食材。空调器产品能够通过大数据、物联网的辅助,自动为消费者调节最舒适的空气温湿度环境。包括生活电器、厨电、小家电类产品,5G有助于家电实现智慧家庭全局掌控,打开目前智能家电在标准、接口、平台方面的混乱局势,为不同品牌、型号、品类的家电产品打造健康的发展环境。

表1 TCGA肾癌(乳头状上皮细胞癌、嫌色细胞癌、透明细胞癌)临床样本特征
2.2 构建细胞连接通路基因风险模型
通过单因素Cox回归筛选与生存预后相关的基因,进一步使用Lasso-Cox 回归构建风险模型。最终构建了包括12个基因的风险模型:L1CAM,b1=0.115 5;NRXN3,b2=-0.302 5;CLDN11,b3=0.444 4;CNTNAP1,b4=0.353 2;MYH3,b5=0.528 4;YBX3,b6=0.288 6;TUBA1B,b7=0.299 3;TUBA8,b8=1.784;ADCY2,b9=-0.814 0;MYH10,b10=-0.131 3;CGN,b11=-0.153 5;CLDN10,b12=-0.147 1。
2.3 风险评分的预后分析
从UCSC 网站下载肾癌患者无瘤生存时间(PFS)。如图1 所示,Kaplan-Meier曲线结果显示高风险组无进展期(PFS)短于低风险组,高风险组总生存时间(OS)明显缩短。

图1 高低风险评分与肾癌生存预后的关系
接下来,我们对肾癌患者的临床特征及风险评分分别进行单因素与多因素Cox分析,结果提示高风险评分可作为肾癌患者的独立预后危险因素,见图2。

图2 单因素Cox回归森林图左与多因素Cox回归森林图右
PCA 分析能准确区分高低风险组。对细胞通路基因及风险组基因进行主成分(PCA)分析,结果提示模型基因表达量可准确区分高低风险组患者,见图3。图4 显示:1 a 时的ROC 曲线下面积(AUC)为0.849,3 a时AUC 为0.756,5 a时AUC为0.765。对临床特征及风险评分均绘制ROC 曲线,结果显示,风险评分曲线下面积最大。

图3 细胞连接通路基因PCA分析与模型基因PCA分析

图4 风险模型ROC曲线与临床特征构建ROC曲线
2.4 风险评分与临床特征间的关系
根据风险评分中位数将患者分为高低风险组,分析风险模型与临床特征的关系。在肿瘤分级中,G3组风险评分大于G2组和G1组,G2组大于G1组风险评分;在肿瘤分期中,StageⅣ的风险评分最高,StageⅢ的风险评分大于StageⅡ;在T 分期中,T4组的风险评分大于T3组,T3组风险评分大于T2组;在N 分期中,N1期风险评分大于N0期;在M 分期中,M1组风险评分大于M0组(P<0.05)。
2.5 风险模型与免疫细胞浸润之间的关系
根据CIBERSORT 算法,计算高低风险评分与免疫细胞浸润之间的关系,结果显示:在记忆B 细胞、CD8T 细胞、激活的CD4T 细胞、滤泡辅助性T细胞、静止的NK 细胞、M1巨噬细胞中,高风险评分组分数较高;在M2巨噬细胞、静止的肥大细胞中
低风险评分组分数较高。基于不同的免疫浸润计算方法,计算风险基因与不同免疫细胞浸润之间的关系,结果显示:CNTNAP1 与癌症相关成纤维细胞呈正相关,CLDN11与癌症相关成纤维细胞呈正相关,MYH10与CD4T 细胞呈负相关、与NK 细胞呈负相关,YBX3与M1巨噬细胞呈正相关,CLDN10与中性粒细胞呈正相关。
2.6 药物敏感性
TIDE 数据库表明高风险评分的免疫治疗效果较差。我们进一步采用Cell Miner数据库筛选可能应用于肾癌化疗的药物。药物敏感性与高低风险组的关系如图5所示:随着CLDN10表达越高,患者对LOXO-101(拉罗替尼)、NMS-E628(恩可替尼)越敏感;随着YBX3表达的增加,患者对Deleukin diftitoxontak(地尼白介素)、Cinchonidine(辛可尼丁)的耐药程度增加;随着NRXN3的表达增高,患者对Belinostat(贝利司他)、Methotrexate(甲氨蝶呤)、Malacid(苹果酸/乙胺嘧啶)、Melbex(肌苷单磷酸脱氢酶抑制剂)的耐药性增加,对Cyclobenzaprine Hydrochloride(盐酸环苯扎林)的药物作用越敏感;ADCY2的表达增加,患者对Dabrafenib(达拉非尼)的治疗越敏感,对Vemurafenib(维莫非尼)的耐药性增加;CGN 的表达增加,则患者对Acetalax(乙二醇/醋酸氧苯沙丁)、Bisacodyl(比沙可啶)的治疗效果越敏感;TUBA8 的表达则使患者对Docetaxel(多西他赛)的耐药性增强;随着CNTNAP1表达量的增加,患者对Temsirolimus(坦西莫司)、Bleomycin(博来霉素)的治疗效果越明显。
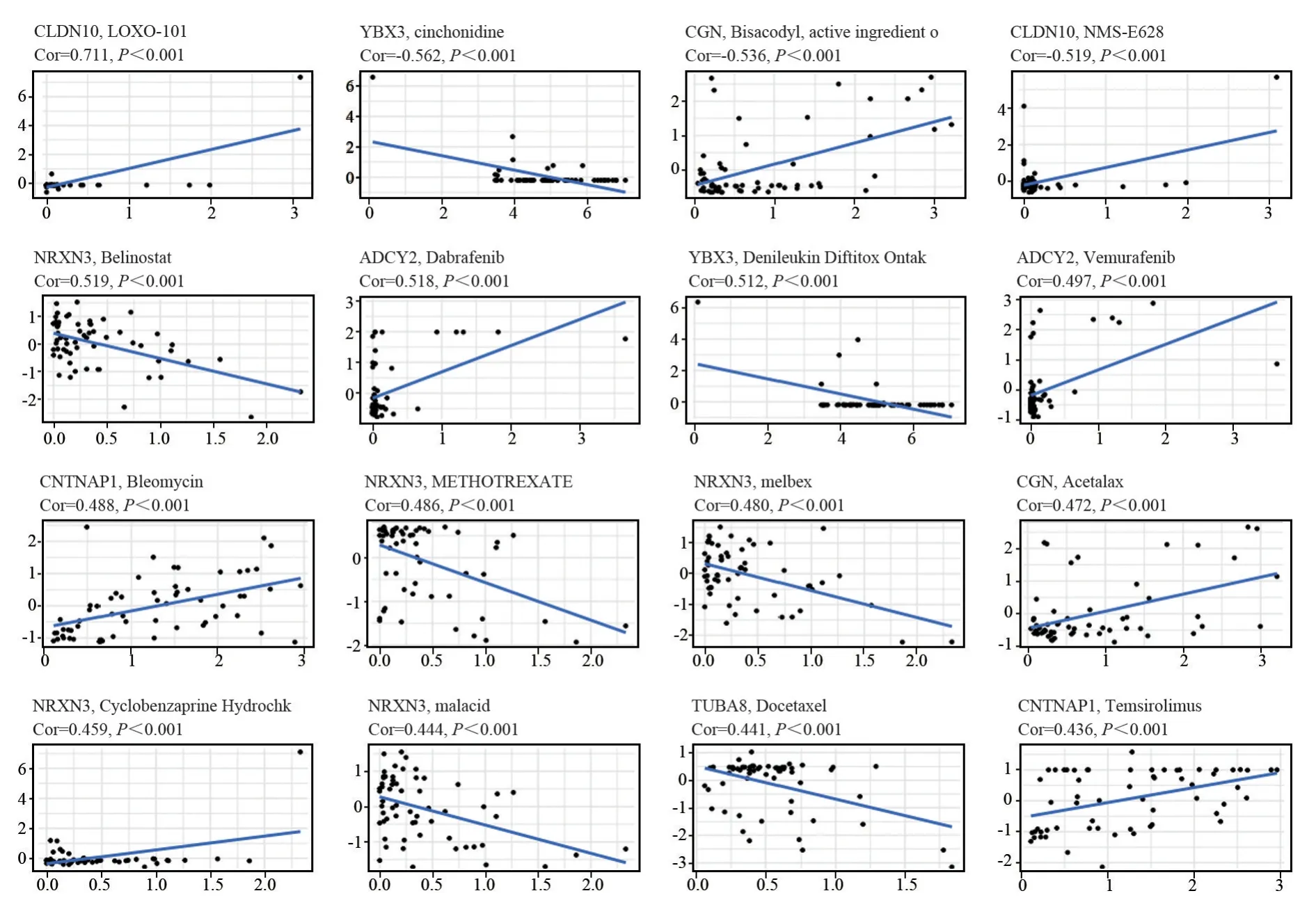
图5 风险基因与药物敏感性
2.7 功能分析
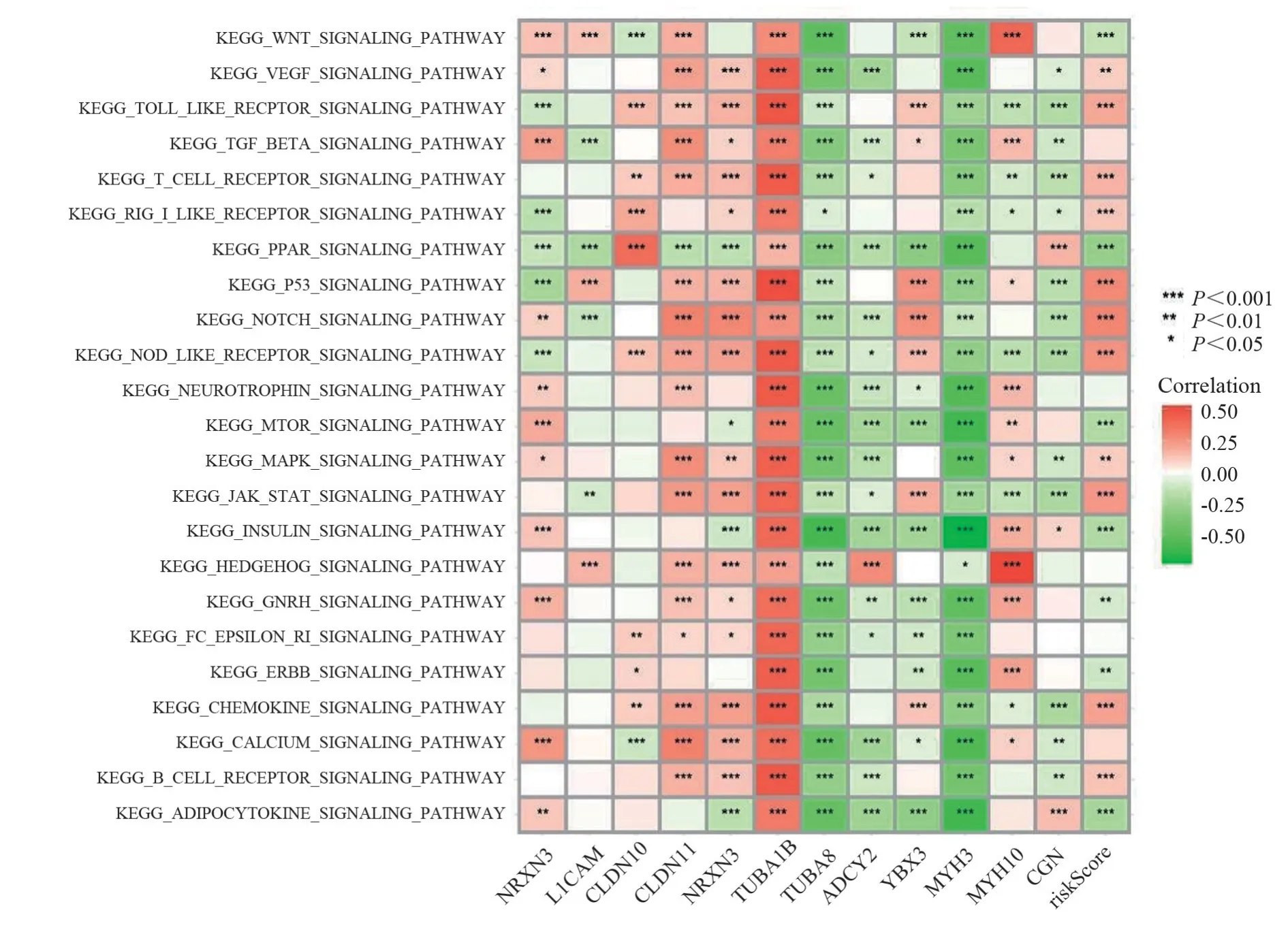
图6 GSVA富集分析风险评分潜在的作用通路
2.8 风险组间差异基因
基于以上结果可看出包含12种基因的风险模型在肾癌中具有重要的研究价值。为了进一步分析风险评分是如何影响肾癌的进展,基于风险评分将肾癌患者分成高低风险组,筛选组间差异基因(LogFC=2,FDR<0.05),如图7为用String数据库及Cytoscape绘制的差异基因网络图,基于邻近基因节点数目的多少,使用Cyto Hubba插件中Degree method计算方法筛选核心差异基因,得到IL6为最显著核心基因。

图7 Cytoscape筛选风险差异核心基因
3 IL6与肾癌临床特征的关系
根据肾癌转录组数据表达矩阵将肿瘤患者分为IL6高表达组与IL6低表达组,K-M 法绘制生存曲线,IL6高表达组患者生存期短于IL6 低表达组。在肿瘤分级中,G4 组IL6 表达分别大于G3 组和G2组中IL6表达,G3与G2组的IL6表达分别大于G1组中IL6的表达。
3.1 构建列线图
纳入IL6、年龄、性别、肿瘤分级、肿瘤分期构建列线图(图8A),用于预测肾癌患者的生存率。校准曲线(图8B)评估列线图的准确性,C 指数为0.775,提示列线图具有较准确的生存预测能力。

图8 临床特征列线图
3.2 IL6的表达分别对高低风险组预后的影响
在高低风险组中分别以IL6的表达值中位数为临界点,将患者分成IL6高低表达亚组。KM 法绘制生存曲线,比较两亚组之间的生存差异。如图9所示,在高风险组中,IL6 高表达组生存时间短于IL6低表达组;在低风险组中,IL6高表达组与IL6低表达组患者无生存差异。

图9 IL6的表达对高低风险组预后的影响
3.3 IL6与风险基因的相关性
基于上述结果,IL6高表达对高风险评分组患者生存影响明显,而对低风险评分组患者无明显生存影响。采用TIMER 数据库进一步分析了IL6与风险基因的相关性。在肾嫌色细胞癌病理类型中IL6与CNTNAP1正相关;在上皮乳头状癌类型中IL6与CLDN11、L1CAM 正相关;在透明细胞癌病理类型中IL6与CGN 呈负相关、IL6与CLDN11、CNTNAP1、TUBA1B、BX3(CSDA)正相关。
4 讨论
细胞连接在细胞间相互通讯及作用中发挥着重要作用,与多种疾病及肿瘤的发生密不可分[26-27]。本次研究以广泛细胞连接通路相关基因为研究目标,基于TCGA 数据库下载的肾癌转录组数据(包括肾透明细胞癌、乳头上皮状癌、嫌色细胞癌)成功构建了包含L1CAM、NRXN、CLDN11、CNTNAP1、MYH3、YBX3、TUBA1B、TUBA8、ADCY2、MYH10、CGN、CLDN10等12个基因的风险模型,在UCSC 数据库下载了肾癌生存数据,验证了高风险评分可作为肾癌独立预后危险因素的可行性,同时经过分析得出风险评分在肾癌的临床方面具有重要的临床价值;同时计算出风险评分与免疫浸润及免疫治疗效果间均存在密切关联,通过Cell Miner数据库发掘了与风险基因相关的治疗药物。使用GSVA 分析得出高低风险评分在多条重要通路间存在差异,所涉及通路多数为肿瘤发生发展直接相关的重要通路,如JAK-STAT、NOTCH基因信号通路、P53信号通路、B 细胞受体通路、趋化因子通路、酪氨酸激酶转录因子通路、WNT 信号通路、T 细胞受体通路、血管内皮因子等信号通路[28-30]。为了进一步分析风险基因在肾癌中的应用,基于高低风险评分,筛选组间差异基因,结果显示IL6为风险评分的核心差异基因。IL6作为趋化因子家族常见的成员之一,在多种类型肿瘤中具有重要的表达,在肾癌中的研究也有报道。我们首先验证了IL6高低表达对肾癌患者的预后存在影响,且与临床特征构建的列线图在预测肾癌患者的生存率方面具有一定的临床应用价值。接下来进行分层分析,结果发现在高风险组患者中,IL6高表达明显缩短患者生存预后,而对低风险组患者无生存预后影响,此结论为本文的创新点所在。最后,使用TIMER 数据库分析IL6 分别与12 个风险基因的相关性,结果发现IL6 在肾癌中与CNTNAP1、CLDN11、L1CAM、TUBA1B、YBX3(CSDA)均呈现相关性。
信号转导通路贯穿细胞生长的始终,从细胞膜上的信号分子到细胞核内的转录因子任何一个环节问题均可导致肿瘤的发生[31]。细胞间连接的主要作用在于增强细胞间的交流、对细胞间的物质交换,维持机体稳态起重要作用,在细胞连接通路中存在大量基因,我们通过差异分析及筛选最终得到包含L1CAM、NRXN3、CLDN11、CNTNAP1、MYH3、YBX3、TUBA1B、TUBA8、ADCY2、MYH10、CGN、CLDN10等12个基因的风险模型。L1CAM(L1细胞黏附分子)属免疫球蛋白超家族成员,最初在神经组织中被发现,L1CAM 在多种类型肿瘤中呈现高表达趋势,并且L1CAM 与EMT、血管异常生成、肿瘤细胞的耐药性等多种肿瘤进展因素相关[32];NRXN3可促进神经递质的释放,最早被发现在神经系统病中发挥关键作用,后在肿瘤中也有所报道,在肾癌中的研究相对较少[33-34];Claudin蛋白家族是细胞紧密连接的主要蛋白,在维持细胞动态平衡中起重要作用,与肿瘤细胞的侵袭、转移相关,此次在我们的模型中包含CLDN11、CLDN10两个Claudin蛋白家族成员。已有报道证实CLDN10低表达提示肾透明细胞癌的进展,CLDN11高表达预示肾透明细胞癌较差的预后,我们的研究与报道相一致[35-37];髓鞘粘连相关蛋白(Caspr)家族是细胞信号转导和激活神经元细胞内功能的一种跨膜蛋白,CNTNAP1是该家族中被发现的第一个成员,尤其是与免疫浸润、功能之间的关系被广泛研究,有研究表明CNTNAP1或可作为透明细胞癌潜在的治疗靶点,在我们的研究中提示CNTNAP1高表达预示肾癌较差的预后[38];肌球蛋白超家族在物质运输、肌肉收缩等多种生理活动中发挥重要作用,MYH3作为其中一员主要与人类某些遗传病存在关联,然MYH3在肿瘤中的研究相对较少[39];YBX3作为近些年的热点转录因子,编码具有高度保守的冷休克结构域的蛋白质,在代谢过程中具有重要作用,在多种类型的肿瘤中均有所报道,且与MAPK、PI3/Akt等一些重要的通路相关联[40-42];微管蛋白(TUBA1B)是构成细胞骨架的主要成分之一,参与构成细胞骨架、物质交换和转运,在肿瘤中同样存在微管蛋白的异常表达,如在结肠癌中TUBA1B高表达,是CD8T 细胞耗竭的重要原因,微管蛋白α8(TUBA8)则在肿瘤中的研究相对较少[43];ADCY2属于膜相关蛋白酶,与肿瘤免疫微环境及生存预后相关,且在多种类型肿瘤中均为风险基因[44-45];有多篇文献报道,MYH10在肾癌中低表达,其表达水平影响肾癌患者生存预后,在我们的研究中,MYH10高表达是肾癌的一种保护性因素,与报道相符合[46-47];CGN 在肿瘤中的表达作用也有报道,但在肾癌中的研究相对较少[48-49]。作为一种炎性细胞因子,IL6在防御病原体和调节人体免疫系统方面起着不可替代的作用,其表达缺失或增加均可导致人类疾病的发生,包括肿瘤的发生。在此次的研究中,当对所有的肾癌患者分析时,IL6高表达提示患者预后不良。而进行分层分析后,我们发现IL6高表达仅影响高风险组患者生存时间。此外,IL6-JAKSTAT 通路在细胞增殖分化、炎症反应、肿瘤生长中均为重要通路。此次发现在高低风险组中JAKSTAT 为差异通路,风险基因是否与IL6-JAKSTAT 通路相互作用而影响肾癌的发展有待进一步研究。
基于上述研究分析,我们认为IL6通过与风险基因相互作用进而影响患者的生存预后,日后将进一步采取实验验证。

