多模态MR成像在乳腺良恶性病变的诊断价值及其与乳腺癌预后的相关性分析
王颖,王斌杰,周依
河南大学淮河医院 医学影像科,河南 开封475000
随着乳腺癌发病率及病死率的增长,临床关于乳腺癌的研究逐渐增多,有研究[1]证实早诊断、早治疗对乳腺癌病情进展的控制以及转归具有重要意义。2010年Gillies[2]首次提出影像组学的概念,意在通过放射影像的高通量进行特征提取,并建立数据库对个体疾病诊断治疗进行科学指导。影像组学是目前临床上常用的无创预测肿瘤分型、预后等多方面的手段[3-5]。磁共振(MRI)是临床上乳腺病变检查的常用手段。弥散加权成像(DWI)是通过计算表观弥散系数(ADC)值,其可以对水分子在人体组织中的布朗运动达到量化与可视化,侧面评估了组织的微结构[6]。在生物组织中,其细胞密度、细胞膜的完整度均与水的扩散程度成负相关性。由于乳腺肿瘤存在完整细胞膜、高细胞密度,会更大程度的对水分子的运动进行限制,所以DWI影像中肿瘤呈现高信号,而在ADC 影像中呈现低信号[7-8]。动态增强扫描(DCE-MRI)能够对肿瘤内血管生成情况及血流动力学变化状况进行检测,在使用对比剂后能够观察到病灶的形态和其内部微血管的状态。本研究通过多模态MRI成像技术对乳腺的良恶性病变之间的影像学参数差异,探讨其影像学参数ADC和灌注时间信号强度(TIC)曲线类型对乳腺良恶性病变的鉴别作用。
乳腺癌常见的病理信息有病理分级、肿瘤大小、淋巴结转移等指标,了解病理信息可以预测患者的预后情况;对这些指标进行了解,增加对其的了解,对患者的治疗计划和预后评估都有重要意义。有学者[9]发现MRI的参数ADC值和乳腺癌的预后因子例如病理分级、腋窝淋巴结转移及肿瘤大小存在显著相关性;但目前相关研究仍需进一步深入研究,本文就MRI成像参数ADC 值和乳腺癌的预后因素(病理分级、肿瘤直径、腋窝淋巴结转移情况等)的相关性进行研究。
1 资料与方法
1.1 临床资料
选择某院在2021年3月~2022年1月入院治疗的患有乳腺病变的59例(67个病灶)患者,所有入组患者术前均进行DWI、T1WI、T2WI、DCE-MRI等检查,后经病理学确诊有35个恶性病变与32个良性病变,患者的平均年龄是(46.37±11.62)岁。
纳入标准:(1)患者已做前哨淋巴结(Sentinel lymph node,SLN)活检且活检结果完整。(2)术前患者已行多参数MRI检查且影像清晰。(4)患者的所有临床资料完整。
排除标准:(1)MRI项目不全或影像不清晰。(2)在进行MRI检查前进行过化疗、放疗等治疗。(3)在进行MRI前进行过活检。(4)在手术后进行的磁共振检查。
1.2 磁共振检查
1.2.1 检查设备
两组患者均使用同一台西门子Verio 3.0T 磁共振机进行MRI检测。
1.2.2 磁共振检查方法
患者取仰卧位,呼吸平稳,躯体和扫描床呈平行状态,手臂上举过头顶,双乳自然下垂于线圈内,头部先进入机器,再常规定位扫描后使用下列参数进行扫描,扫描参数见表1。
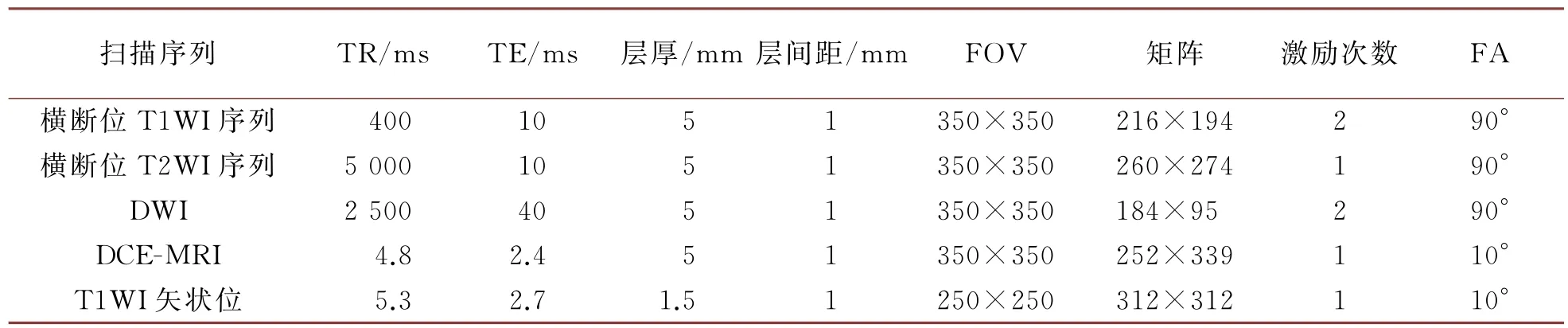
表1 磁共振各序列扫描参数
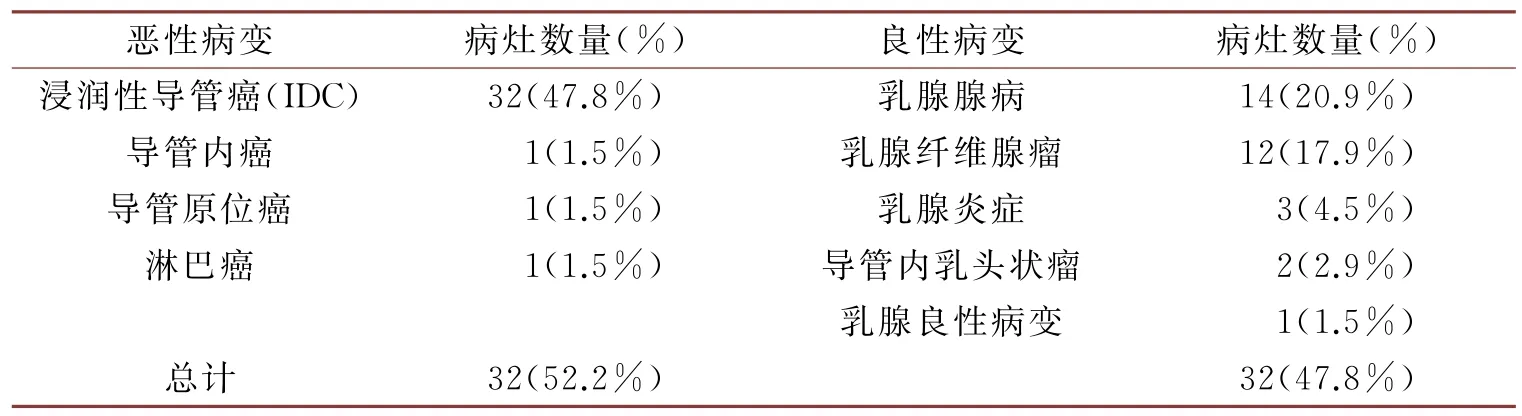
表2 病理学检测结果分析
扫描序列包括:横断位T1WI序列、横断位T2WI序列、DWI、DCE-MRI及高分辨率增强抑脂序列T1WI矢状位。DWI使用单次激发平面回波成像序列(SSEPI),设定b值为800 s/mm2。DCE-MRI使用的扫描轴位是T1高分辨率各向同性容积采集技术轴位,扫描设置为:单次扫描80 s,反复扫描6次,间隔时间为18s;使用钆喷酸葡胺(Gd-DTPA)注射,采用高压注射器进行静脉注射,含量对比剂用量是0.2 mmol/kg,流速是3 mL/s;注射结束后按照上述流速进行冲管,冲管材料是用20 mL生理盐水,3 mL/s冲洗,连续动态增强;进行5次扫描,扫描时间总计505 s。在DCE-MRI扫描完成后进行高分辨率增强抑脂序列T1WI矢状位扫描,扫描时间是108 s。
1.3 图像分析
由2位在临床乳腺MR 影像学经验8年以上的放射科医师进行勾画,两位放射科医生对所有研究患者的病理检查结果均不了解。当两位医师的图像处理结果不一致时应交由影像诊断学主任医师进行处理。
影像组学研究使用多参数MRI影像(T1+C、T2WI、DWI及DCE-MRI)进行,分割收集的乳腺原始影像的病灶。ROI的绘制在3Dslicer V4.10.2(https://www.slicer.org/)上操作,这个软件可以进行半自动分割功能。手动多边形勾画感兴趣区(ROI),需要避开囊变和坏死的部位,要尽可能的将全部肿瘤结构组织都进行手动勾画。多次测定取平均值、ADC值和TIC值,TIC曲线共分为I型(病变信号强度呈持续上升趋势)、II型(早期病变信号强度增强,且中晚期保持在较高水平)、III型(早期病变信号强度快速加强,中晚期则减弱)及IV 型(病变信号强度始终保持在较低水平)4个分型。
1.4 病理学资料
对诊断为乳腺浸润性导管癌(IDC)的患者(n=32)取与ADC值测定部位的病理标本,所有病理标本均由具有8年以上临床经验的病理科中级职称以上医师进行诊断,对标本的病理诊断和分级、肿瘤大小及腋窝淋巴结转移状态进行判定。在本研究中病理分级采取乳腺组织学的半定量评级法,共3级。
1.5 统计学方法
数据分析应用SPSS 20.0软件。以病理诊断作为金标准对ADC值鉴别诊断乳腺良恶性疾病的临界值进行分析,其评价指标是:敏感度(sensitivity)、准确度(accuracy)、特异度(specificity),不同诊断方式的诊断结果对比使用约登指数z检验。相同病理分级的IDC 之间的ADC 值对比使用LSD 多重检验,不同病理分级的IDC 之间的ADC 值差异对比及相关性分析分别使用单因素方差分析(one-way ANOVA)和Speaman等级秩相关分析。组间ADC值使用均数±标准差()进行代表,应用t检验。使用Pearson相关分析IDC 患者年龄和ADC 值间的关系。P<0.05则说明差异显著。
2 结果
2.1 病理结果
经病理检测后,67个病灶中共确诊35个恶性肿瘤、32个良性肿瘤,具体分型见表2-1。形态学特征:恶性病变多呈不规则状、分叶状,且病灶的边缘存在毛刺征;良性病变形状多为类圆形或圆形,病灶的边缘较光滑(见图1)。

图1 DCE-MRI图像,A为乳腺纤维腺瘤,B为浸润性小叶瘤
2.2 ADC值分析
在本研究中恶性病变患者的ADC 值显著小于良性病变(详见表3),并且采用ROC 曲线进行分析,鉴别诊断乳腺良恶性病变的临界值是ADC=0.983×10-3mm2/s(详见图2、图3),即当ADC 值小于该值时病灶是恶性病变。

图2 乳腺纤维腺瘤的ADC图和常规病理切片

图3 乳腺浸润性导管癌的ADC图和常规病理切片
表3 不同病变之间的ADC值对比分析()

表3 不同病变之间的ADC值对比分析()
2.3 TIC曲线分析
在本研究中恶性病变的主要TIC 类型是II型与III型,良性病变的主要TIC 类型的I型,且具有显著差异(P<0.05),详见表4。在本研究中将I型TIC曲线看作良性病变的诊断标准,同时II型和III型为恶性病变的诊断标准。在本研究中根据TIC曲线进行诊断:有41个恶性病变病灶,26个良性病变病灶,以病理学结果作为金标准,该结果存在差别,则TIC的诊断准确度为83.6%。
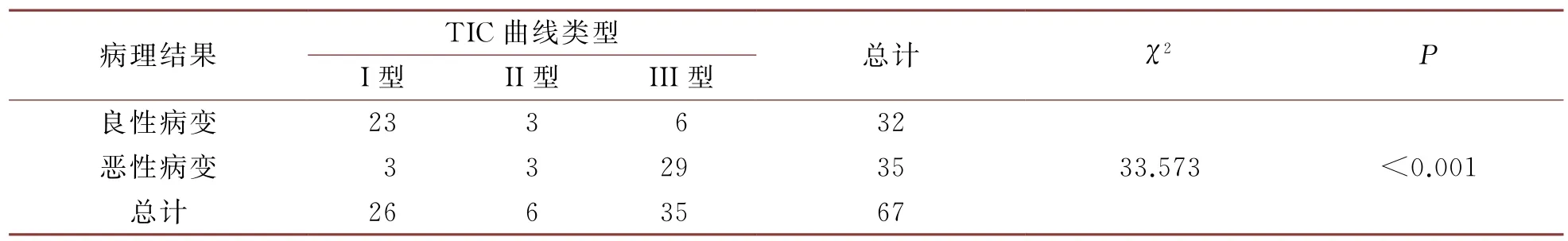
表4 TIC曲线类型分析
2.4 TIC曲线类型及DWI-ADC值的单独或联合诊断价值分析
两者联合应用时则其诊断准确率最高,其诊断效能较为明显(P<0.05)。详见表5、图4。

图4 ROC曲线分析:鉴别诊断乳腺良恶性病变的ADC值、TIC曲线及其联合应用价值
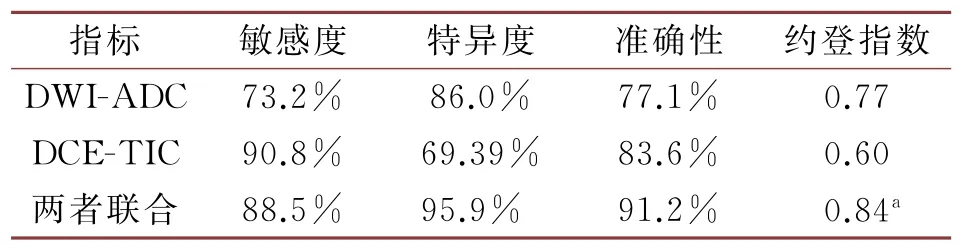
表5 DWI-ADC、DCE-TIC曲线类型单独或联合诊断乳腺良恶性病变的诊断效能分析
2.5 ADC值与IDC患者预后的相关性分析
在本研究中,IDC病灶在DWI(b=800 s/mm2)上表现为高信号,在ADC图中表现为低信号。32个IDC病灶中,对其病理分级、ADC值进行单因素方差组间分析发现具有显著差异(P<0.05),(详见表6);组内分析使用LSD多重比较显示病理分级Ⅰ级和Ⅱ级、Ⅰ级和Ⅲ级的ADC值具有显著差异(P<0.05);进行Spearman等级秩相关分析发现IDC的病理分级和ADC值之间具有显著的负相关性(r=-0.496,P<0.05)。在本研究中有15例IDC患者发生腋窝淋巴结转移,以患者是否发生腋窝淋巴结转移作为分组依据,ADC值比较结果发现不存在显著差异(P>0.05)。肿瘤直径以2cm 为分界线进行分组,发现肿瘤直径与ADC值之间不存在显著差异(P>0.05)。通过Pearson相关性分析发现,IDC患者年龄和ADC值之间不存在统计学意义(P=0.912)。
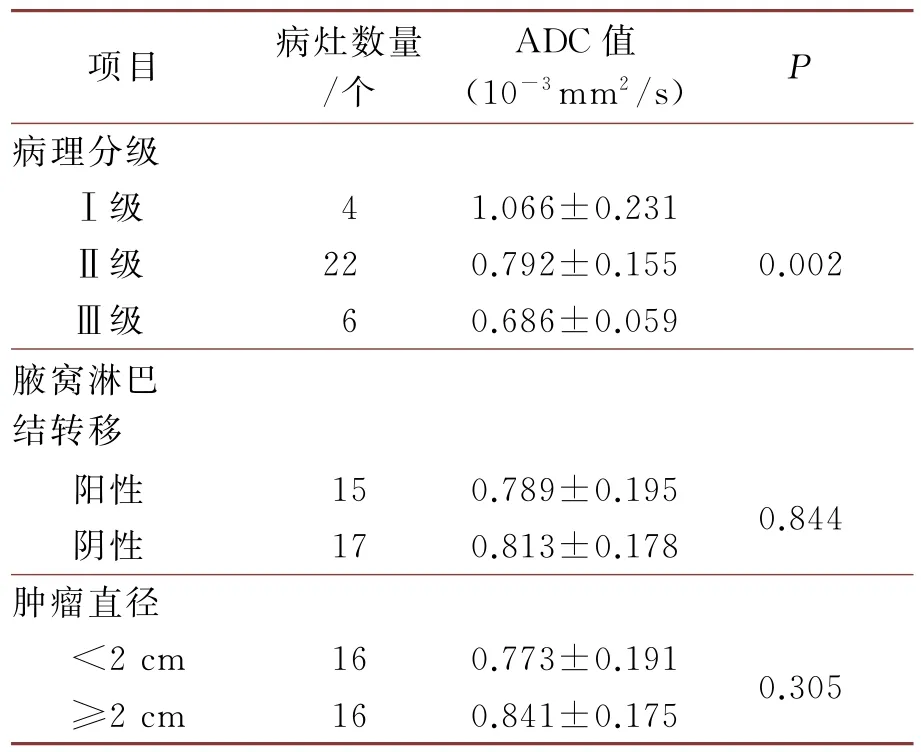
表6 ADC值和IDC患者不同预后因子之间的相关性分析
3 讨论
目前临床上常用的乳腺MRI多为DCE-MRI、T1加权序列、T2加权成像序列、扩散加成成像。DWI是通过计算ADC可以对水分子在人体组织中的布朗运动达到量化与可视化,侧面评估了组织的微结构[6]。ADC值能够说明扩散加权成像上的组织信号强度的改变情况[10-11],在本研究中敏感系数b值选取0~800 s/mm2。目前临床上DWI成像通常使用SS-EH 采集技术,能够缩短回波时间及回波链长度,加速空间信号采集速度,避免运动伪影等,可以获得清晰度更高的成像,在本研究中就采取的该方式。在生物组织中,组织的细胞密度、细胞膜的完整性均与其内水的扩散程度成负相关性。由于乳腺肿瘤有较高细胞密度,会更大程度地对水分子的运动水平进行限制,所以DWI影像中肿瘤呈现为高信号,而在ADC影像中呈现低信号[12-13],这与本研究中的成像结果一致。应用ROC曲线分析结果显示鉴别乳腺良恶性病变的临界值是ADC=0.983×10-3mm2/s,即当ADC值小于该值时病灶是恶性病变,此时准确率最佳。但是DWI-ADC的图像分辨率偏低,在临床上常和DCEMRI联合应用进行乳腺良恶性病变的鉴别诊断。
DCE-TIC 作为临床上乳腺疾病检查的常用手段,其通过对形态学及血流动力学进行分析以确定乳腺病变性质。在疾病的发展过程中,其病变强化程度和病灶组织细胞外间隙的渗透度、微血管结构及密度存在关联,恶性肿瘤在细胞增殖过程中会分泌大量的相关血管生成因子,此物质能够加速血管的生长及分化,增加病灶内毛细血管的密度,因此当注射对比剂后,注射早期则会快速进入病变病灶内部,此时强化表现为“快进”,但良恶性病变病灶内部的毛细血管的动静脉分流程度不同,因此对比剂流中后期的流入速度不同,会呈现快速下降或保持在较高水平,所以TIC 曲线类型会有所差异[14-15],在本研究中TIC 曲线类型能够对乳腺良恶性病变进行鉴别,恶性病变的主要TIC类型是II型与III型,良性病变的主要TIC 类型的I型,且具有显著差异[16],这和Mann 等[17-18]多位学者的研究结果一致,但是DCE-TIC 单独诊断时的特异性偏低。所以在本研究中DWI-ADC、DCE-TIC 曲线类型联合应用于乳腺良恶性肿瘤鉴别诊断时,诊断准确度最高,且可对两者单独诊断时的缺点进行弥补。
在本研究中为了减小乳腺癌组织学类型差异对ADC值的区别,选取IDC进行研究。ADC值的大小会随着组织细胞内水分子扩散程度而变化,常见的影响因素有细胞膜的通透性、细胞密度的大小、细胞内外间隙的大小、组织细胞内血流灌注状态、体液的粘滞程度等[19]。乳腺癌因其具有较高的细胞密度、细胞外间隙偏窄、偏大的细胞核,同时较良性肿瘤而言,乳腺癌内的血管内皮生长因子表达水平更高、微血管密度更大,所以造成ADC值偏小[20]。有学者研究表明,ADC值越小则其恶性病变的可能性更大,这和本研究结果基本一致[21]。在本研究中将IDC的病理分级分为3级,分级越高则肿瘤的腺腔越大、细胞核异型性细胞偏小与核分裂数量减少,则细胞外基质降低,水分子扩散运动受限,从而ADC值减小,所以在本研究中对其病理分级、ADC值进行单因素方差组间分析发现具有显著差异,在本研究中发现IDC的病理分级和ADC值之间具有负相关性(r=-0.496,P<0.001);但和Aydin H 等[22]的结果相反,其结果显示ADC值和病理分级之间无显著相关性。
在本研究中IDC 患者出现腋窝淋巴结转移和未出现转移的患者之间的ADC 值进行比较,发现差异不存在显著性统计学意义。这不同于Kamitani等[23]的研究结果,这可能是由于两个研究的样本量存在差异大小不同;本研究的样本量较少,导致实验结果出现过拟合现象,P值过大,差异不具有统计学意义。本研究中发现以肿瘤直径2cm 为分界线,发现其与ADC 值之间无显著差异;这与多数学者[24]的研究结果相似。
综上所述,多模态MR 成像的参数DWI-ADC、DCE-TIC联合应用能够在某种程度上使乳腺良恶性病变的鉴别诊断率得到提升。MR 参数ADC 值和乳腺癌患者的预后因子表达水平之间存在一定相关性,能够对乳腺癌患者的预后进行评估。

