乳酸上调非小细胞肺癌细胞中总胆固醇水平的机制研究
黄登亮,张耀刚,侯静,田美媛,江源,孙莉,李志琴,童思贤,郑凯曼,姜军
1 青海大学附属医院,青海西宁 810000;2 青海大学研究生院,青海西宁 810000
肺癌是全球范围内发病率(11.4%)仅次于乳腺癌(11.7%),但病死率(18%)最高的恶性肿瘤[1]。在我国,肺癌新增病例和死亡病例均居恶性肿瘤之首[2]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占所有肺癌的80%;大多数NSCLC 患者就诊时已处于中晚期,预后较差。21 世纪以来,在NSCLC 治疗方面,靶向治疗和免疫治疗取得了较大进展[3-6],但肺癌的诊疗仍需新的突破。代谢重塑是肿瘤细胞的重要特征之一,研究发现肿瘤组织中胆固醇水平升高[7],且高胆固醇含量与肿瘤细胞耐药性有关[8],抑制胆固醇合成可以减弱肺癌细胞耐药性[9]。胆固醇是由乙酰辅酶A 经过复杂的生化反应合成的脂质,在机体生命活动中具有重要作用;虽然胆固醇水平的调节途径已很明确,但其影响因素仍有很大探索空间。乳酸蓄积是实体瘤的重要特点之一,肿瘤组织中乳酸浓度可高达20~ 30 mmol/L。研究显示,乳酸可促进人NSCLC 和小鼠肺癌进展并参与调节人非小细胞肺癌细胞糖酵解和线粒体代谢[10],且能诱导内质网中Mg2+释放进而参与急性炎症过程中的组织损伤[11]。研究表明,乳酸通过组蛋白乳酸化或乙酰化修饰引起细胞基因表达和细胞表型变化[10,12-14],还促进Treg 细胞中PD-1 表达,但具体分子机制不明[15]。因此,乳酸可作为代谢底物、信号分子和表观遗传修饰因子,在细胞生物学过程中发挥重要调节作用。本研究将探索乳酸是否会通过组蛋白乳酸化修饰或其他方式调节NSCLC 细胞中胆固醇水平,拟揭示胆固醇水平新的调节机制和乳酸的功能,为肺癌治疗探索新的思路。
材料与方法
1 实验细胞 人肺支气管上皮细胞BEAS-2B、非小细胞肺癌细胞A549 和H1299 购自中国科学院细胞库,用含10%胎牛血清的RPMI 1640 培养基培养于37℃、5% CO2、95%湿度的培养箱中。
2 实验试剂和仪器 RPMI 1640 培养基(Gibco,23400-021),胰蛋白酶(Gibco,27250-018),胎牛血清(Biological Industries,04-001-1ACS),乳酸(Sigma-Aldrich,L6402),辛伐他汀(Sigma-Aldrich,PHR1438-1G),草氨酸钠(默克,o2751),qPCR 试剂SYBR Green (Roche,0491850001),乳酸化组蛋白一抗H4 (Lys8) (景杰生物,PTM-1405),Protein G Agarose Beads (Cell Signaling Techonology,#37478),逆转录试剂盒(北京全式金生物,AT311),总胆固醇测定试剂盒(索莱宝科技有限公司,BC1985),Light Cycler 480 Ⅱ qPCR 仪(Roche),Cytation 5 细胞成像分析系统(BioTek)。
3 外源乳酸干预培养细胞 接种细胞,待细胞汇合度达到约80%时加乳酸处理,乳酸母液浓度为1 mol/L,工作浓度有0 mmol/L、5 mmol/L、7.5 mmol/L 和10 mmol/L。提取RNA、细胞内总胆固醇含量测定和染色质免疫共沉淀的细胞样品,分别在6 孔板、6 cm 培养皿和10 cm 培养皿中处理,处理时间均为24 h。
4 细胞总胆固醇含量测定 将细胞收集在异丙醇中(5×106个细胞使用1 mL 异丙醇),冰浴条件下超声波破碎细胞(功率300 W,超声2 s,间隔3 s,总时间2 min),4℃下10 000 g 离心10 min,取上清置于冰上待测。按总胆固醇测定试剂盒说明书配好标准品和工作液后,配制反应体系并充分混匀,37℃静置 15 min,反应完成后用酶标仪测定500 nm 处吸光值,通过标准品和待测样品的吸光值分析得到样品中总胆固醇含量。实验中设置复孔进行细胞计数或蛋白量测定,对胆固醇含量测定结果进行标准化。
5 qPCR 分析HMGCR、SQLE、FDPS 和GGPS1基因的mRNA 水平 取3 µg 总RNA 用于逆转录,逆转录产物稀释5 倍后进行qPCR 分析。反应体系15 µL:Roche Fastessential 7.5 µL、逆转录产物2 µL、正反向引物(10 µmol/L)各0.75 µL、ddH2O 4 µL。反应程序参照试剂说明书,qPCR 引物序列见表1。
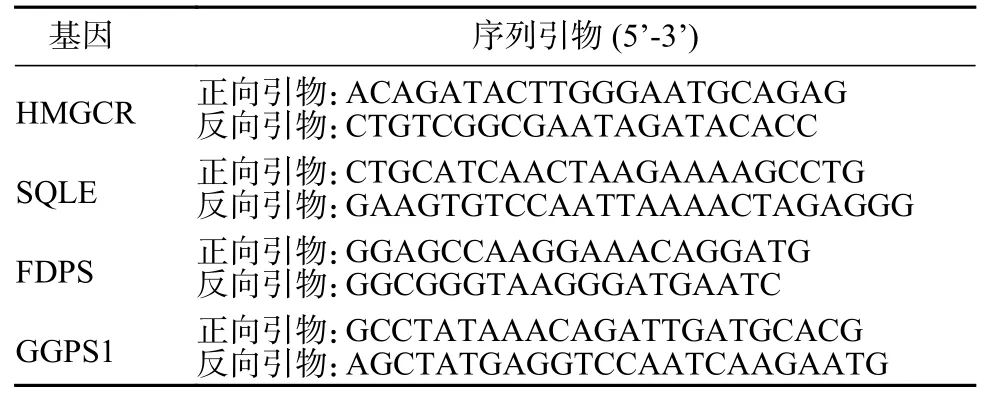
表1 HMGCR、SQLE、FDPS 和GGPS1 基因的qPCR 引物Tab.1 qPCR primers for HMGCR,SQLE,FDPS and GGPS1 genes
6 ChIP 分析HMGCR、SQLE 和GGPS1 基因启动子区的组蛋白乳酸化水平 将对照组和乳酸处理组A549 细胞用含1%甲醛的PBS 在室温交联15 min,然后用0.125 mol/L 甘氨酸终止交联;裂解细胞并用超声破碎法断裂基因组DNA,形成约500 bp 的片段;把基因组被打断的细胞裂解产物分为两份,分别加入2 µg 乳酸化组蛋白抗体和对应种属IgG、Protein G-Agarose 凝胶,在4℃垂直混旋仪孵育过夜;用洗涤缓冲液依次洗涤Protein G-Agarose 凝胶后,将蛋白-DNA 复合体洗脱并解交联;抽提纯化DNA 后进行PCR 及琼脂糖凝胶电泳分析。目的基因启动子区PCR 引物见表2。
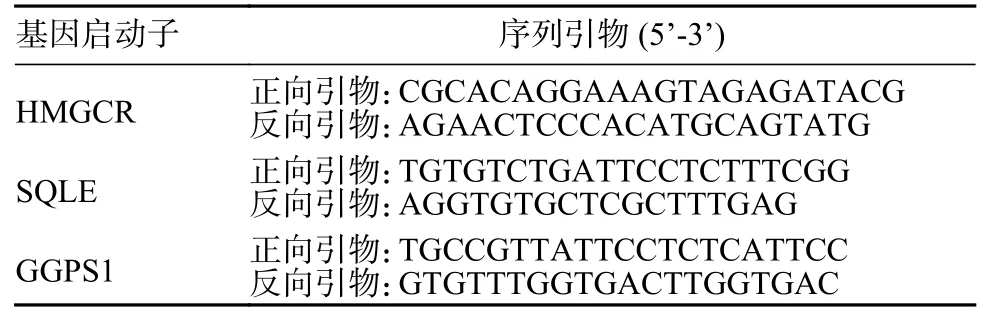
表2 HMGCR、SQLE 和GGPS1 基因启动子的ChIP PCR 引物Tab.2 ChIP PCR primers for promoters of HMGCR,SQLE and GGPS1 genes
7 统计学方法和TCGA 数据分析 利用SPSS 19.0 进行数据统计。计量资料符合正态分布与方差齐性以±s表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用Tukey’s 检验;将TCGA 数据库中肺鳞癌按乳酸脱氢酶A (lactate dehydrogenase A,LDHA)表达水平由低到高分为LDHA 低表达组(前40%)和LDHA 高表达组(后40%),Wilcoxon 秩和检验分析ACAT1、ACAT2、HMGCR、FDFT1和SQLE 在两组间的表达差异性。检验水准为双侧α=0.05。
结果
1 肺鳞癌中乳酸代谢影响胆固醇合成代谢酶基因表达 TCGA 数据库中数据集分析结果显示,LDHA 高表达的肺鳞癌,胆固醇合成途径中HMGCR (图1A)、ACAT1 (图1B)、ACAT2 (图1C)、SQLE (图1D)和FDFT1 (图1E)基因mRNA 水平均上升(P<0.05)。以上结果提示,肺鳞癌中乳酸含量和胆固醇水平存在关联。
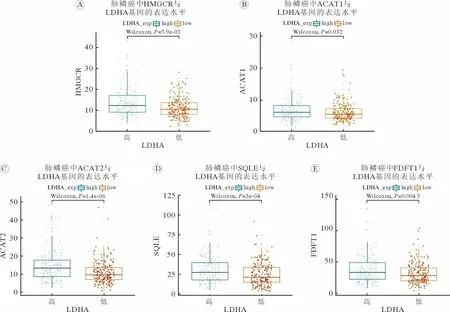
图1 LDHA 高表达的NSCLC 中胆固醇合成代谢酶基因表达上调参与胆固醇生物合成途径的代谢酶HMGCR (A)、ACAT1 (B)、ACAT2 (C)、SQLE (D)和FDFT1 (E)在不同LDHA 表达水平NSCLC 中的表达差异性Fig.1 Expression levels of genes involved in cholesterol biosynthesis increased in LDHA up-regulated NSCLC Expression levels of genes involved in cholesterol biosynthesis including HMGCR (A),ACAT1 (B),ACAT2 (C),SQLE (D) and FDFT1(E) in NSCLC with different LDHA expression levels
2 乳酸上调细胞内总胆固醇水平和胆固醇合成代谢酶基因转录 相比对照组细胞,用含10 mmol/L乳酸的培养基处理48 h后,BEAS-2B(图2 A)、A549(图2B)和H1299 (图2C)细胞内总胆固醇水平升高(P<0.01)。并且,含7.5 mmol/L 乳酸的培养基处理的BEAS-2B 和A549 细胞中HMGCR (图2D)、FDPS (图2E)、GGPS1 (图2F)和SQLE (图2G)基因的mRNA 水平升高(P<0.01)。以上结果提示,乳酸可能通过激活胆固醇合成代谢酶基因转录而上调细胞内总胆固醇水平。
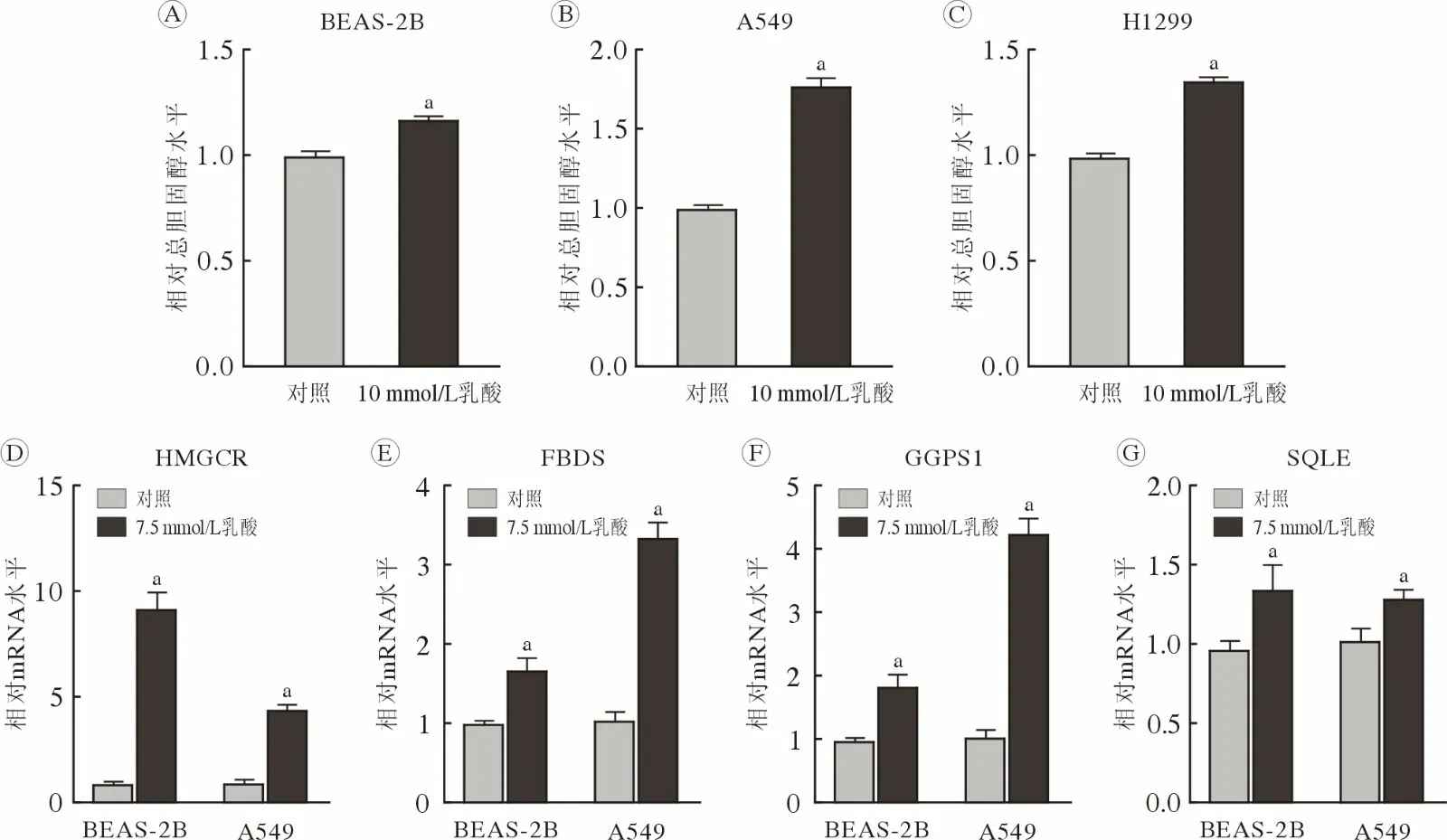
图2 乳酸上调细胞内胆固醇水平及胆固醇合成代谢酶基因mRNA 水平乳酸处理后,BEAS-2B (A)、A549 (B)和H1299 (C)细胞内总胆固醇水平;BEAS-2B 和A549 细胞中胆固醇合成代谢酶HMGCR (D)、FDPS (E)、GGPS1 (F)、SQLE (G)基因mRNA 水平(aP<0.01,vs 对照)Fig.2 Lactate triggered an increase in intracellular cholesterol and mRNA levels of cholesterol biosynthesis-related genes The intracellular total cholesterol level in BEAS-2B (A),A549 (B) and H1299 (C) cells treated with or without lactate;mRNA levels of HMGCR (D),FDPS (E),GGPS1 (F),and SQLE (G) in BEAS-2B and A549 cells (aP<0.01,vs control)
3 乳酸对细胞内总胆固醇水平的上调作用不完全依赖于改变pH 为进一步探索乳酸是否完全依赖于降低pH 而使细胞内总胆固醇水平上调,用含7.5 mmol/L 乳酸的培养基和含盐酸的培养基(pH与含7.5 mmol/L 乳酸的培养基相同)处理A549 细胞;结果显示,乳酸和盐酸处理组A549 细胞内总胆固醇水平升高(P<0.05)(图3A),且HMGCR(图3B)及FDFT1 (图3C)基因的mRNA 水平也上升(P<0.01)。但与盐酸处理组相比,乳酸处理组A549 细胞内总胆固醇水平以及HMGCR 和FDFT1的mRNA 水平上调更显著(P<0.01),提示乳酸对细胞内总胆固醇水平及胆固醇合成代谢酶基因转录活性的上调作用不完全依赖于改变pH。
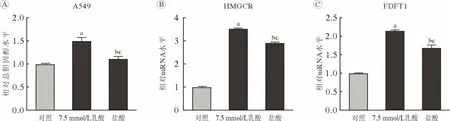
图3 乳酸和盐酸对A549 细胞内总胆固醇以及HMGCR 和FDFT1 基因mRNA 水平的影响正常培养的A549 细胞及乳酸和盐酸处理的A549 细胞内总胆固醇水平(A)、HMGCR 基因mRNA 水平(B)和FDFT1 基因mRNA 水平(C)(aP<0.01,vs 对照;bP<0.05,vs 对照;cP<0.01,vs 7.5 mmol/L 乳酸)Fig.3 Influence of lactate and hydrochloric acid on intracellular total cholesterol as well as HMGCR and FDFT1 mRNA levels in A549 cells Intracellular total cholesterol level (A),mRNA levels of HMGCR (B) and FDFT1 (C) in control A549 cells and A549 cells treated with lactate or hydrochloric acid (aP<0.01,vs control;bP<0.05,vs control;cP<0.01,vs 7.5 mmol/L lactate)
4 乳酸可能通过表观遗传修饰或作为代谢底物上调细胞内总胆固醇水平 乳酸能够通过组蛋白乳酸化修饰改变巨噬细胞基因表达及细胞表型,那么胆固醇合成代谢酶基因表达是否受组蛋白乳酸化修饰调节?染色质免疫共沉淀结果显示,用含10 mmol/L 乳酸的培养基处理细胞A549 细胞后,HMGCR、SQLE 和GGPS1 启动子区组蛋白乳酸化水平有升高趋势(图4A)。此外,乳酸能通过乳酸脱氢酶转化为丙酮酸,丙酮酸可以在线粒体中生成草酰乙酸和乙酰辅酶A,两者合成柠檬酸被转运出线粒体进入胞质后,又裂合形成草酰乙酸和乙酰辅酶A,而胞质乙酰辅酶A 是胆固醇等脂类的合成原料;乳酸是否会通过上述代谢途径转化为乙酰辅酶A 而促进胆固醇合成?使用草氨酸钠抑制乳酸脱氢酶后,A549 细胞中乳酸对总胆固醇的上调作用被逆转(图4B)。以上结果提示,组蛋白乳酸化修饰调节可能上调细胞内胆固醇合成代谢酶基因转录活性,并且乳酸也可能通过细胞内代谢转化为乙酰辅酶A,促进胆固醇合成。
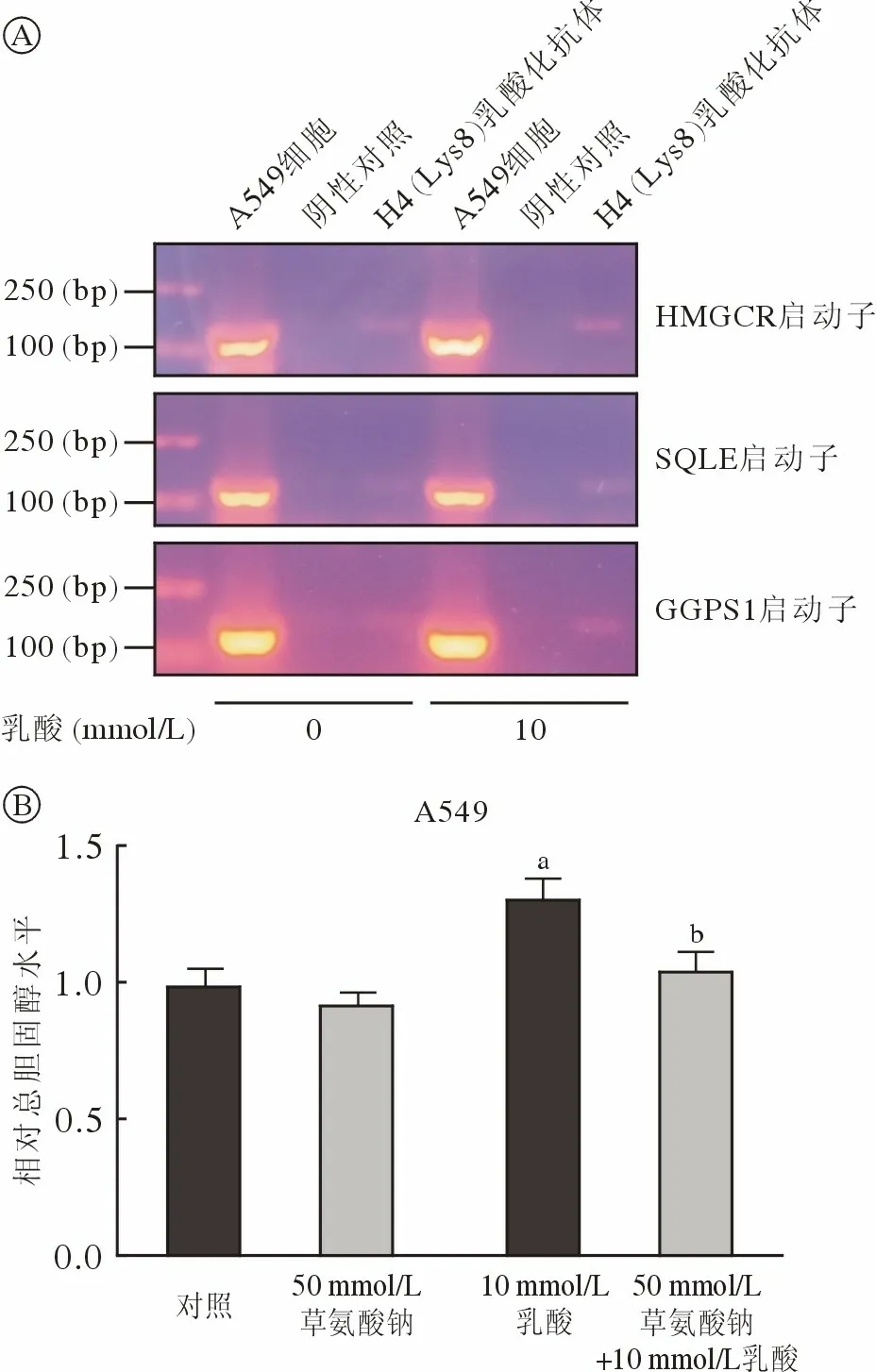
图4 乳酸调节细胞内总胆固醇水平的可能机制A:正常培养的A549 细胞及乳酸处理的A549 细胞中HMGCR、SQLE 和GGPS1 基因启动子区组蛋白乳酸化水平;B:正常培养的A549 细胞及乳酸和草氨酸钠处理的A549 细胞内总胆固醇水平(aP<0.01,vs 对照;bP<0.01,vs 10 mmol/L 乳酸)Fig.4 The possible role of lactate in regulating intracellular total cholesterolHistone lactylation within HMGCR,SQLE and GGPS1 promoters in A549 cells treated with or without lactate (A);Intracellular total cholesterol in A549 cells with the indicated treatment (B) (aP<0.01,vs control;bP<0.01,vs 10 mmol/L lactate)
讨论
在我国,肺癌新增病例和死亡病例均居恶性肿瘤之首,NSCLC 约占所有肺癌病例的80%,而乳酸和胆固醇在NSCLC 中代谢异常并参与疾病进展;本研究发现乳酸能够上调NSCLC 细胞内总胆固醇水平。TCGA 数据分析结果显示,LDHA 高表达的NSCLC中,参与胆固醇合成的代谢酶基因HMGCR、ACAT1、ACAT2、SQLE 和FDFT1 mRNA 水平上调(图1),提示乳酸与胆固醇合成存在关联。与正常培养的BEAS-2B、A549 和H1299细胞系相比,用乳酸处理的BEAS-2B、A549 和H1299 细胞中总胆固醇水平升高(图2A~ 图2C),且BEAS-2B 和A549 细胞中胆固醇合成代谢酶基因HMGCR、FDPS、GGPS1 和SQLE (图2D~图2G) mRNA 水平升高,提示乳酸通过促进胆固醇合成代谢酶基因表达而上调NSCLC 细胞内总胆固醇水平。
有研究报道乳酸通过降低pH 引起SREBP2 活化而上调胆固醇合成代谢酶基因转录和胆固醇水平[16],而本研究结果显示低pH 可引起胆固醇水平升高,用盐酸模拟乳酸引起的低pH 对胆固醇水平的调节作用较乳酸弱(图3),说明乳酸还通过不依赖于改变pH 的途径上调细胞内胆固醇水平。染色质免疫共沉淀结果显示,乳酸处理组A549 细胞中HMGCR、SQLE 和GGPS1 基因启动子区组蛋白乳酸化水平有升高趋势(图4A),但此结果不能确定组蛋白乳酸化修饰是否为乳酸上调胆固醇合成代谢酶基因的直接因素;HDAC1 和HDAC3 具有去乳酸化修饰功能[17],后续研究将用乳酸处理过表达HDAC1 和HDAC3 的A549 细胞,在抑制组蛋白乳酸化修饰的条件下,充分研究组蛋白乳酸化修饰对胆固醇合成代谢酶基因表达的影响。此外,乳酸经乳酸脱氢酶转化为丙酮酸后在线粒体内合成柠檬酸,线粒体柠檬酸被转运到细胞之后裂解生成乙酰辅酶A[14],而细胞质乙酰辅酶A 是胆固醇合成的原料;因此,乳酸也可能通过细胞内代谢转化为乙酰辅酶A 而参与胆固醇合成。本研究中,用草氨酸钠抑制乳酸脱氢酶可以减弱外源乳酸对A549 细胞内总胆固醇水平的上调作用(图4B),说明草氨酸钠可能通过阻断乳酸转化为乙酰辅酶A 的代谢过程而使细胞内总胆固醇水平降低。
综上所述,本研究表明乳酸能够上调NSCLC细胞内总胆固醇水平,并经初步探索发现,乳酸可能通过促进胆固醇合成代谢酶基因表达和转化为胆固醇合成底物乙酰辅酶A 两条途径上调细胞内胆固醇水平,揭示了细胞内胆固醇水平新的调节机制。NSCLC 中胆固醇含量升高[7],且高胆固醇含量能增强A549、H1650、H1299 等NSCLC 细胞系对EGFR 抑制剂的耐药性[9];他汀类等阻断细胞内胆固醇合成药物已被用于NSCLC 等肿瘤的治疗临床试验和治疗[18-19]。本研究揭示的乳酸上调细胞内胆固醇水平的调节过程,有望提供新的抗肿瘤药物靶点,其靶向药物可能提高现有胆固醇合成阻滞剂对NSCLC 的疗效。
作者贡献姜军:课题构思;江源、侯静:TCGA 数据分析;张耀刚、田美媛:染色质免疫共沉淀;孙莉、李志琴:定量PCR;童思贤、郑凯曼:胆固醇测定;黄登亮:汇总数据并撰写初稿。
利益冲突所有作者同意文章发表,并声明不存在利益冲突。
数据共享声明不进行数据共享。

