微血流成像联合超声造影诊断猪肾创伤伴活动性出血的实验研究
朱连华 费 翔 韩 鹏 姜 波 罗渝昆
创伤是中青年常见的主要致死原因之一,全球每年约450万人死于创伤,且发病率逐年提高,严重影响人类生命健康[1]。肾脏是最常见的泌尿生殖系统创伤部位,在腹部实质脏器创伤中仅次于肝、脾[2]。早期发现并准确评估肾创伤分级对于指导临床治疗具有重要意义,尤其是活动性出血的早期诊断与定位,对于提高创伤救治成功率及改善预后起着关键作用。超声具有无辐射、方便、快捷、可重复、实时成像等优点,已成为腹部闭合性损伤的首选影像学检查方法。随着超声造影(contrast-enhanced ultrasound,CEUS)的广泛应用,其在肾创伤的诊断中发挥着重要作用,不仅可提高创伤灶早期诊断的敏感性,而且能准确发现和评估活动性出血,进一步提高了诊断肾创伤分级的准确性[3-4]。CEUS常以造影剂局部异常浓聚或“涌泉”征象诊断活动性出血,但是难以明确活动性出血部位及受损血管破口内径[5-6]。微血流成像(micro-flow imaging,MFI)是新兴的血流多普勒超声成像技术,其能与CEUS 技术联合应用,不会破坏超声造影剂,且能实时显示组织或病灶微细血流的形态、结构,为肾创伤伴活动性出血的定位、诊断,以及血管内径的测量提供了可能。本实验通过建立猪肾创伤伴活动性出血模型,探讨MFI 联合CEUS 诊断和定位肾创伤伴活动性出血的准确性,以期指导临床实现肾创伤伴活动性出血的精准治疗。
材料与方法
一、实验动物
巴马小型猪10 只,体质量30~40 kg,平均(36.56±1.81)kg,雌雄不限,均购自北京金牧阳实验动物养殖有限责任公司[许可证号:SYXK(京)2020-0007];实验前均于SPF级动物房饲养。本实验经我院实验动物伦理委员会批准(2022-X18-111),并遵循动物的基本福利。
二、主要实验仪器与方法
1.建立模型:实验猪麻醉前肌肉注射0.05 mg/kg阿托品和0.1 ml/kg 痛立定,经耳缘静脉建立静脉通道,静脉注射3%戊巴比妥钠1 ml/kg,并实时监测实验猪的生命体征。静脉注射肝素,以抑制实验猪的凝血系统。肾区备皮,侧腹部切口,暴露肾脏结构,通过穿刺针及止血钳在肾包膜下1 cm 内构建猪肾创伤伴活动性出血模型,受损血管主要是弓形动脉及以下分支血管。实验过程中保持实验猪生命体征稳定,无明显休克症状。根据美国创伤外科协会(American Association for the Surgery of Trauma,AAST)肾损伤分级2018 年修订版对肾创伤进行分级[7],具体为:Ⅰ级,肾包膜下血肿和/或肾实质挫伤,无裂伤;Ⅱ级,血肿局限于肾筋膜;肾实质裂伤深度<1 cm,无集合系统破裂或尿外渗出;Ⅲ级,肾实质裂伤深度>1 cm,无尿外渗出;肾筋膜内存在肾血管损伤或活动性出血;Ⅳ级,肾实质撕裂伤延伸至集合系统并伴有尿外渗出,肾盂撕裂伤和/或完全性输尿管破裂,肾段静脉或动脉损伤,活动性出血超过肾筋膜进入腹膜后或腹腔;Ⅴ级,无活动性出血的血管血栓形成引起的节段性或完全性肾梗死,肾主动脉或静脉裂伤或肾门撕脱伤,肾血运受损伴活动性出血,肾脏破碎,失去可识别的肾实质解剖结构。
2.超声检查:使用Philips EPIQ 7 彩色多普勒超声诊断仪,C5-1 凸阵探头,频率1~5 MHz;内置CEUS 和MFI 联合CEUS 成像模式。先行二维超声扫查整个肾脏,观察可疑肾创伤切面,CDFI观察血流信号;随后调节至双幅成像模式,进行CEUS 成像和MFI 联合CEUS成像。超声造影剂使用声诺维(意大利Bracco 公司),使用前用5 ml 生理盐水溶解冻干粉,振荡摇匀后,静脉注射0.03 ml/kg,启动计时器,实时采集并储存动态图像120 s。观察肾创伤灶内有无活动性出血、出血部位;在MFI 联合CEUS 图像上测量活动性出血的受损血管破口内径。CEUS 诊断肾创伤伴活动性出血标准[8]:CEUS图像中存在不规则或“涌泉”状造影剂异常浓聚区。MFI 联合CEUS 诊断肾创伤伴活动性出血标准[9]:MFI联合CEUS 图像中存在异常血流信号区。由两名分别具有8 年和15 年腹部超声造影检查经验的医师独立分析所有动态图像,判断不一致时协商解决。
3.病理检查:图像采集结束后,解剖暴露肾脏,大体观察肾脏结构,明确肾包膜创伤灶及活动性出血部位,作为活动性出血的诊断及定位诊断标准。实验结束后,处死巴马小型猪,完整取出肾脏组织并拍照。
三、统计学处理
应用R 4.2.2 统计软件,计数资料以频数或率表示,采用配对χ2检验。P<0.05为差异有统计学意义。
结 果
一、活动性出血实验猪模型建立
本实验共10 只实验猪构建肾创伤伴活动性出血模型,其中1只由于麻醉原因在实验过程中意外死亡,其余9 只共构建18 处肾创伤伴活动性出血灶,其中AAST Ⅲ级6处,Ⅳ级12处。
二、CEUS 与MFI 联合CEUS 诊断猪肾创伤伴活动性出血情况
18处肾创伤伴活动性出血灶中,二维超声及CDFI均未探及明显的肾创伤灶内活动性出血。CEUS 共探及14 处活动性出血,诊断准确率为77.78%;MFI 联合CEUS 共探及17处活动性出血,诊断准确率为94.44%。CEUS 与MFI 联合CEUS 诊断活动性出血的准确率比较差异无统计学意义(χ2=1.333,P=0.248)。见表1和图1。
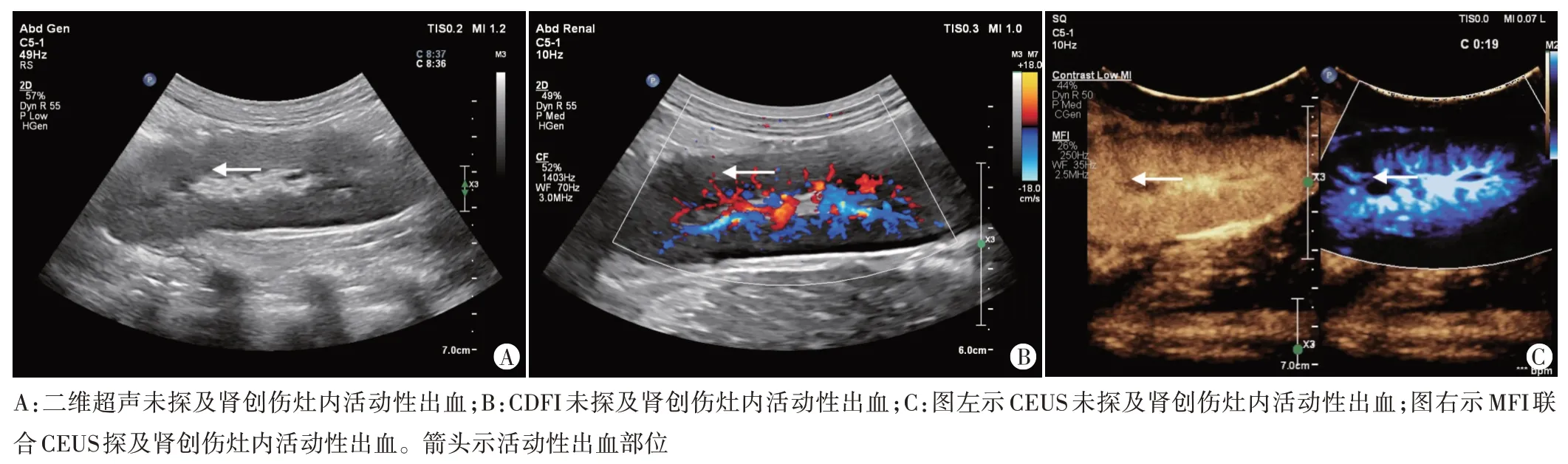
图1 CEUS与MFI联合CEUS诊断猪肾创伤伴活动性出血
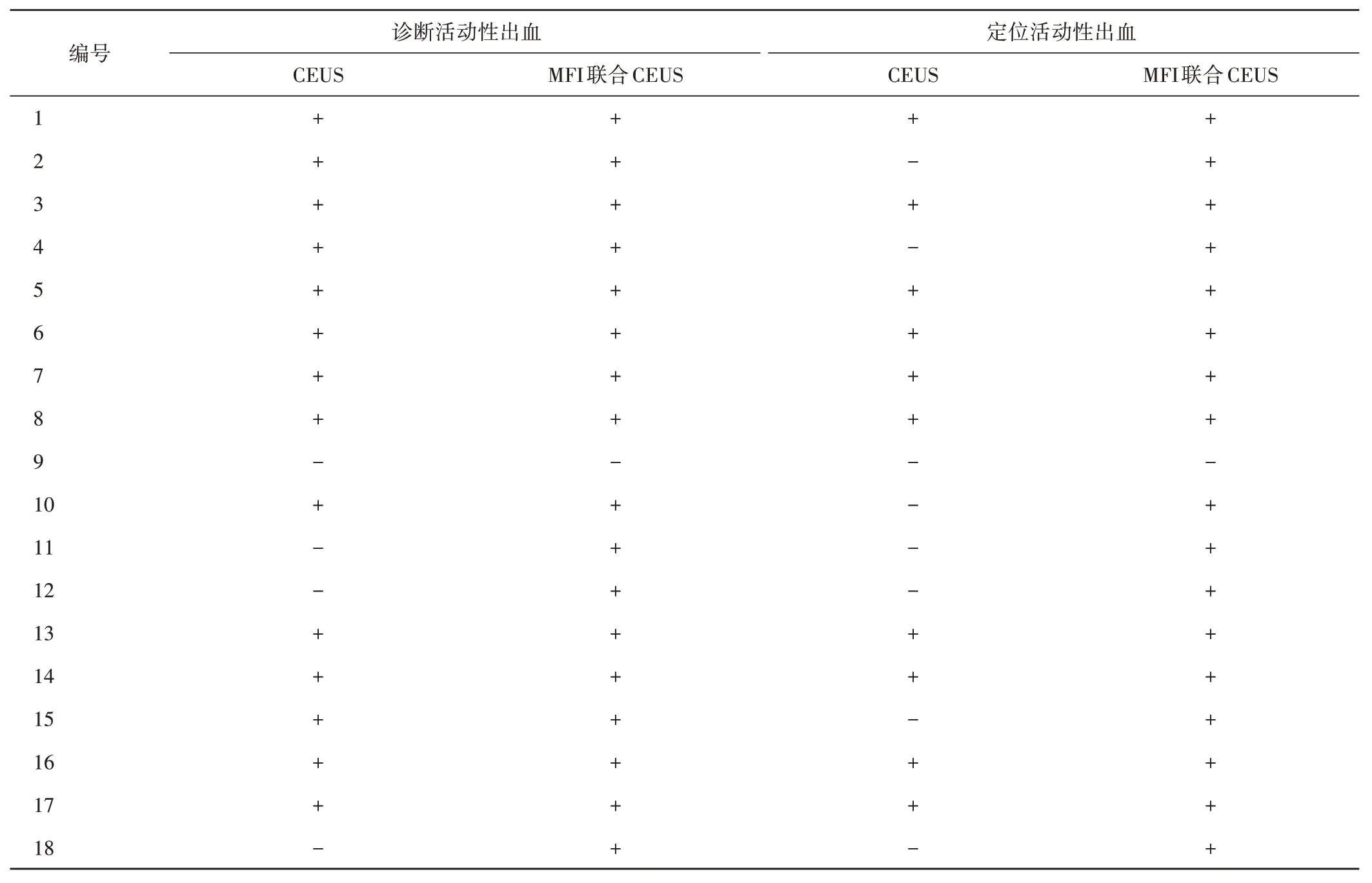
表1 CEUS与MFI联合CEUS诊断及定位猪肾创伤伴活动性出血情况
三、CEUS 与MFI 联合CEUS 定位猪肾创伤伴活动性出血情况
18 处肾创伤伴活动性出血灶中,CEUS 明确10 处活动性出血部位,定位活动性出血的准确率为55.56%;MFI 联合CEUS 明确17 处活动性出血部位,定位活动性出血的准确率为94.44%。CEUS 与MFI 联合CEUS 定位活动性出血的准确率比较差异有统计学意义(χ2=5.143,P=0.023)。见表1 和图2,3。MFI联合CEUS 测得活动性出血受损血管破口内径为1.54~2.42 mm,平均(1.94±0.29)mm。

图2 CEUS与MFI联合CEUS诊断及定位猪肾创伤伴活动性出血
讨 论
肾创伤伴活动性出血若止血不及时,易导致肾功能急速下降,发生急性肾损伤,甚至危及生命。早期发现肾创伤伴活动性出血并明确其部位对于临床治疗方案选择和预后评估至关重要。超声在肾创伤的早期检测中具有不可替代的作用,尤其是CEUS 的广泛应用,不仅提高了创伤灶早期发现的敏感性,而且能检测活动性出血,显著提高了创伤分级的诊断效能[3,10]。随着创伤治疗理念的革新,为尽可能保留患者肾功能,对于血流动力学稳定的患者主要选择非手术微创介入治疗和随访观察[11]。因此,在准确分级诊断创伤的同时,超声检查还需明确活动性出血部位。CEUS 主要依靠造影剂局部异常浓聚或“涌泉”征象判断创伤灶内存在活动性出血,由于缺乏对受损血管的直接观察,因此难以准确鉴别受损血管来源和定位活动性出血,从而增加临床微创介入治疗的难度,甚至导致失败。因此,早期准确判断活动性出血部位有助于实现微创介入精准止血,改善活动性出血的治疗疗效。
MFI 采用新的时空滤波器技术,改善了超声图像的空间分辨率,将组织杂波与低速和微血流的多普勒信号分离,降低噪声,提高微细血管的显示能力,因此能清晰显示直径为100 μm的微细血管和流速为1 cm/s的低速微小血流[12]。此外,MFI 还可以与CEUS 联合应用,进一步增强检测微细血管和低速血流的能力,从而准确评价肾肿瘤的血管形态,有利于肾良恶性肿瘤的鉴别诊断[13]。韩鹏等[9]研究发现在体外人工模拟血管模型中应用MFI 联合CEUS 较CEUS 能更准确地检出活动性出血,且对活动性出血部位的判断也更加准确。本实验通过建立巴马小型猪肾创伤伴活动性出血模型发现,CEUS 与MFI 联合CEUS 诊断活动性出血的准确率分别为77.78%、94.44%。虽然MFI 联合CEUS 的诊断准确率更高,但与CEUS 的诊断准确率比较差异无统计学意义。分析原因为:MFI联合CEUS是在CEUS 成像的基础上增加了血管成像,其仍然是通过观察超声造影剂的分布特征来评价肾脏局部血流动力学的变化,因此对活动性出血诊断的准确率与CEUS 比较无显著改变;此外本实验样本量较小,难以发现CEUS 与MFI 联合CEUS 在诊断活动性出血准确率方面的差异。
明确活动性出血部位是临床微创介入治疗的关键环节。本实验结果显示,CEUS 与MFI 联合CEUS 定位肾创伤伴活动性出血的准确率分别为55.56%、94.44%,二者比较差异有统计学意义(P<0.05)。分析原因为:MFI联合CEUS检查在观察超声造影剂异常浓聚的同时,能准确判断异常浓聚的超声造影剂来源,从而鉴别创伤灶内受损血管,提高活动性出血定位诊断的准确率。在CEUS发现活动性出血的模型中,有4处不能明确活动性出血部位,待联合MFI 后均能明确。此外,本实验还发现应用MFI 联合CEUS 测得受损血管破口内径为1.54~2.42 mm,证实MFI联合CEUS在诊断及定位活动性出血的同时,也能判断受损血管的内径大小,为临床微创介入治疗提供更多有价值的诊断信息。由于二维超声与CDFI 均未能探及组织内微细血管,故在猪肾创伤伴活动性出血模型中二者均未发现明确的活动性出血,与以往研究[3]结论一致。
本研究的局限性:①仅通过大体标本观察活动性出血及部位,未行增强CT 或DSA 检查评价活动性出血;②MFI联合CEUS测量受损血管破口内径存在局限性,测量值与量程、增益等有关;③仅探讨了MFI 联合CEUS 检查破口内径<3 mm 的受损小血管导致的活动性出血,未对肾脏大、中血管受损导致的活动性出血进行研究,存在一定的偏倚。
综上所述,CEUS联合MFI能清晰显示猪肾创伤灶内受损血管,准确诊断活动性出血,且定位活动性出血的能力优于CEUS,可为指导临床微创介入治疗提供理论依据。

