聚乙烯醇/海藻酸钠载药复合水凝胶的制备及其抗菌性能
王悦 徐国平 仇巧华 朱灵奇 刘涛
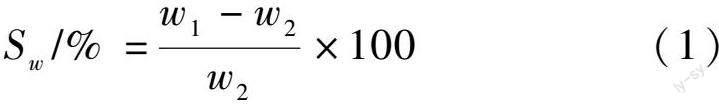
摘 要:以聚乙烯醇(Polyvinyl alcohol,PVA)和海藻酸钠(Sodium alginate,SA)为原料,采用循环冷冻-解冻法制备具有半互穿网络结构(SIPN)的PVA/SA复合水凝胶并搭载盐酸万古霉素(VAN)。通过扫描电子显微镜(SEM)、红外光谱仪(FT-IR)和X射线粉末衍射仪(XRD)等仪器对其形貌和结构进行表征,分析PVA/SA@VAN载药复合水凝胶的溶胀度和力学性能,并探究其抗菌性能。结果表明:PVA/SA@VAN载药复合水凝胶均呈现出三维多孔结构,孔隙率在80%以上,在磷酸盐缓冲液中的溶胀度可达1338%,具有良好的力学性能。抗菌实验表明,PVA/SA@VAN载药复合水凝胶对金黄色葡萄球菌具有显著的抗菌效果。该研究结果可为载药复合水凝胶在创伤敷料中的应用方面提供参考。
关键词:聚乙烯醇;海藻酸钠;复合水凝胶;载药;抗菌
中图分类号:TB332
文献标志码:A
文章编号:1009-265X(2023)03-0145-10
基金项目:国家自然科学基金项目(31900964);浙江理工大学科研启动基金项目(11150131722120)
作者简介:王悦(1999—),女,浙江台州人,硕士研究生,主要从事现代纺织技术和产品开发应用方面的研究。
通信作者:徐国平,E-mail:xuguoping8@126.com
水凝胶是由可溶性或亲水性聚合物的化学或物理交联形成的大分子网络,由于其优异的亲水性、良好的生物相容性、对生理环境的高度敏感性,以及能够为创伤界面提供潮湿的环境等优点使其成为伤口敷料和其他生物医学用途的理想选择[1-2]。水凝胶也被广泛用作药物载体,因为他们具有较高的孔隙率且能够有效调节药物释放速率,使其在促进创面修复及抗感染的基础研究与临床应用上取得喜人成果[3-4]。抗生素临床上通常采用传统的静脉注射以及口服的方式使用,但系统循环使到达感染部位的药物浓度不足以杀灭病菌,因此将抗生素负载在水凝胶中,直接施用在创口部位进行局部释药,针对性抵御病原微生物,可以在避免创口的感染的同时减轻抗生素过度口服的副作用,并且减少耐药性的形成[5]。
海藻酸钠(SA)是一种天然聚电解质,来源广泛,具有高透氧性,生物降解性,生物相容性,良好的止血能力以及pH敏感性,可在温和条件下快速形成水凝胶[6-9]。但其刚性大、易碎的缺点限制了其使用范围[10]。聚乙烯醇(PVA)是一种水溶性极性聚合物,具有优异的生物相容性和生物降解性,固有的无毒性和良好的机械性能[4, 11-12]。它可以通过化学或物理交联形成水凝胶,由于其具有伤口愈合性能[13-14],PVA水凝胶也被广泛用作伤口敷料的基质材料。将PVA与SA复合,PVA的加入弥补了SA凝胶脆性大的缺点,提高了凝胶的机械性能,增加了凝胶的弹性[15-16]。PVA提供了足够的机械性能,并且促成水凝胶的形成,而SA改善了样品的物理和生物学特性。盐酸万古霉素(VAN)是一种亲水性糖肽抗生素,性质稳定,对金黄色葡萄球菌和其他革兰氏阳性菌具有较高活性,已成为治疗感染的首选抗生素[17-20]。
本文制备了以PVA和SA为原料,负载VAN的PVA/SA@VAN载药复合水凝胶,研究其表面微观结构及理化性能,并评估其抗菌性能,为后期将该载药复合水凝胶应用于创伤敷料奠定基础。
1 实 验
1.1 材料和仪器
主要材料:聚乙烯醇(PVA,1799型,醇解度98%~99%,上海麦克林生物化学有限公司),海藻酸钠(SA,AR,90%,上海麦克林生物化学有限公司),盐酸万古霉素(VAN,USP,上海阿拉丁生化科技股份有限公司),无水乙醇(EtOH,分析纯,杭州双林化工试剂有限公司),去离子水(实验室自制)。
主要仪器:磁力搅拌器(S82-1型,上海志威电器有限公司),超声波清洗器(KQ5200E型,昆山市超声仪器有限公司),集热式恒温加热磁力搅拌器(DF-101S型,杭州惠創仪器设备有限公司),电子天平(CFA1004型,宁波市鄞州华丰仪器厂),冷冻干燥机(FD-1A-5O型,上海比朗仪器制造有限公司),场发射扫描电子显微镜(Ultra55型,德国Carl Zeiss公司),X射线衍射仪(D8 discover型,德国布鲁克AXS有限公司),材料测试机(Instron 5943型,美国Instron仪器公司),傅立叶变换红外光谱仪(Nicolet5700型,美国Thermo Electron公司),立式自动电热压力蒸汽灭菌器(LX-B50L型,合肥华泰医疗设备有限公司),净化工作台(SW-CJ-2D型,上海叶拓科技),电热恒温培养箱(DHP-9082型,上海一恒科学仪器有限公司),恒温培养摇床(THZ-100型,上海一恒科学仪器有限公司)。
1.2 PVA/SA@VAN载药复合水凝胶的制备
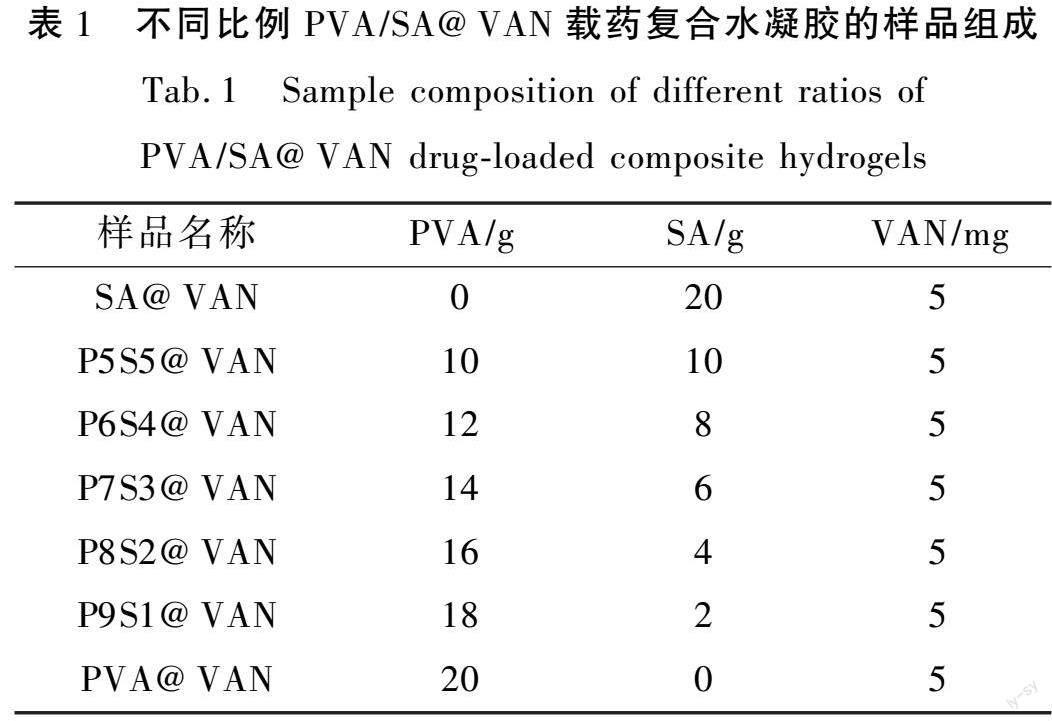
称取10 g的PVA颗粒放入加含有190 mL去离子水的烧杯中,于95℃水浴搅拌至完全溶解,得到质量分数5%的PVA水溶液。称取1 g的SA粉末放入加含有99 mL去离子水的烧杯中,常温下搅拌至完全溶解,得到质量分数1%的SA水溶液。按一定质量配比将SA溶液加入PVA溶液中,搅拌至均匀,静止去泡后获得PVA/SA水凝胶溶液。将5 mg/mL的VAN溶液加入到PVA/SA溶液中,搅拌至完全混合,通过超声处理使药物分散均匀,得到PVA/SA@VAN载药复合水凝胶溶液。倒入模具后在-18℃冷冻18 h,室温解冻6 h,如此反复3次,在常压下注入液氮使其冷冻,最后将复合水凝胶在-51℃下冷冻干燥处理48 h,即可获得PVA/SA@VAN载药复合水凝胶。样品组成如表1所示。
1.3 测试与表征
1.3.1 表面形貌及结构分析
将PVA/SA@VAN载药复合水凝胶进行冷冻干燥后,在液氮中脆断,然后在氮气气氛下使用溅射镀膜机镀上金-钯层。使用3 kV的加速电压通过场发射扫描电子显微镜(FE-SEM)观察PVA/SA@VAN载药复合水凝胶的表面形貌。
1.3.2 化学结构分析
傅立叶红外光谱仪(FTIR)选用ATR模式获得。在4000~500 cm-1的波数区域内对PVA/SA@VAN载药复合水凝胶进行扫描来表征其红外透过率。
1.3.3 结晶分析
通过X射线衍射仪(XRD)对样品进行结晶性能检测。放射源:Cu靶Kα射线;扫描区间:5°~80°;扫描步长:0.02°。
1.3.4 溶胀性能测试
将不同比例干燥的PVA/SA@VAN载药复合水凝胶浸入pH=7.4的PBS缓冲液中并在室温下进行溶胀测试,在每个时间间隔,从溶液中取出溶胀凝胶并从凝胶表面除去多余液体后称重,称重记为w1。将样品置于80℃真空干燥中至少48 h后称重,记为w2。样品的溶胀率(Sw)通过式(1)计算得到:
1.3.5 孔隙率测试
用无水乙醇作为介质,采用比重瓶法测定不同比例PVA/SA@VAN载药复合水凝胶的孔隙率,每个样品重复3次。孔隙率P通过式(2)计算得到:
式中:P为孔隙率,%;m1为乙醇和比重瓶的总质量,g;m2为加入样品后反复抽取真空后乙醇和比重瓶的总质量,g;m3为反复抽取真空后取出样品后剩余乙醇和比重瓶的总质量,g;ms为水凝胶的干重,g。
1.3.6 力学性能测试
使用材料测试机通过压缩评估不同比例PVA/SA@VAN载药复合水凝胶的力学性能。将样品制成直径10 mm、高度10 mm的圆柱形,用于压缩试验。每个样品在10 mm/min的压缩试验速度,60%的压缩模量下测定。
1.3.7 抗菌性能测试
细菌培养基营养琼脂配制:将6.4 g营养琼脂溶于200 mL去离子水中,120℃高压灭菌30 min,待高压灭菌锅温度降至65℃取出,倒入培养皿中,冷却形成固体培养基。营养肉汤的配置:将0.36 g营养肉汤溶于20 mL去离子水中,高压灭菌后,冷却至室温下备用。细菌培养:将大肠杆菌和金黄色葡萄球菌置于液体培养基中,在37℃恒温摇床中过夜培养活化。抑菌圈实验:将200 μL菌悬液(1×105 CFU/mL)均匀涂抹于固体培养基上,静置吸收10 min。将载药水凝胶样品放在琼脂板中心并轻轻按压,然后在37℃下倒置培养18 h后观察抑菌圈大小。使用尺子测量每个样品的抑菌圈,并拍摄不同培养皿的照片。水凝胶样品的抗菌性能采用抑菌环直径来评定,计算公式如式(3)所示:
式中:D′为抑菌环直径,mm;D为抑菌圈外径,mm;d为被测样品直径,mm。
2 结果与讨论
2.1 微观结构分析
图1为PVA@VAN、SA@VAN及PVA/SA@VAN载药复合水凝胶的FE-SEM照片。可以发现,纯PVA@VAN载药水凝胶经过多次重复的冷冻-解冻循环,形成三维多孔结构(图1 (a))。如图1 (b)所示,纯SA@VAN载药水凝胶的孔隙率高,但结构松散。不同比例的PVA/SA@VAN载药复合水凝胶中PVA和SA之间没有明显的相分离,表明两种组分之间具有良好的相容性。该载药水凝胶均表现出高度多孔的三维网络结构,孔隙分布均匀且相互连接,形成独特的半互穿网络结构[21](图1 (c)―(g))。孔隙的大小和形态随PVA/SA的混合比而变化,随着SA含量的增加,PVA含量减少,该复合水凝胶结构由紧密逐渐变得松散。一方面可能是因为水凝胶以半互穿网络结构的形式存在,这种结构会使两种材料都保持各自的化学结构;SA组分本身没有交联,只是在PVA网络中物理互锁,SA自身以线性聚合物链扩散到PVA聚合物网络中形成半互穿聚合物网络[22-23]。另一方面,SA可能导致PVA分子链之间通过冷冻和解冻形成的结晶交联点的破坏,阻碍PVA分子物理交联的有效范围[13]。
2.2 化学組成分析
图2为PVA/SA@VAN载药复合水凝胶及其原材料的FTIR光谱图。从图2 (a)中可以看出,PVA在1087 cm-1处的特征峰归因于C—O拉伸振动,在1414 cm-1处的特征峰为—CH2的弯曲振动峰,2909 cm-1和2940 cm-1处的特征峰分别为—CH2的对称和不对称伸缩振动峰,3268 cm-1处的特征峰为—OH的伸缩振动峰。在SA红外光谱中,1023 cm-1处为C—O—C的伸缩振动峰,1406 cm-1和1595 cm-1处分别为—COO—的对称和不对称伸缩振动峰,2923 cm-1处为C—H的伸缩振动峰,3285 cm-1处为—OH的伸缩振动峰。在VAN红外光谱中,3422 cm-1为N—H和O—H的伸缩振动峰,2967 cm-1处为C—H的伸缩振动峰,1652 cm-1处的特征峰归因于酰胺基的CO振动,1234 cm-1的特征峰归因
于芳香酯的C—O振动,1062 cm-1和1025 cm-1处为胺基的C—N键的伸缩振动峰[24-27]。但由于VAN的特征峰与SA的特征峰所处范围有重合,导致VAN的特征峰在复合载药水凝胶中不清晰可见,如图2 (b)所示。所有的PVA/SA@VAN载药复合水凝胶样品在3235 cm-1和3339 cm-1之间显示出宽带,这可能是由于PVA/SA中—OH的伸缩振动和VAN中N—H的伸缩振动的重叠。随着PVA/SA@VAN载药复合水凝胶中SA组分的增加,1564 cm-1和1638 cm-1之间的峰强度增加,因为游离的—COO-数量增加。与纯PVA、SA和VAN相比,在PVA/SA@VAN载药复合水凝胶的光谱中没有观察到新的峰,从而表明没有产生化学键。这些结果表明,PVA/SA@VAN载药复合水凝胶的SIPN仅涉及PVA、SA和VAN之间的物理交联[28]。
2.3 XRD分析
PVA、SA、PVA/SA复合水凝胶及其载药复合水凝胶的XRD如图3所示。从图3可以观察到在PVA和PVA/SA复合水凝胶的2θ=19.8°处的高强度峰和2θ=41.2°处的低强度峰显示一个尖锐的衍射峰表明PVA是一种半结晶材料[29-30]。PVA溶液在冻融过程中,PVA会形成分子间氢键和分子内氢键,从而形成了结晶区。SA在2θ=23.3°处显示1个衍射峰,这是由于藻酸盐链之间通过分子间氢键的强相互作用,这对应于SA的无定形区域[31-32]。PVA/SA复合水凝胶的衍射峰比PVA水凝胶的强度低且峰宽,这是因为复合水凝胶的结晶度主要来自于PVA,并且SA的加入破坏了PVA的原始内部官能团之间的作用力,SA和PVA之间形成了新的氢键作用,降低了复合水凝胶的结晶度。与未载药水凝胶相比,载药水凝胶的结晶度明显降低,这可能归因于PVA中的—OH与VAN中的—NH2形成的弱氢键合。
2.4 溶胀性能分析
不同比例的PVA/SA@VAN载药复合水凝胶的溶胀率如图4所示。由图4可以观察到,水凝胶在初始溶胀阶段,水凝胶的溶胀率迅速增加,水分子进入水凝胶并与水凝胶内部的大分子相互作用,溶胀率缓慢增加并最终在40 min左右达到稳定状态。PVA@VAN溶胀率大约为346%,P5S5@VAN、P6S4@VAN、P7S3@VAN、P8S2@VAN和P9S1@VAN的最大溶胀率分别约为1338%、1059%、599%、478%和400%,表明载药复合水凝胶的溶胀率随着PVA浓度的增加而明显降低,分别为PVA水凝胶的3.9、3.1、1.7、1.4、1.2倍。这是由于聚合物上亲水基团的亲水能力是影响水凝胶溶胀性能的关键因素,而SA比PVA更具亲水性,并且内部的—COO-不仅与水分子发生水合作用,而且使聚合物链在水中伸展,另外—COO-之间存在静电排斥效应,使水凝胶可以吸收大量水分并膨胀直至平衡,因而水分子进入水凝胶的扩散速率和水量均增加,进一步提高了复合水凝胶的溶胀率。结合XRD数据可知,SA含量的增加使载药复合水凝胶的结晶度降低,有助于改善半互穿网络水凝胶在介质中的溶胀[30-33]。
2.5 孔隙率分析
孔隙率是水凝胶的一个重要参数,孔隙率高代表材料具有较大的比表面积及较高的吸附能力,有助于吸收创伤的渗出液[8]。PVA/SA@VAN载药复合水凝胶的孔隙率如图5所示。PVA@VAN的孔隙率为80.53%,SA@VAN的孔隙率相对较高,为92.58%。载药复合水凝胶的孔隙率随着SA含量的增加,从80.37% (P9S1@VAN)增加到87.81% (P5S5@VAN),这是由于SA本身的性质增加了载药复合水凝胶的孔隙率。综上,该水凝胶的高孔隙率使其具有良好的吸附能力,有利于后期药物的释放及吸收伤口渗出液,使其在伤口敷料应用方面有良好的前景。
2.6 力学性能
理想的伤口敷料应具有良好的机械性能,以保持其结构的完整性[13,34]。为了检验PVA/SA@VAN载药复合水凝胶的力学特性,进行了压缩实验。图6(a)为不同比例PVA/SA@VAN载药复合水凝胶的应力-应变曲线,拟合结果表明,所有复合水凝胶的应力-应变行为均呈指数关系,相关系数r2均大于0.99。复合水凝胶中的三维网络结构包含了PVA的非晶区和微晶区以及大量的自由水,使柔性的PVA分子链能够通过重新排列自身来快速响应外力,最终导致水凝胶的压缩应变比相对较高[35]。图6 (b)为不同比例PVA/SA@VAN载药复合水凝胶在60%应变下的压缩模量,可以看出随着SA含量的增加,PVA/SA@VAN载药复合水凝胶的压缩模量明显降低。不含SA的PVA@VAN载药水凝胶可达到高压缩模量(167.06±16.66) kPa,P5S5@VAN载药复合水凝胶的压缩模量下降到(33.70±21.26) kPa,这可能是由于SA的加入使PVA的交联强度降低所致。因此,为了保证PVA/SA@VAN载药复合水凝胶能够满足后期应用的力学需求,SA的含量应控制在合适的范围内。
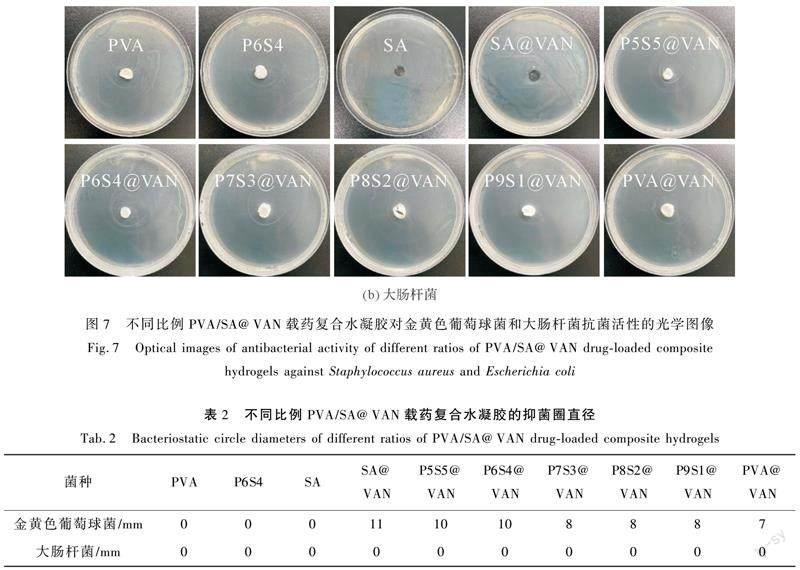
2.7 抗菌性能分析
以未载药水凝胶作为对照样,通过抑菌圈法观察PVA/SA@VAN载药复合水凝胶对革兰氏阳性金黄色葡萄球菌和革兰氏阴性大肠杆菌的抗菌活性,结果如图7所示。对于没有负载VAN的PVA/SA水凝胶,在测试的两个菌株周围均无抑菌圈,这表明
PVA/SA水凝胶对这两种细菌没有抗菌活性。对于PVA/SA@VAN载药复合水凝胶,在对金黄色葡萄球菌的抗菌测试中样品周围均出现明显的抑菌圈,而在大肠杆菌中则无明显抑菌圈存在,说明VAN对金黄色葡萄球菌表现出良好的抗菌活性,抑菌圈直径如表2所示。不同比例的PVA/SA@VAN载药复合水凝胶抑菌圈存在差异,可能是由于通过原位加载将药物掺入水凝胶基质中的这种方法会使药物的释放取决于扩散、溶胀、药物-聚合物相互作用以及暴露于不同环境时水凝胶结构的结构变化[36],从而使得VAN扩散效果不同。PVA/SA@VAN载药复合水凝胶表現出良好的抗菌活性,使其在抗菌伤口敷料材料应用中具有巨大潜力。
3 结 论
本文通过循环冻融法制备了PVA/SA@VAN载药复合水凝胶,分析了PVA/SA@VAN载药复合水凝胶的理化性能和抗菌性能,主要结论如下:
a) 成功合成了PVA/SA@VAN载药复合水凝胶,PVA/SA@VAN载药复合水凝胶均表现出三维网络结构,XRD峰的变化和FT-IR结果证实了VAN的存在。
b) PVA/SA@VAN载药复合水凝胶具有良好的溶胀性能、孔隙率和力学性能,随着复合水凝胶中SA含量的增加,该水凝胶溶胀度可达1338%,孔隙率在80%以上。
c) PVA/SA@VAN载药复合水凝胶对金黄色葡萄球菌表现出良好的抗菌效果,且随着SA含量的增加,抑菌圈增大。
綜上,本文制备的PVA/SA@VAN载药复合水凝胶表现出的优异性能显示出在伤口敷料和其他生物医学领域中有良好的应用前景。
参考文献:
[1]KAMOUN E A, KENAWY E R S, CHEN X. A review on polymeric hydrogel membranes for wound dressing applications: PVA-based hydrogel dressings[J]. Journal of Advanced Research, 2017, 8(3): 217-233.
[2]周润华,柴益民.载药水凝胶敷料在创面中的应用[J].国际骨科学杂志,2018,39(2):89-92.
ZHOU Runhua, CHAI Yimin. Application of drug-loaded hydrogel dressing in wound[J]. International Journal of Orthopedics, 2018, 39(2): 89-92.
[3]SUN M, CHENG L D, XU Z X, et al. Preparation and characterization of vancomycin hydrochloride-loaded meso-porous silica composite hydrogels[J]. Frontiers in Bioen-gineering and Biotechnology, 2022, 10: 826971.
[4]ZHANG D, ZHOU W, WEI B, et al. Carboxyl-modified poly(vinyl alcohol)-crosslinked chitosan hydrogel films for potential wound dressing[J]. Carbohydrate Polymers, 2015, 125: 189-199.
[5]RICHARDSON W L, HAMMERT W C. Adverse effects of common oral antibiotics[J]. The Journal of Hand Surgery, 2014, 39(5): 989-991.
[6]KAUR P, GONDIL V S, CHHIBBER S. A novel wound dressing consisting of PVA-SA hybrid hydrogel membrane for topical delivery of bacteriophages and antibiotics[J]. International Journal of Pharmaceutics, 2019, 572: 118779.
[7]MONTASER A S, REHAN M, EL-NAGGAR M E. pH-Thermosensitive hydrogel based on polyvinyl alcohol/sodium alginate/N-isopropyl acrylamide composite for treating re-infected wounds[J]. International Journal of Biological Macromolecules, 2019, 124: 1016-1024.
[8]PAN H, FAN D, DUAN Z, et al. Non-stick hemostasis hydrogels as dressings with bacterial barrier activity for cutaneous wound healing[J]. Materials Science and Engineering: C, 2019, 105: 110118.
[9]刘玉,徐国平,祝佳琼.PLA/PVA/SA复合纱线的制备与表征[J].浙江理工大学学报(自然科学版),2019,41(6):723-729.
LIU Yu, XU Guoping, ZHU Jiaqiong. Preparation and characterization of PLA/PVA/SA composite yarns[J]. Journal of Zhejiang Sci-Tech University (Natural Sciences Edition), 2019, 41(6): 723-729.
[10]DI DONATO P, TAURISANO V, POLI A, et al. Vegetable wastes derived polysaccharides as natural eco-friendly plasticizers of sodium alginate[J]. Carbohydrate Polymers, 2020, 229: 115427.
[11]QIAO K, ZHENG Y, GUO S, et al. Hydrophilic nanofiber of bacterial cellulose guided the changes in the micro-structure and mechanical properties of nf-BC/PVA composites hydrogels[J]. Composites Science and Technology, 2015, 118: 47-54.
[12]WANG T W, ZHANG F, ZHAO R, et al. Polyvinyl alcohol/sodium alginate hydrogels incorporated with silver nanoclusters via green tea extract for antibacterial appli-cations[J]. Designed Monomers and Polymers, 2020, 23(1): 118-133.
[13]XU M J, QIN M, ZHANG X M, et al. Porous PVA/SA/HA hydrogels fabricated by dual-crosslinking method for bone tissue engineering[J]. Journal of Biomaterials Science, Polymer Edition, 2020, 31(6): 816-831.
[14]KIM J O, PARK J K, KIM J H, et al. Development of polyvinyl alcohol-sodium alginate gel-matrix-based wound dressing system containing nitrofurazone[J]. International Journal of Pharmaceutics, 2008, 359(1/2): 79-86.
[15]鄭丹.用于细胞培养的聚乙烯醇/海藻酸钙水凝胶力学性能的模拟及定量控制[D].重庆:重庆大学,2014.
ZHENG Dan. Mathematical Simulation and Quantitative Control of Polyvinyl Alcohol/Calcium Alginate Hydrogels for Cells Culture in Vitro[D]. Chongqing: Chongqing University, 2014.
[16]吴建荣.PVA/SA复合水凝胶的制备及药物缓释规律的研究[D].成都:四川大学,2006.
WU Jianrong. Preparation of the PVA/SA Blend Hydrogel Bead and Research of Its Drug Sustained Release[D]. Chengdu: Sichuan University, 2006.
[17]JOOSTEN U, JOIST A, GOSHEGER G, et al. Effective-ness of hydroxyapatite-vancomycin bone cement in the treatment of Staphylococcus aureus induced chronic oste-omyelitis[J]. Biomaterials, 2005, 26(25): 5251-5258.
[18]PACE J L, YANG G. Glycopeptides: Update on an old successful antibiotic class[J]. Biochemical Pharmacology, 2006, 71(7): 968-980.
[19]SINGH V, KUMAR V, KASHYAP S, et al. Graphene oxide synergistically enhances antibiotic efficacy in vancomycin-resistant Staphylococcus aureus[J]. ACS Applied Bio Materials, 2019, 2(3): 1148-1157.
[20]CENSI R, CASADIDIO C, DUBBINI A, et al. Thermo-sensitive hybrid hydrogels for the controlled release of bioactive vancomycin in the treatment of orthopaedic implant infections[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2019, 142: 322-333.
[21]TANG Q S, HU J W, LI S, et al. Colorimetric hydrogel indicators based on polyvinyl alcohol/sodium alginate for visual food spoilage monitoring[J]. International Journal of Food Science & Technology, 2022,57(10):6867-6880.
[22]KIM Y J, MIN J. Property modulation of the alginate-based hydrogel via semi-interpenetrating polymer network (semi-IPN) with poly(vinyl alcohol) [J]. International Journal of Biological Macromolecules, 2021, 193: 1068-1077.
[23]SAMPATH U G T M, CHING Y C, CHUAH C H, et al. Preparation and characterization of nanocellulose reinforced semi-interpenetrating polymer network of chitosan hydrogel[J]. Cellulose, 2017, 24(5): 2215-2228.
[24]THENNAKOON MUDIYANSELAGE SAMPATH U G, CHING Y C, CHUAH C H, et al. Drug transport mechanisms and in vitro release kinetics of vancomycin encapsulated chitosan-alginate polyelectrolyte microparticles as a controlled drug delivery system[J]. European Journal of Pharmaceutical Sciences, 2018, 114: 199-209.
[25]BABAEI M, GHAEE A, NOURMOHAMMADI J. Poly (sodium 4-styrene sulfonate)-modified hydroxyapatite nanoparticles in zein-based scaffold as a drug carrier for vancomycin[J]. Materials Science and Engineering: C, 2019, 100: 874-885.
[26]KAUR A, PREET S, KUMAR V, et al. Synergetic effect of vancomycin loaded silver nanoparticles for enhanced antibacterial activity[J]. Colloids and Surfaces B: Biointerfaces, 2019, 176: 62-69.
[27]ZARGHAMI V, GHORBANI M, BAGHERI K P, et al. In vitro bactericidal and drug release properties of vancomycin-amino surface functionalized bioactive glass nanoparticles[J]. Materials Chemistry and Physics, 2020, 241: 122423.
[28]YU Z C, LIU J, HE H, et al. Flame-retardant PNIPAAm/sodium alginate/polyvinyl alcohol hydrogels used for fire-fighting application: Preparation and characteristic evalua-tions[J]. Carbohydrate Polymers, 2021, 255: 117485.
[29]CHEN K, ZONG T, CHEN Q, et al. Preparation and characterization of polyvinyl alcohol/sodium alginate/carboxymethyl cellulose composite hydrogels with oriented structure[J]. Soft Materials, 2022, 20(1): 99-108.
[30]KHALID I, AHMAD M, MINHAS M U, et al. Preparation and characterization of alginate-PVA-based semi-IPN: Controlled release pH-responsive composites[J]. Polymer Bulletin, 2018, 75(3): 1075-1099.
[31]XIAO Q, LU K, TONG Q Y, et al. Barrier properties and microstructure of pullulan-alginate-based films[J]. Journal of Food Process Engineering, 2015, 38(2): 155-161.
[32]NIKOLOVA D, SIMEONOV M, TZACHEV C, et al. Polyelectrolyte complexes of chitosan and sodium alginate as a drug delivery system for diclofenac sodium[J]. Polymer International, 2022, 71(6): 668-678.
[33]CHEN K, CHEN G, WEI S, et al. Preparation and property of high strength and low friction PVA-HA/PAA composite hydrogel using annealing treatment[J]. Materials Science and Engineering: C, 2018, 91: 579-588.
[34]KONG F H, FAN C, YANG Y, et al. 5-hydroxymethy-lfurfural-embedded poly (vinyl alcohol)/sodium alginate hybrid hydrogels accelerate wound healing[J]. Interna-tional Journal of Biological Macromolecules, 2019, 138: 933-949.
[35]LI W X, WANG D, YANG W, et al. Compressive mechanical properties and microstructure of PVA-HA hydrogels for cartilage repair[J]. RSC Advances, 2016, 6(24): 20166-20172.
[36]KHAN Y A, OZALTIN K, BERNAL-BALLEN A, et al. Chitosan-alginate hydrogels for simultaneous and sustained releases of ciprofloxacin, amoxicillin and vancomycin for combination therapy[J]. Journal of Drug Delivery Science and Technology, 2021, 61: 102126.
Abstract: In recent years, people have paid increasing attention to wound healing, and medical dressings have developed rapidly. Wound dressings can act as a skin protective barrier to prevent wound infection, quickly absorb wound exudate, and guide human tissue regeneration. The ideal dressing material should not only absorb the excess exudation of the wound, but also keep the wound in a proper moist state, effectively avoid the dry necrosis of the wound tissue and prevent secondary infection. Hydrogels, which are a hydrophilic cross-linked polymer network, can maintain a large amount of water by expansion, and perfectly mimic the natural structure of the tissue microenvironment. Due to its porous structure, biodegradability, growth factor incorporation ability and controlled release ability, it is a promising dressing material. In particular, hydrogels can be loaded with antimicrobial materials such as antibiotics, nanoparticles, and natural products to avoid contact with external bacteria and to effectively prevent cross-infection and improve the healing process.
From the perspective of biosafety and anti-infection, we use polyvinyl alcohol (PVA) and sodium alginate (SA) as raw materials to prepare a PVA/SA composite hydrogel with semi-interpenetrating network structure (SIPN) by a green and simple method, namely cyclic freezing-thawing method, to improve the biological characteristics of PVA and the brittleness of SA, and use it as a carrier to better carry Vancomycin hydrochloride (VAN), aiming to achieve a new composite material with excellent biocompatibility, good mechanical properties and antibacterial effect. The morphology and structure were characterized by scanning electron microscope (SEM), infrared spectrometer (FT-IR) and X-ray powder diffractometer (XRD). The swelling degrees, porosities and mechanical properties of PVA/SA@VAN drug-loaded composite hydrogels were analyzed, and their antibacterial properties were explored. The results showed that the PVA/SA@VAN drug-loaded composite hydrogels all showed a three-dimensional porous structure, with uniform pore distribution and a porosity of more than 80%. They swelled rapidly in phosphate buffer solution without dissolution, and the swelling degree could reach 1338%. They had strong water absorption and swelling ability and good mechanical properties. Antibacterial experiments showed that the PVA/SA@VAN drug-loaded composite hydrogel had significant antibacterial effect on Staphylococcus aureus. The results of this study provide a basis for the application of drug-loaded composite hydrogels in wound dressings.
At present, the demand for antibacterial wound dressings that control infection and prevent microbial invasion by releasing fungicides is gradually increasing. The antibacterial composite hydrogel wound dressing prepared in this paper can be used as a short-term dressing candidate for acute wounds. The research results can provide reference for the research of hydrogel wound dressings.
Keywords: polyvinyl alcohol; sodium alginate; composite hydrogel; drug loaded; antibacterial

