菠萝PARMS反应体系的建立
高云飞 林文秋 吴青松 张秀梅 孙伟生 刘胜辉 姚艳丽


关键词:菠萝;SNP;PARMS;反应体系
中图分类号:S668.3 文献标识码:A
DNA 分子标记是根据基因组中DNA 片段差异来判断个体间遗传信息的差异。与传统表型性状选择相比,DNA 分子标记技术在基因或DNA水平上进行选择,可减少传统育种中的盲目性、选择效率低且易受环境条件影响等问题[1]。早期的分子标记技术主要包括AFLP (amplifiedfragment length polymorphism)、RFLP(restrictionfragment length polymorphism)、RAPD(randomamplified polymorphic)、SSR(simple SequenceRepeats)、SNP(single nucleotide polymorphisms)等。但由于AFLP、RAPD、SSR 等标记存在步骤繁琐、分型不稳定甚至是分型过多无法分辨以及非共显性等问题,使这些标记技术难以应用于育种工作中[2]。
随着高通量测序技术的快速发展,单核苷酸多态性(single nucleotide polymorphisms, SNP)标记被广泛应用于植物中。SNP 广泛分布于植物基因组中,是最丰富的DNA 变异形式[3-6]。基于SNP 开发的标记是第3 代的分子标记,被认为是极具应用前景的分子标记[7]。其主要技术有基因芯片技术(gene chips)[8]、直接测序法(directsequencing)[9]、CAPS(cleaved amplified polymorphicsequence)[10]、KASP(kompetitive al-lelespecific PCR)[11]和PARMS(penta-primer amplificationre-fractory mutation system)[12]等。其中,基于等位基因特异扩增的KASP 和PARMS 分型技术是目前主流的分型方法,具有成本低、耗时短、准确性高和通量高等优点。PARMS 分型的特点是在ARMS-PCR 的基础上,增加了2 条带有不同荧光的引物,经过与相同的反向引物的PCR扩增后,通过检测待测位点的荧光信号进行分型(图1)[13]。在作物遗传图谱构建、基因定位、种质资源分析、分子标记辅助育种等方面广泛应用[12, 14],但在果树上应用较少,仅在桃、葡萄等果树上得到应用[15-16]。
目前,菠萝上主要利用SSR[17]、RAPD[18]、AFLP[19]、SRAP[20]和CAPS[21]等分子标记进行遗传图谱构建及种质资源遗传多样性的分析。但PARMS-SNP 分型技术在菠萝上的研究尚未见报道。本研究以3 份表型差异较大的菠萝种质为材料,分析反应体积、引物浓度和DNA 模板用量等因素对PARMS PCR 反应的影响,以期建立适用于菠萝的PARMS-SNP 分型体系, 为利用PARMS-SNP 分型技术开展菠萝种质资源鉴定、遗传图谱的构建、基因的精细定位和分子标记辅助育种奠定基础。
1 材料与方法
1.1 材料
本研究所用材料为农业农村部菠萝种质资源圃(湛江)保存的种质,选择表型差异较大的3份种质‘ Baro Rothchild ‘ James Queen 和‘Maroochy进行PARMS 反应体系的优化,65份种质用于体系验证。
1.2 方法
1.2.1 引物设计根据 130 份菠萝种质资源重测序数据及其SNP 位点信息,利用Primer Premier 5软件设计引物,命名为SNP31,委托生工生物工程(上海)股份有限公司合成。其上游引物序列(SNP31X、SNP31Y)分别为5'-GAAGGTGACCAAGTTCATGCTCGACGCGTTCAAAATTTAAAGCCT-3' 和5'-GAAGGTCGGAGTCAACGGATTCGACGCGTTCAAAATTTAAAGCCC-3',下游通用引物序列(SNP31C)为5'-TCGTTTAATTTGAATCAGTCAACAACA-3',其中下划线和双下划线分别为FAM 和HEX 荧光标签序列。
1.2.2 基因组DNA的提取 采用改良的CTAB法[22]和快速提取法[23]提取65 份种质的叶片总DNA,利用1%的琼脂糖凝胶电泳检测DNA 的质量,NanoDropOne(Thermo Scientific 公司)检测DNA 的浓度。
1.2.3 PARMS 的基本反应体系反应体系为10 μL:1μL DNA 模板(100 ng/μL),5 μL PARMSmix(2×),0.45 μL 混合引物,3.55 μL ddH2O。引物混合物在配制PCR 反应前预先混匀制备。
PARMS-PCR 扩增体系为94℃ 15 min;94℃20 s,65℃ 1 min(?0.7℃/循环),10 个循环;94℃20 s,57℃ 1 min,35 个循环;35℃ 1 min。利用Applied BiosystemsTM QuantStudioTM 6 读取扩增产物的终点信号,使用其自带的软件进行SNP 分型分析。其中,连接FAM 荧光标签序列的等位基因型聚合在X 軸附近,连接HEX 荧光标签序列的等位基因型聚合在Y 轴附近,2 种等位基因的杂合型在中间显示。其分型结果通过基因型荧光信号点来判断,荧光信号值越高,PARMS-SNP 分型结果越好。
1.2.4 PARMS 反应体系的优化 设置4、6、8、10 μL 等4 种反应体积,其中PARMS master mix(2×)分别为2、3、4、5 μL,100 ng/μL DNA 模板为1 μL,100 μmol/L 引物混合物均为0.15 μL,ddH2O 分别为0.55、1.55、2.55、3.55 μL(表1),对反应体积进行优化。在此基础上进行引物浓度的优化,具体为:将SNP31 的3 条引物分别稀释成25、50、100 μmol/L 等3 种浓度后,进行PARMS反应。在PARMS 反应体积和引物浓度优化的基础上, 将‘ Baro Rothchild ‘ James Queen ‘Maroochy的DNA 分别稀释成100、50、25 ng/μL 的浓度,进行DNA 的浓度优化。
1.2.5 PARMS 反应体系的验证 利用65 份菠萝种质进行PARMS 反应体系的验证。
2 结果与分析
2.1 引物SNP31 的PARMS-SNP 分型结果
本研究在前期重测序的基础上,根据SNP 位点信息设计特异引物SNP31,该引物能够将8 份菠萝种质区分开来(图2)。其中,2 份种质的基因型为C:C,信号点为红色;4 份种质的基因型为T:T,信号点为蓝色;2 份种质的基因型为T:C 或C:T,信号点为绿色。表明SNP31 引物对8 份种质的分型效果较好,且阴性对照(NTC)位于原点附近,可用于后续的实验。
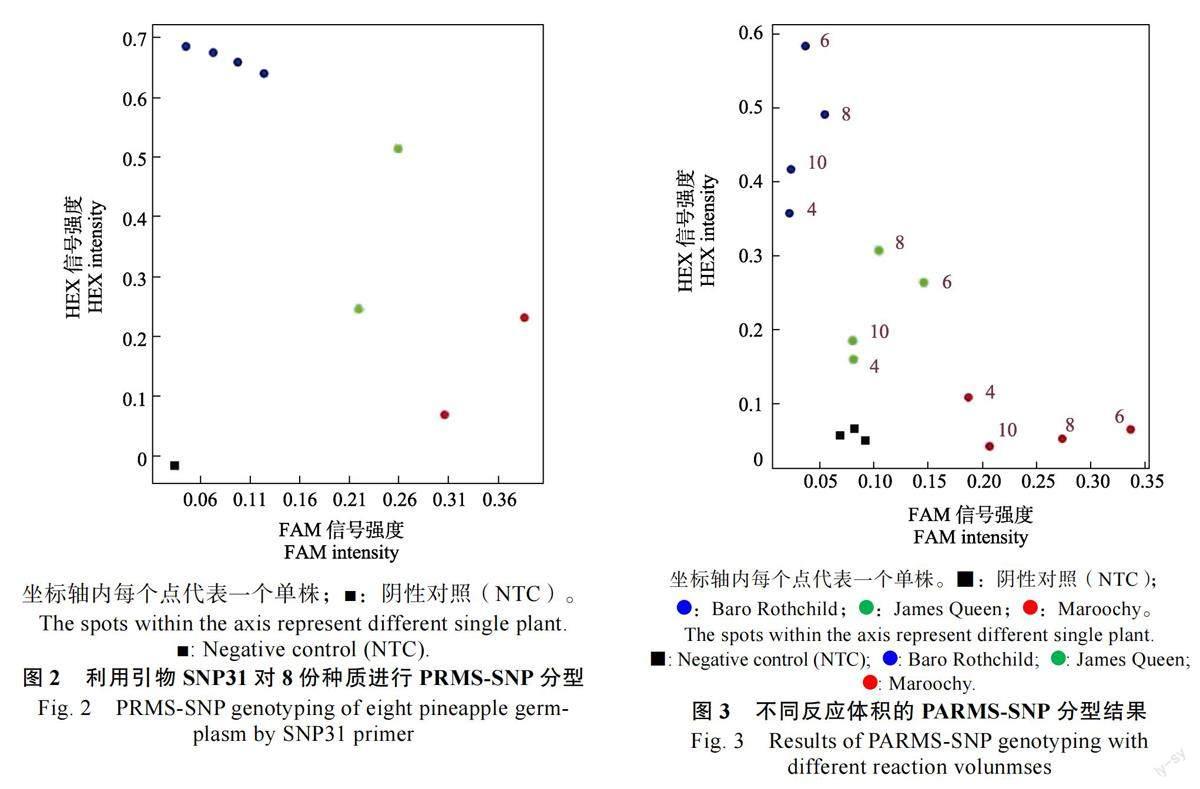
2.2 不同反应体积对PARMS-SNP 分型的影响
PARMS 反应体系中Master mix 是决定反应成本的主要组成部分,反应体积减少则Mastermix 用量减少(表1),可显著降低成本。因此,通过分析不同的反应体积对PARMS-SNP 分型的影响,结果表明,反应体积影响基因型信号点的荧光信号值。4、6、8、10 μL 等4 种反应体积,均实现了很好的基因分型。4 μL 的反应体积下,荧光信号值最低;6 μL 的反应体积下,荧光信号强度最强;8 μL 和10 μL 的反应体系处于二者之间(图3)。综合PARMS-SNP 分型结果及成本,选择6 μL 为最佳的反应体系。
2.3 引物浓度对PARMS-SNP 分型的影响
在已优化的PARMS 反应体系基础上,分析引物浓度对PARMS-SNP 分型的影响。结果表明,在引物浓度为25、50、100 μmol/L 时均能较好地进行分型,但其浓度显著影响荧光值,荧光值随着引物浓度的增加而增强,浓度为100 μmol/L 分型效果最佳(图4)。因此,选择100 μmol/L 作为6 μL反应体积下的最优引物浓度。
2.4 DNA 提取方法及浓度对PARMS-SNP 分型的影响
在已优化的反应体积和引物浓度的基础上,为了节省时间、节约成本,本研究比较CTAB 法和快速提取法提取菠萝叶片基因组DNA 对PARMS-SNP 分型的影响。结果表明,2 种提取方法均能对3 份种质进行较好的PARMS-SNP 分型(图5)。
分析DNA 浓度对PARMS-SNP 分型的影响,结果表明,DNA 浓度对PARMS-SNP 的分型影响较小。其中,以CTAB 法提取的DNA,100 ng 的荧光信号最强,25 ng 和50 ng 的荧光信号差异不显著(图5A);而以快速提取法提取的DNA,稀释100 倍的荧光信号最弱,25 倍的荧光信号最强(图5B)。因此,CTAB 法提取的总DNA,选择100 ng 作为最优模板量,而快速提取法提取的总DNA,以稀释25 倍作为最优模板量。
2.5 PARMS-SNP 优化体系稳定性的验证
根据以上优化结果,确定了适用于菠萝的最佳PARMS 反应体系。总反应体积为6 μL,其中DNA(25 ng)1 μL,PARMS mix 3 μL,Primer mix(100 μmol/L)0.45 μL,ddH2O 1.55 μL。为验证该体系的稳定性,利用SNP31 对65 份菠萝种质进行分型。结果表明,利用该体系分型效果较好(图6),19 份种质资源的基因型为T:T,32 份种质资源的基因型为C:C,14 份种质资源的基因型为T:C 或C:T,说明本研究建立的PARMS-SNP优化体系稳定可靠。
3 讨论
随着生物技术的发展,作物育种由传统的田间选择育种转向分子标记辅助育种[24]。然而早期的分子标记技术如依赖于电泳分析,耗时费力且效率低下,影响了其在育种中的应用[25]。基于SNP位点开发的分子标记技术,具有数量多、通量高、可视化好等优点,逐渐成为基因分型的主流技术,广泛应用于种质资源鉴定、分子标记辅助育种中[26-27]。本研究首次建立了菠萝PARMS 体系并对其进行优化和验证, 获得稳定、可靠的PARMS-SNP 分型体系,为菠萝种质资源鉴定、QTL 定位和分子标记辅助育种提供技术支撑。
PARMS 技术受反应体积、引物浓度、DNA模板用量等的影响。反应体积显著影响基因型信号点的荧光值,大白菜的最适反应体积为4 μL[26],番茄的最小反应体积为5 μL[27],茄子的最小反应体积为6 μL[28]。本研究中,6 μL 的反应体积最佳,4 μL 和10 μL 的反应体系荧光强度减弱,表明反应体积影响PCR 扩增的效果,过高或过低的反应体积均对菠萝的PARMS-SNP 分型有影响。那么,反应体积如何影响PCR 扩增结果?杨双娟等[26]分析引物浓度、模板DNA 的用量等发现,反应体积是通过引物浓度的变化影响分型结果。而引物浓度是通过对引物与DNA 模板的匹配效率来影响KASP 分型结果[29]。引物浓度过低可能会提前消耗殆尽,导致PCR 反应提前终止;引物浓度过高容易发生非特异性扩增或形成引物二聚体,从而抑制目标序列的扩增[30]。本研究中100 μmol/L 的荧光信号值显著高于25 μmol/L 和50 μmol/L,表明引物浓度能够影响分型结果。DNA 模板是影响PARMS-SNP 分型的重要因素,适宜的DNA 模板量是获得足量特异性扩增产物的前提,DNA 模板浓度过低时,扩增产物较少甚至无扩增条带;浓度过高时,非特异性产物增加,特异性扩增受到抑制[26-27]。本研究中25~100 ng DNA模板量均能产生较好的PARMS-SNP 分型,表明菠萝PARMS- PCR反应对模板DNA 的浓度敏感度较小,这一结论与杨双娟等[26]和肖熙鸥等[28]的结果一致。
传统CTAB、DNA 提取试剂盒等方法提取DNA 耗时长、成本高,限制PARMS 标记的应用。因此,寻找一种适用于PARMS 标记的快速提取菠萝基因组DNA 的方法将有助于提高PARMSSNP的分型效率。LU 等[12]发现原始的DNA 裂解液不能对水稻、小麦、玉米和棉花等作物进行基因分型,但稀释5~30 倍的DNA 裂解液能将水稻、小麦、玉米成功基因分型,表明快速提取法获得的DNA 提取液可用于PARMS-SNP 分型,但基因分型的荧光强度受稀释倍数的影响,稀释20 倍以上导致荧光强度下降。本研究结果表明,以CTAB提取的DNA 和快速提取DNA 的稀释液为模板,均能够完成菠萝的基因分型,但快速提取法为模板的PCR反应,荧光强度值随着稀释倍数的增加,逐渐下降。可能原因是随着稀释倍数的增加,稀释液里的模板DNA 浓度下降,导致扩增效率降低,从而导致荧光值减弱。
4 结论
本研究通过对反应体积、引物浓度以及DNA模板用量等影响PARMS PCR 的因素进行優化,建立了菠萝PARMS-SNP 分型体系,其稳定性和可靠性得到了验证。该体系可用于菠萝种质资源的鉴定、QTL 定位和分子标记辅助选择等。

