结直肠癌患者应用腹腔镜行根治术的临床效果观察
王 盼,杨秀春
北京市平谷区中医医院外科,北京 101200
结直肠癌(colorectal cancer, CRC)是一种典型的原发于结肠直肠的恶性肿瘤,随着人们生活方式与环境因素的改变,其发病率也在逐年增加。CRC是由多种复杂因素诱发的,这些因素包括饮食中膳食纤维含量低和动物性油脂含量过多,以及遗传、社会因素等等,其死亡率较高[1]。临床上对于符合指征的CRC大多首选进行根治性手术治疗。传统的开腹手术被广泛用于胃肠道肿瘤的根治性治疗,但其造成切口较大、术中出血较多、术后恢复慢、舒适度差等不利影响。而腹腔镜CRC根治术是一种具有良好应用前景的微创术式。在本项研究中,笔者观察了腹腔镜CRC根治术对结直肠癌患者的临床治疗效果,并与传统开腹手术进行了比较,报告如下。
1 资料与方法
1.1 一般资料
选择2018年1月—2021年3月北京市平谷区中医医院收治的乙状结肠癌、直肠癌患者60例。统一纳入标准:(1)符合我国医政医管局公布的CRC诊疗规范中的临床诊断标准[2];(2)经临床病理证实;(3)符合手术指征;(4)无转移;(5)凝血功能正常;(6)患者自愿签署知情同意书。排除标准:(1)有癌转移证据;(2)肿瘤过大而不利于腹腔镜手术;(3)存在重要脏器功能受损;(4)临床资料不完整;(5)各种原因不能耐受手术者。60例患者按接受手术的差异分成两组,对照组30例,其中男19例、女11例,年龄46~76岁,平均(63.32±4.73)岁;观察组30例,其中男21例、女9例,年龄44~78岁,平均(62.28±5.16)岁。两组基线一般资料比较,差异无统计学意义(P>0.05)。
1.2 方法
所有患者手术前夜进行肠道清洁准备工作,对照组进行全麻开腹手术,根据肿物位置采取合适体位,进入麻醉后,在患者下腹正中行手术切口,进入腹腔后游离乙状结肠、直肠系膜,切除肿瘤及结直肠系膜切除,清扫肠系膜下动脉根部淋巴结,圆形吻合器行端端吻合,完成上述操作之后冲洗腹腔并留置腹腔引流管,逐层缝合手术切口。
观察组借助腹腔镜进行根治术治疗:患者采取改良截石位,全麻后以5孔法建立操作通道,建立CO2气腹(腹压维持12 mmHg),置入腹腔镜探头,探查腹腔并确定肿瘤位置,置入操作器械,游离乙状结肠、直肠系膜,清扫肠系膜下动脉根部淋巴结,视肠管长度决定游离脾曲,裸化肠管后,以切割闭合器将肿瘤远端离断,基于瘤灶位置在腹壁上切开约5 cm切口,将肿瘤近端所在肠段取出体外并进行切除,将肿瘤标本完整摘除,达到全系膜切除,再将近端肠管还纳腹腔,腹腔镜辅助下使用圆形吻合器进行断端吻合,以生理盐水对腹腔进行彻底冲洗,放置腹腔引流管后缝合腹壁切口。
两组患者均是由同一组外科医师进行腹腔镜手术和开腹手术,且所有直肠癌患者手术均为保肛。
1.3 观察项目
观察对比两组手术指标(手术时间、淋巴结清扫数量、术中出血量、手术切口长度),术后恢复指标(腹胀持续时间、肛门排气时间、首次进食时间、住院时间),炎症因子指标(IL−6、IL−8、IL−10、CRP),胃肠道激素水平(血清胃动素、胃泌素水平)、术后并发症情况和1年后生存率。
1.4 统计学分析
使用统计学软件SPSS 20.0进行数据分析。计量资料以±s表示,行t检验;计数资料以百分率(%),行χ2检验和Ridit检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组手术指标对比
两组手术时间、淋巴结清扫数量均无显著性差异(P>0.05),观察组术中出血量少于对照组、手术切口长度短于对照组(均P<0.01)。见表1。
表1 两组不同手术治疗患者手术指标对比(±s)Tab.1 Comparison of surgical indicators between two groups of patients with different surgical treatments(±s)

表1 两组不同手术治疗患者手术指标对比(±s)Tab.1 Comparison of surgical indicators between two groups of patients with different surgical treatments(±s)
组别对照组观察组t值P值例数30 30手术时间/min 151.68±16.24 155.32±15.39 0.89 0.377淋巴结清扫数量/个13.38±2.21 12.43±1.96 1.76 0.083术中出血量/mL 137.28±34.49 96.42±33.76 4.64<0.001手术切口长度/cm 12.36±2.62 5.14±1.67 12.72<0.001
2.2 两组术后恢复指标对比
观察组术后腹胀持续时间、肛门排气时间、首次进食时间、住院时间均明显短于对照组(均P<0.01)。见表2。
表2 两组不同手术治疗患者术后恢复指标对比(±s, d)Tab.2 Comparison of postoperative recovery indicators between two groups of patients with different surgical treatments (±s,d)

表2 两组不同手术治疗患者术后恢复指标对比(±s, d)Tab.2 Comparison of postoperative recovery indicators between two groups of patients with different surgical treatments (±s,d)
组别对照组观察组t值P值例数30 30腹胀持续时间4.47±0.58 3.15±0.52 9.28<0.001肛门排气时间3.72±0.29 2.66±0.37 12.35<0.001首次进食时间3.81±0.58 2.42±0.46 10.28<0.001住院时间12.52±2.04 8.54±1.47 8.67<0.001
2.3 炎症因子指标对比
术前两组血清炎症因子水平均无明显差异(P>0.05),术后1、3、7 d两组IL−6、IL−8、IL−10及C反应蛋白(CRP)水平均有明显变化,且在不同时间点,观察组上述炎症因子水平均明显优于对照组(均P<0.01)。见表3。
表3 两组手术前后不同时间点炎症因子指标的变化(±s)Tab.3 Changes of inflammatory factors at different time points before and after operation in two groups (±s)

表3 两组手术前后不同时间点炎症因子指标的变化(±s)Tab.3 Changes of inflammatory factors at different time points before and after operation in two groups (±s)
注:与本组术前相比,1)P<0.01;与对照组相比,2) P<0.05。
组别对照组观察组例数30 30时间术前术后1 d术后3 d术后7 d术前术后1 d术后3 d术后7 d IL−6/(ng·L−1)3.46±1.62 16.72±3.781)13.91±3.231)11.84±0.561)3.41±1.68 8.85±2.941)2)7.06±1.581)2)5.39±1.271)2)IL−8/(ng·L−1)2.57±1.35 18.63±2.811)15.84±2.621)12.76±1.181)2.53±1.16 16.37±2.621)2)13.38±2.051)2)10.24±1.131)2)IL−10/(ng·L−1)45.24±14.57 22.36±8.381)25.78±9.361)28.17±7.381)46.01±16.26 25.53±12.241)2)29.33±10.611)2)33.51±9.471)2)CRP/(mg·L−1)0.24±0.07 2.96±0.541)2.06±0.521)1.67±0.381)0.27±0.05 2.10±0.581)2)1.31±0.341)2)0.88±0.291)2)
2.4 胃肠道激素水平对比
术前两组血清胃动素、胃泌素水平均无明显差异(P>0.05),术后两组胃动素、胃泌素水平均出现一定的下降,但观察组胃动素、胃泌素水平明显高于对照组(均P<0.01)。见表4。
表4 两组手术前后血清胃动素、胃泌素水平的变化(±s, ng/L)Tab.4 Changes of serum motilin and gastrin levels before and after operation in two groups (±s, ng/L)

表4 两组手术前后血清胃动素、胃泌素水平的变化(±s, ng/L)Tab.4 Changes of serum motilin and gastrin levels before and after operation in two groups (±s, ng/L)
注:与本组术前相比,1)P<0.01。
组别对照组观察组t值P值例数30 30胃动素术前327.19±16.08 330.04±12.52 0.77 0.447术后288.47±19.361)302.71±15.481)3.15 0.003胃泌素术前165.82±10.67 163.27±10.49 0.93 0.355术后120.35±8.141)141.06±7.391)10.32<0.001
2.5 术后并发症情况
观察组术后并发症的出现频率明显低于对照组(P<0.05)。见表5。
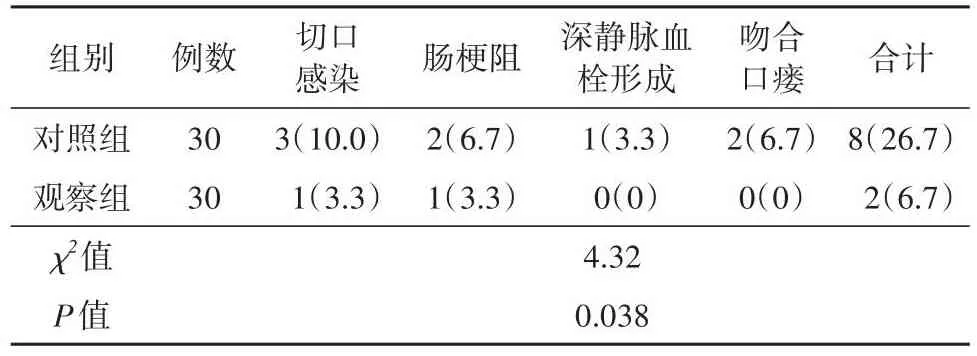
表5 两组术后并发症发生率对比[n(%)]Tab.5 Comparison of postoperative complications between two groups [n(%)]
2.6 生存率对比
经过一年时间的随访,观察组的生存率为80.0%(24/30),对照组为76.67%(23/30),组间比较无明显差异(χ2=0.10,P=0.308)。
3 讨论
近年来,我国CRC的发病率有所上升,大大影响了患者的生活质量。传统的开腹手术是CRC临床治疗中广泛使用的方法,虽然能有效治疗结直肠癌,但由于该手术方式的创伤大,出血量大,有些患者可能无法耐受,对于术后恢复不利[3]。腹腔镜技术应用于CRC根治术,具有手术开口小、失血少、患者恢复快等益处,能在很大程度上弥补传统开腹手术的不足,受到医师和患者的广泛青睐。
在本研究中,观察组的手术切口长度、术中出血量、术后腹胀持续时间和肛门排气时间、首次进食时间、住院时间均短于对照组,术后并发症的发生率也低于对照组,说明腹腔镜手术可以明显控制术中出血量,加快术后康复过程,考虑这与腹腔镜手术在小切口的同时又保障了手术视野,对腹腔脏器的干扰较小有一定关系[4]。胃动素、胃泌素分别由胃肠道Mo细胞、G细胞分泌,属于消化道激素,正常水平的胃动素、胃泌素具有维持胃肠正常运动、刺激胰液、胆汁和肠液分泌等作用[5]。本研究中发现,两组患者术后胃动素、胃泌素水平均出现一定的下降,提示无论是开腹手术还是腹腔镜手术,都可对消化道激素的分泌造成一定的影响,手术的应激会造成对胃动素、胃泌素分泌的不同程度抑制,观察组术后胃动素、胃泌素水平降低幅度小于对照组(均P<0.01),说明腹腔镜手术对其分泌的抑制较小,这在一定程度上有利于保护胃肠道功能,也从另一个角度解释了观察组术后胃肠恢复较对照组更快的原因。
当前,无论哪种腹腔手术都可影响腹腔内脏器功能,其中一个重要原因还在于侵入性的手术操作可使机体炎症水平上升,并因此造成一定程度的免疫抑制,而各种手术类型对脏器功能的影响有一定差异性。IL−6、IL−8是两种典型参与机体炎症过程的炎症因子;CRP是体内炎症反应的敏感指标;而IL−10属于一种抗炎因子,具有抑制单核巨噬细胞释放炎症递质、增强其他抗炎性因子释放等作用;当机体处于炎症状态时,IL−6、IL−8、CRP水平升高,IL−10水平降低[6]。本研究结果显示,观察组进行腹腔镜手术后,IL−6、IL−8、CRP水平较术前更高,但低于对照组,IL−10水平较术前更低,但高于对照组(均P<0.01),说明腹腔镜手术对于应激所造成的炎症反应具有一定的抑制效应[7]。在生存率方面,经过1年时间的随访,观察组的生存率为80.0%(24/30),对照组为76.67%(23/30),组间比较无明显差异(P<0.05)。提示,腹腔镜结直肠癌根治术可以取得和常规开腹结直肠癌根治术相当的远期疗效。
综上所述,笔者认为与传统开腹手术相比,腹腔镜根治术对于CRC患者在保障手术治疗效果的前提下,对胃肠功能的影响较轻微,造成损伤炎症反应更小,术后并发症更少、恢复更快,具有较高的临床应用价值。

