温度胁迫对黑木耳菌丝相关酶活性的影响*
刘岩岩,李 红,王 红,赵玉梅,曹 君,刘 贺,刘俊杰**
(1.辽宁省农业科学院食用菌研究所,辽宁 沈阳 110161;2.抚顺市先进装备制造业发展促进中心,辽宁 抚顺 113000;3.抚顺市现代农业及扶贫开发促进中心,辽宁 抚顺 113000)
黑木耳(Auricularia auricularia)隶属担子菌亚门(Basidiomycotina)层菌纲(Hymenomycetes)木耳目(Auriculariales)木耳科(Auriculariale)木耳属(Auricularia)[1],属于中温型菌类。其营养丰富,含有人体所需的铁、钙、蛋白质、维生素、碳水化合物、粗纤维等营养物质[2],不仅具有食用价值,还有较高的药用价值。中医认为黑木耳具有清肺、益气、治疗痔疮的功效,早在《本草纲目》中就有记载木耳性平、味甘,轻身强志,益气不饥。现已有研究证明,黑木耳粉对因二氧化硅粉尘吸入导致的矽肺病有一定的抑制作用。黑木耳多糖有抑菌、抗氧化、预防心血管相关疾病等多种医药功效[3]。
中国为全球黑木耳栽培、出口第一大国,栽培量占全世界的95%以上[4]。黑木耳栽培方法受地域、气候等因素影响而有不同,获得的子实体在品质和产量上也存在较大差异。目前,国内大面积人工栽培的黑木耳,大多采用袋料式栽培,此种方式因栽培周期短、产量高而优势突出,现已成为其人工栽培的主要方式。在食用菌生长发育过程中因光照、温度、湿度等环境因素不同,其品质和产量会受到影响[5]。黑木耳是中温型食用菌品种,菌丝体在5~35 ℃条件下均可以正常生长[6]。
利用人工袋料栽培黑木耳虽然历史较长、经验丰富,但由于栽培者技术水平和管理理念的不同,导致获得的收益千差万别。全光照露地栽培管理方式较为传统,由于目前还不能实现精准化管控,栽培期间常出现菌包烧热等现象,导致菌丝体生理及子实体农艺性状发生改变,影响黑木耳的产量和品质。刘秀明等[7]在温度胁迫12 h 和24 h 内,对白灵侧耳[Pleurotus nebrodensis(Inzenga)Quél.]菌丝中3 种保护酶的活性进行检测时发现,超氧化物歧化酶SOD(Super oxide dismutase,SOD)和过氧化物酶POD(Peroxidaseoxide dismutase,POD)活性迅速提高,随后下降;在整个胁迫过程中过氧化氢酶CAT(Catalase,CAT)活性一直处于较高水平。闫静等[8]对秀珍菇(Pleurotus geesteranus)的研究发现,在同一温度条件下,随着菌丝培养时间的延长,胞外羧甲基纤维素酶CMC(Carboxymethyl cellulase,CMC)、半纤维素酶(Hemicellulases)、滤纸纤维素酶FPA(FibrinopepideA,FPA)和淀粉酶AMY(Amylase,AMY)4 种胞外酶活性增强,而胞外漆酶LC(Laccases,LC)活性有所下降。处理温度越低,漆酶活性越低,胞外5 种酶的活性总体呈先升后降的趋势。韩增华等[9]发现不同品种的黑木耳菌种中漆酶和多酚氧化酶PPO(Polyphenol oxidase,PPO)活性的变化趋势大致相同,酶活性变化与产量呈正相关。不同种类的食用菌,菌落形态不相同,菌丝在受到高温胁迫后,应激反应也不相同[10]。
上述研究证明,在食用菌栽培过程中,温度是影响食用菌生长发育的重要因素,不同食用菌品种或同种食用菌,不同生长时期对温度的要求也不相同。不同温度对食用菌酶活性的影响都是菌丝体适应环境的结果[11],菌丝只有在适宜的温度范围内,才能进行正常的新陈代谢。包括食用菌在内的多种生物体,在高温胁迫下,活性氧氧化生物膜会产生多种不饱和醛酮产物使蛋白质变性,并且破坏细胞膜的稳定性,对菌丝具有伤害作用,使其生理紊乱。
在生理学中高温胁迫对生物产生的影响是非常重要的研究课题。
通过对黑木耳菌株进行一定时间的高温胁迫后,测定黑木耳营养生长期和生殖生长期菌丝中丙二醛MAD(malondialdehyde, MAD)的含量, SOD、PPO、CAT、谷胱甘肽还原酶GR(glutathione reductase,GR)等的活性及子实体的农艺性状,探讨黑木耳对温度胁迫的生理反应,为温度控制、品种选育和栽培技术标准的制定提供技术手段和理论支持。
1 材料与方法
1.1 材料
1.1.1 菌种及来源供试菌种黑木耳“沈8-9”,为辽宁省主栽品种之一,由辽宁省农业科学院食用菌研究所保藏。
1.1.2 培养基
PDA 培养基:200 g 马铃薯、20 g 葡萄糖、3 g磷酸二氢钾、1.5 g 蛋白胨、1.5 g 硫酸镁、15 g 琼脂粉、1 000 mL 纯净水,pH 自然。
液体培养基:200 g 马铃薯、20 g 葡萄糖、3 g磷酸二氢钾、1.5 g 蛋白胨、1.5 g 硫酸镁、1 000 mL纯净水,pH 自然。
栽培袋培养基:木屑85%、麦麸12%、石膏1%、豆面2%,pH 为7.5。
1.1.3 检测试剂盒
MAD 含量检测试剂盒和SOD、PPO、GR、CAT检测试剂盒均购自苏州科铭生物技术有限公司。
1.2 方法
1.2.1 菌种制备
将供试菌种黑木耳沈8-9 母种接种到PDA 平板培养基上,封口放置在25 ℃恒温培养箱内培养,待菌丝长满整个平板后取出。在无菌条件下,用接种铲将培养好的菌丝转接到液体培养瓶中,置于25 ℃恒温培养箱内静置12 h 后,在150 r·min-1、25 ℃条件下培养5~7 d。
1.2.2 栽培袋制作
按常规方法生产菌棒,使用16.5 cm×33 cm 的聚乙烯栽培袋装袋,灭菌后的菌袋转移至冷却间,待菌袋温度降到30 ℃以下时接种。接10 mL 液体原种到栽培袋中,接种200 棒,设3 个重复。将接种后的菌袋置于25 ℃环境下避光培养,直到菌丝长满菌袋。分别在温度为25 ℃和35 ℃的培养室内放置100 棒菌袋,培养12 h 后取出,进行正常出菇管理。
1.2.3 菌落形态观察
取35 ℃胁迫12 h 后的菌丝转接至PDA 培养基上,在25 ℃条件下培养,测定菌丝在平皿中的生长速度,同时与在25 ℃条件下培养的菌丝生长速度进行对比分析。
1.2.4 酶活测定
经高温胁迫12 h 后,分别在耳芽期、出耳期随机选取5 袋菌包,取耳芽或耳片,测定质量后分装于1.5 mL 离心管中,置于-80 ℃超低温冰箱保存后,进行MAD 含量及SOD、PPO、GR、CAT 等抗性酶系活性的测定。
1.2.5 黑木耳农艺性状观测记录
观测记录高温处理后黑木耳菌株菌丝的现耳芽时间、耳片颜色、耳片厚度、耳片宽度、产量、出芽整齐度和污染率指标[12-13]。耳片性状选取第1 潮30 朵鲜耳进行测定。耳片厚度、宽度用游标卡尺以“十”字形进行测量,记录子实体颜色的深浅。
2 结果与分析
2.1 菌落形态特征
不同温度处理下黑木耳菌丝生长情况见表1 和图1。

图1 不同温度处理后菌丝的生长情况Fig.1 Growth situation of hypha after different temperatures
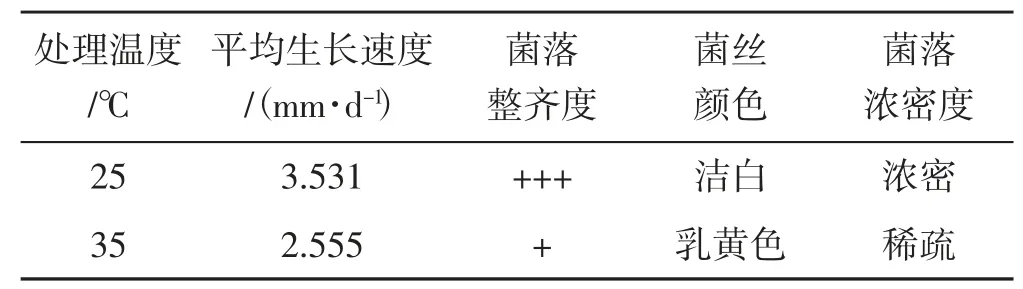
表1 不同温度处理黑木耳菌丝生长情况Tab.1 Growth situation of mycelium of Auricularia auricularia at different temperatures
由表1、图1 可知,菌丝回接到PDA 培养基后,25 ℃条件下培养的黑木耳菌丝洁白、致密,长势均匀,边缘整齐,生长速度为3.531 mm·d-1。35 ℃胁迫12 h 后的黑木耳菌丝呈乳黄色,菌丝稀疏,边缘整齐度差,生长速度为2.555 mm·d-1。
2.2 高温胁迫对MAD 含量的影响
高温胁迫对MAD 含量的影响见图2。
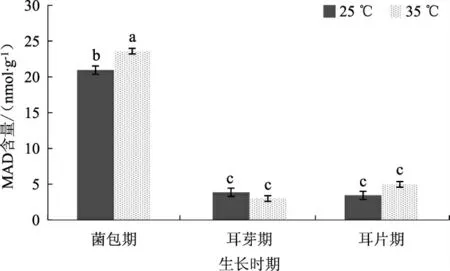
图2 不同温度条件下黑木耳菌丝中MAD 的含量Fig.2 MAD contet of Auricularia auricularia mycelium under different temperature conditions
由图2 可以看出,35 ℃高温胁迫菌包12 h 后,菌丝中MAD 的含量为23.59 nmol·g-1,比对照组(25 ℃处理组)高3.46 nmol·g-1,而耳芽期和耳片期的MAD 含量处于低表达量水平,且受高温胁迫影响不显著。
2.3 高温胁迫对SOD 活性的影响
不同温度条件下黑木耳菌丝中SOD 的活性见图3。
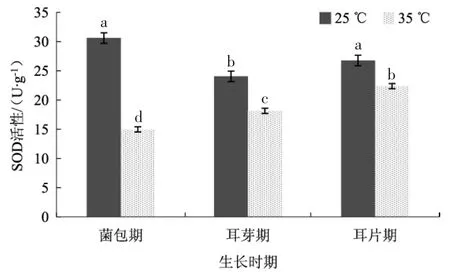
图3 不同温度条件下黑木耳菌丝中SOD 的活性Fig.3 SOD activity of Auricularia auricularia mycelium under different temperature conditions
由图3 可以看出,35 ℃高温胁迫菌包12 h 后,菌丝中SOD 活性从30.61 U·g-1下降到14.97 U·g-1,下降了48.68%。随着菌包中菌丝的自然恢复,耳芽期高温胁迫后菌丝中SOD 的活性为CK 组的75.44%,含量提升了26.76%;耳片期高温胁迫后菌丝中SOD 的活性为CK 组的78.40%,含量分别比菌包期和耳芽期提升了29.72%和2.96%。结果表明,高温胁迫后黑木耳菌丝中SOD 的活性迅速下降,而到耳芽期和耳片期时,SOD 活性高于CK,有所提升。
2.4 高温胁迫对PPO 活性的影响
不同温度条件下黑木耳菌丝的PPO 活性见图4。
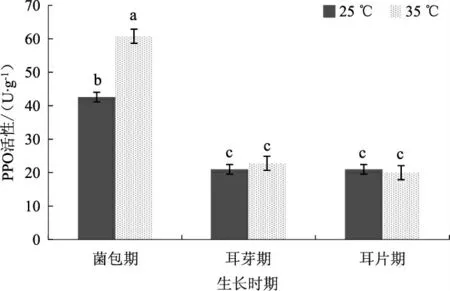
图4 不同温度条件下黑木耳菌丝的PPO 活性Fig.4 PPO activity of Auricularia auricularia mycelium under different temperature conditions
由图4 可以看出,35 ℃高温胁迫菌包12 h 后,菌丝中PPO 的活性为60.80 U·g-1,是CK 的1.43倍,菌包期的处理对耳芽期和耳片期PPO 的活性无显著影响,整体活性水平在20~22.8 U·g-1。
2.5 高温胁迫对CAT 活性的影响
不同温度条件黑木耳菌丝中CAT 的活性见图5。
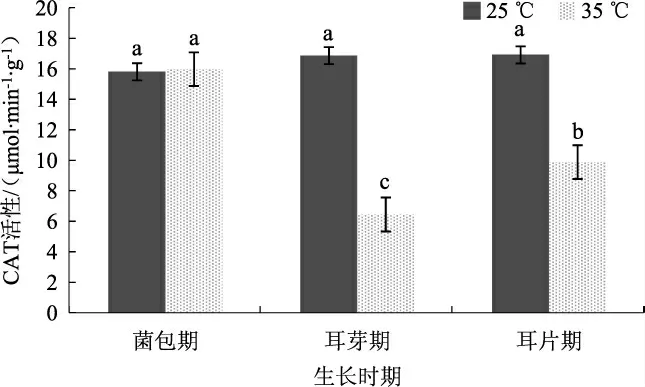
图5 不同温度条件黑木耳菌丝中CAT 的活性Fig.5 CAT activity of Auricularia auricularia mycelium under different temperature conditions
由图5 可以看出,35 ℃高温胁迫菌包12 h 后,CAT 活性未发生明显变化,为16.572 μmol·min-1·g-1,而CK 中CAT 的活性为16.442 μmol·min-1·g-1。当生长发育到耳芽期和耳片期时,CAT 活性均低于CK,其中耳芽期CAT 活性最低,为6.45 μmol·min-1·g-1,仅为CK 组的37.65%。
2.6 高温胁迫对GR 活性的影响
不同温度条件下黑木耳菌丝的GR 活性见图6。
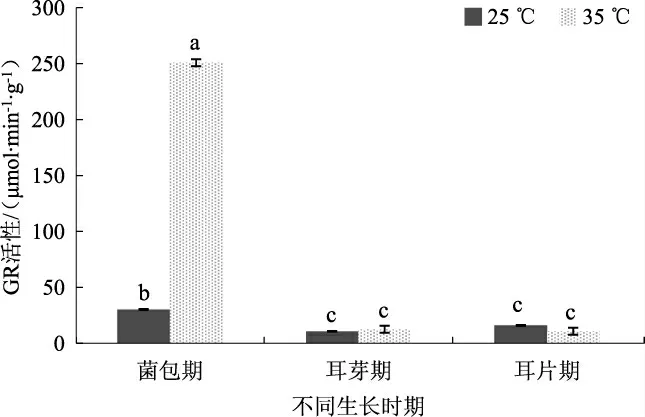
图6 不同温度条件下黑木耳菌丝中GR 的活性Fig.6 GR activity of Auricularia auricularia mycelium under different temperature conditions
由图6 可以看出,35 ℃高温胁迫菌包12 h 后,黑木耳菌丝中GR 活性为250.84 nmol·min-1·g-1,是CK组的8.29 倍。耳芽期和耳片期GR 的活性为10.72~16.08 nmol·min-1·g-1,对照组和处理组差异不显著。
2.7 高温胁迫对黑木耳农艺性状的影响
不同温度处理后黑木耳子实体农艺学性状见表2。

表2 不同温度处理黑木耳子实体农艺性状Tab.2 Agronomic characters of Auricularia auricularia fruiting body under different temperature conditions
从表2 可以看出,在35 ℃条件下,黑木耳耳芽形成的时间比CK 组晚2 d,耳片较薄,耳片颜色差异不明显,耳片比对照组宽1.452 cm,可能是受高温胁迫后该品种朵形发生了变化。高温胁迫后的菌包不但产量比对照组低4.87 g,污染率更是达到15%。说明高温条件下,菌丝的活力会受到影响,其抗病能力也大大减弱,易受污染。
3 结论与讨论
研究表明,黑木耳“沈8-9”对高温胁迫较为敏感。菌丝体在受高温胁迫后,其形态及显微结构都出现变化。在温度不适宜的条件下,黑木耳菌丝体的生长速度、色泽、长势等都存在差异。35 ℃条件下高温胁迫12 h,菌包培养期、耳芽期和出耳期3 个不同时期菌丝中多种酶的活性变化都大于25 ℃。其中SOD 活性在培养期迅速下降,但在整个生长期内,活性不断增强;MAD 含量和PPO、CAT、GR活性变化明显,且在耳芽期和耳片期活性处于较低水平,但受高温胁迫持续影响不显著。
高温胁迫后,菌包培养期MAD 含量升高,抗性酶系活性升高或降低,是黑木耳菌丝自身抵抗外界胁迫产生的应激反应。MAD 是菌丝细胞膜系统受到损伤后产生的最终产物,其含量多少反映细胞膜的受损程度。抗性酶系活性的变化是由于菌丝将细胞内形成的过氧化物转化为低毒或无毒物质,以维持体内活性氧的代谢平衡。耳芽期和耳片期是菌丝从营养生长转变到生殖生长的时期,菌包培养期受高温胁迫对这2 个时期的影响较弱。
在催芽过程中,各处理间耳芽形成时间和整齐度无显著变化。头潮耳采收时间较早的是25 ℃处理的菌棒,35 ℃处理组的采收时间最晚。耳芽的整齐度与菌丝是否受温度胁迫无直接的相关性,这可能是因为黑木耳在催芽期的整齐度与环境湿度有关,栽培袋所处的位置通风好、湿度小,导致耳芽不整齐。
从栽培试验可以看出,栽培袋刺孔后所处的温度条件不同会直接影响木耳的产量和商品性状。在25 ℃条件下,耳片的农艺性状无显著变化;35 ℃条件已经对黑木耳菌丝体活力造成影响,不但产量降低、商品性状下降,污染率也大大增加。试验结果显示,高温胁迫使SOD 活性在初期迅速降低,后期活性不断增强,表明其一直在修复自身的活性损伤。结合产量及耳片相关农艺性状的变化总结得出,温度的变化影响菌丝生长过程中相关酶的活性,活性与受胁迫时间无正相关关系。在栽培过程中,不同温度及胁迫时间对产量、污染率等农业性状变化有直接关系,温度越高且胁迫时间越长,产品品质及产量越低。

