基于网络药理-分子对接探讨乌药治疗酒精性肝炎的作用机制
谭明明 张优妮 严聪聪 庞霄君 王军伟
浙江省天台县人民医院,浙江天台 317200
乌药(Lindera aggregata)系樟科山胡椒属植物,有行气止痛、温肾散寒之功,成分包括挥发油、倍半萜类化合物、异喹啉类生物碱、黄酮类、木脂素以及环戊二烯酮等[1]。研究表明,乌药可降低酒精性肝炎(alcoholic hepatitis,AH)模型大鼠血清丙氨酸氨基转移酶、天冬氨酸氨基转移酶,缓解AH[2]。乌药可通过调节大鼠肠道菌群,抑制炎症反应,发挥保肝效应,机制与降低TLR4/NF-κB 通路的激活有关[3]。本研究基于网络药理学,筛选乌药的活性成分和潜在靶点,分析关键蛋白涉及的生物学功能及信号通路,构建“活性分子-靶点-通路”的网络药理图。通过分子对接技术,分析乌药活性成分与靶蛋白的相互作用,为进一步揭示乌药治疗AH 的药理机制提供理论基础。
1 资料与方法
1.1 乌药组分
通 过TCMSP[4]以“乌 药”为 检 索 词,获 得乌药所有成分信息,设定筛选参数OB ≥30%、DL ≥0.1[5]。
1.2 活性成分靶蛋白预测
采用三种在线工具预测活性分子的靶蛋白,分别是:利用TCMSP 预测活性分子的靶蛋白,基于Uniprot[6]对蛋白名称进行Symbol 转化,利用BATMAN[7]预测活性分子对应的靶蛋白,并根据靶蛋白相互作用与已知靶点相似的可能性进行得分排序,设定Score cutoff=20。利用在线工具Swiss target prediction[8],预测化合物的靶标,设定筛选物种为“Homo sapiens”“Probability>0”。将所有筛选到的活性成分靶蛋白进行合并作为潜在靶蛋白。
1.3 筛选疾病相关靶蛋白
以“Hepatitis,Alcoholic”为关键词,分别在CTD[9]、DisGeNET[10]及GeneCards[11]中,检索AH 相关基因。整合三个数据库的检索结果,并与先前预测的靶蛋白取交集,认定AH 相关的靶蛋白。
1.4 功能和通路富集分析
利用R 软件包clusterProfiler[12]对AH 靶蛋白进行GO 生物过程和KEGG 通路富集分析,参数设置为FDR<0.05,选取富集最显著的前20 位功能条目或通路,绘制气泡图。
1.5 靶蛋白相互作用分析
利用在线数据库String[13]对靶蛋白间相互作用(protein-protein interaction,PPI)进行分析,物种设置为“Homo sapiens”“combined score ≥0.4”。利用Cytoscape[14]对PPI 进行可视化。采用CytoNCA[15]对PPI 网络中的节点进行中心度(degree centrality,DC)分析,参数设置为“without weight”。通过各个节点的连接度排名,得到PPI 网络中的重要节点,即为hub 蛋白。利用Cytoscape 软件的MCODE 插件识别网络中的模块基因,参数设置为“Degree Cutoff=2”“Node Score Cutoff=0.2”“K-core=2”“Max Depth=100”。
1.6 药理学网络构建
基于“乌药- 成 分- 靶 蛋白- 通 路”,利 用cytoscape 构建药理学网络,展示乌药活性成分的靶蛋白及信号通路。
1.7 分子对接
选取富集到AH 通路的基因,通过PDB 数据库[16]下载靶蛋白结合配体复合物的PDB 格式文件,采用pymol 进行复合物的预处理,得到靶标蛋白,进行分子对接。设定靶蛋白的筛选条件:通过X 射线衍射方法获得的蛋白质结构;蛋白 质 结 构 分 辨 率<3;“Polymer Entity Type”设置为“Protein”;得分降序排名第一。选取药理学网络中连接度较大的成分作为关键分子,通过PubChem 数据库[17]下载关键分子的分子结构,并保存为SDF 格式文件,通过pymol 转换为PDB 格式,用于分子对接。将处理好的靶蛋白与活性分子导入Autodock[18],采用Lamarckian GA 算法进行分子对接。
2 结果
2.1 乌药活性成分
通过检索TCMSP,得乌药的127 种化学成分。按阈值筛选得到33 种重要成分(表1)。
2.2 活性成分的靶蛋白预测
根据设定的阈值,TCMSP 共预测得到371 个成分-靶标关系对,包含了30 个活性成分、177 个靶 标;BATMAN 共 预 测 得 到1095 个 成 分- 靶标关系对,包含了13 个活性成分、488 个靶标;Swiss target prediction 共预测得到1451 个成分-靶标关系对,包含了30 个活性成分、551 个靶标。合并以上的预测结果,共得到2838 个活性成分-靶蛋白关系对,包括33 个活性成分和1019 个靶蛋白。
基于三个数据库(CTD、DisGeNET 和GeneCards)依次得到AH 相关基因9248、133、6115 个。对上述预测得到活性成分相关的靶基因和3 个疾病相关基因集取交集,筛选得到27 个重叠的靶蛋白,这些靶蛋白被认为是乌药治疗AH 中的潜在作用靶蛋白。
2.3 靶蛋白功能和通路富集分析
对上述27 个潜在靶基因进行GO 和KEGG 通路富集分析。GO 显示,最显著的前20 位基因功能涉及白细胞迁移、细胞黏附的正向调节、DNA 结合转录因子的调节、细胞对生物刺激的应答等(图1A)。KEGG 分析结果显示,富集最显著的信号通路包括细胞衰老、Toll 样受体通路、C 型凝集素受体通路、人T 细胞白血病病毒1 感染、乙型肝炎、TNF 信号通路等(图1B)。
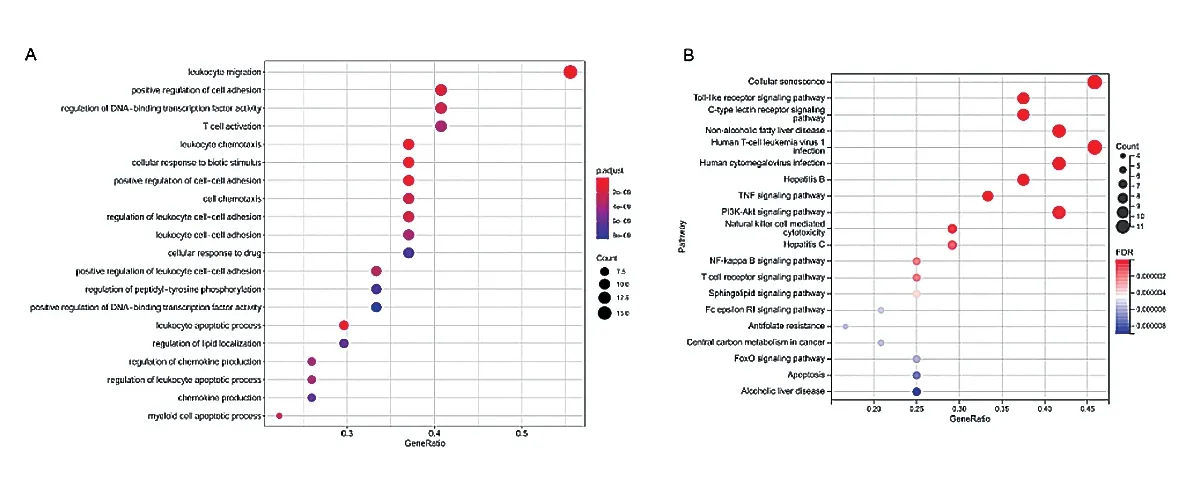
图1 靶蛋白的功能通路富集top20 结果气泡图
2.4 靶蛋白相互作用分析
通过String 对靶蛋白的PPI 进行预测,采用Cytoscape 生成网络图。结果显示,共有25 个蛋白有互作关系,161 个关系对(图2A)。网络图中degree 值较高的前10 位蛋白,分别是TP53、TNF、IL-1B、IL-6、MYC、CXCL8、ICAM1、SIRT1、IL-10、SYK,即为潜在的靶蛋白。

图2 活性成分-靶蛋白相互作用的PPI 网络图(A)及功能子模块(B)
采用MCODE 算法,共筛选出2 个子模块,module1 和module2,其中上述hub 蛋白均包含在模块内(图2B)。
2.5 “活性成分-靶点-通路”网络构建
基于上述得到的27 个关键靶蛋白,结合其对应的成分,靶蛋白及通路关系,构建“活性成分-靶点-通路”网络,如图3 所示,网络共包含59 个节点。其中PIK3CD、PIK3CA、PPARG、TNF、RELA、IL-6、IL-1B、TP53 等可能是乌药作用AH 的潜在靶点;这些靶点富集到的通路有20 个,包括PI3K/AKT 信号通路、癌症中心碳代谢、丙型肝炎、C 型凝集素受体信号通路、人T 细胞白血病病毒1 感染、Toll 样受体信号通路等。
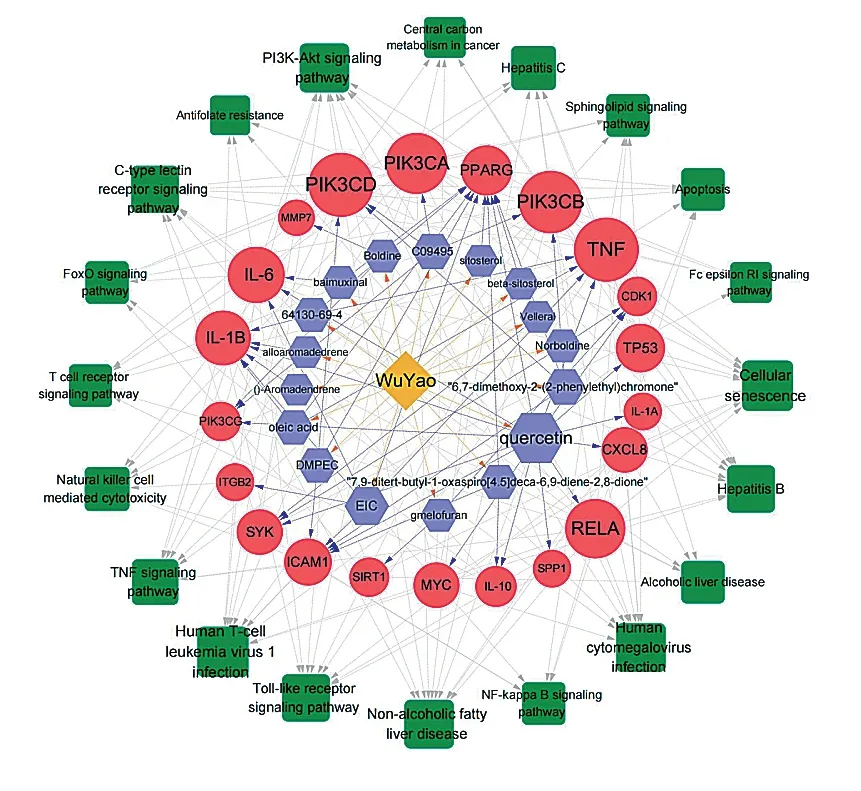
图3 “活性成分-靶点-通路”网络图
2.6 分子对接
选取PPI 网络中AH 相关的蛋白,共有6 个,为CXCL8、IL-1B、IL-6、TNF、SIRT1 和RELA,基于“活性成分-靶点-通路”网络,筛选靶蛋白对应的活性分子。对于多个活性分子靶向同一个蛋白,选取连接度较大的作为关键节点,最终筛选到3 个活性分子,依次为槲皮素(quercetin),亚油酸(EIC)和石梓呋喃(gmelofuran);其中quercetin 靶向CXCL8、IL-1B、IL-6、RELA 和TNF;EIC 靶向IL-1B、IL-6和TNF;gmelofuran 靶向SIRT1。结果表明,活性成分与关键靶点具有较强的结合活性,主要通过氢键相互作用与靶蛋白的氨基酸位点结合。
3 讨论
本研究采用网络药理学研究,预测乌药治疗AH的关键靶点及作用机制。通过在线预测工具,共筛选得到27 个重要靶蛋白。功能和通路富集分析显示,这些分子主要参与白细胞迁移、细胞黏附的正向调节、DNA 结合转录因子的调节、Toll 样受体通路、C 型凝集素受体通路、乙型肝炎、TNF 信号通路等。分析显示,乌药的活性成分可通过多种信号通路干预AH,其中PIK3CD、PIK3CA、PPARG、TNF、RELA、IL-6、IL1B、TP53 是网络中关键节点,可能是乌药作用于AH 的潜在靶点,涉及的通路包括PI3K/AKT 信号通路,癌症中心碳代谢,Toll 样受体信号等。
本研究对乌药治疗AH 的主要活性成分,潜在靶点及作用机制进行探讨,阐述了多组分、多靶点以及多种通路间相互作用的复杂网络关系。通过构建“活性分子-靶点-通路”网络,结合分子对接技术,预测乌药中的三种活性成分,槲皮素、亚油酸和石梓呋喃可能通过氢键结合炎症通路(CXCL8、IL1B、IL-6、RELA、TNF 和SIRT1)的多个关键蛋白,参与调控炎症反应,从而发挥保肝作用。本研究获得了对三种活性成分在AH 保护作用机制中靶点的概述,将为乌药在治疗AH 中的作用提供更好的研究视角和见解。

