NMM抗肿瘤DNA疫苗原液大肠杆菌菌体蛋白质残留量检测方法的建立与验证
郭润姿 伊君梅 孙 澳 田 园 车亦伟 邱创钧 王 宇
固安鼎泰海规生物科技有限公司,河北廊坊 065500
NMM[携带编码肿瘤基因纽约食管鳞状细胞癌1(NY-ESO-1)、黏蛋白1(MUC-1)、黑色素瘤抗原家族A3(MAGE-A3)]肿瘤治疗性DNA 疫苗裸质粒注射液(简称“NMM 抗肿瘤DNA 疫苗”[1])属于重组生物制品,系采用大肠杆菌作为受体菌,将带有编码肿瘤相关基因的pNMM 质粒转化进入菌体后制备工程菌,通过发酵、SDS 碱裂解菌体后粗纯、精纯等步骤而制得的质粒DNA,主要用来治疗黑色素瘤、乳腺癌、淋巴癌、皮肤癌等体表实体瘤。由于该产品源自大肠杆菌发酵,生产过程中会有大肠杆菌菌体蛋白质残留,宿主细胞蛋白质(host cell proteins,HCPs)属于异源蛋白,成分复杂,包括宿主细胞的结构蛋白以及宿主细胞分泌的催生长因子[2],且会因生产过程及纯化工艺的不同而发生变化。宿主菌菌体蛋白残留是影响生物制品安全性的主要因素之一,产品中残存的菌体蛋白等杂质可能是引起机体过敏反应的重要原因[3-4],现行版《中华人民共和国药典》[5]中规定对依托大肠杆菌发酵的重组生物制品中宿主菌蛋白质残留量应不高于0.1%,对于依托酵母菌生产的重组生物制品,宿主菌蛋白质残留量的控制更为严格(应不高于0.05%)。
目前宿主细胞蛋白质的分析检测技术分为定性和定量两种方式,其中定性的检测方法有二维电泳法(2D-PAGE)[6],而定量检测的方法有酶联免疫法[2,7]、毛细管电泳法等[8]。本研究选用美国Cygnus 公司的大肠杆菌宿主细胞ELISA 检测试剂盒进行检测,该试剂盒带有用抗大肠杆菌菌体蛋白抗体包被的酶标板,其抗体是由包含如DH-5α、BL21、K12、JM109 等多种大肠杆菌菌体混合溶菌液反应产生的。本品生产使用的基因工程菌为XL10-Gold,为大肠杆菌K12 系菌株中的一个变种,因此可以使用该试剂盒进行大肠杆菌菌体蛋白质残留量测定。该方法具有简洁、快速、灵敏度高等优点,具有较广泛的应用性。本研究拟从专属性、检测限、定量限、线性、精密度、准确度、耐用性等方面进行验证,以便确认该方法是否适用于NMM 抗肿瘤DNA 疫苗原液中宿主菌蛋白质残留量的检测。
1 仪器与试剂
MB-580 型多功能酶标仪及数据分析软件(深圳汇松科技发展有限公司);振荡器。
大肠杆菌宿主细胞ELISA 检测试剂盒(美国Cygnus);原液空白溶剂(DNA 溶解液,主要成分:13.6 mmol/L 磷酸氢 二 钠、3.2 mmol/L 磷酸二氢钠、6 g/L 氯化钠,由固安鼎泰海规生物科技有限公司制备);NMM 抗肿瘤DNA 疫苗原液(批号:Bulk20200601、Bulk20200602、Bulk20200703、Bulk20200704、Bulk20200805,由固安鼎泰海规生物科技有限公司生产)。
2 方法与结果
2.1 方法的建立
2.1.1 标准品溶液 取试剂盒中菌体蛋白标准品溶液,浓度分别为0、1、3、12、40、100 ng/ml,备用。
2.1.2 检测方法 准确吸取菌体蛋白标准品溶液,原液空白溶剂以及供试品各25 μl 加入到酶标板内,每个溶液平行2 个复孔,每孔加入酶标抗体100 μl,轻轻振荡混匀,用盖膜板盖住酶标板,于室温(20℃~28℃)180 rpm 振荡孵育90 min;小心揭开盖板膜,将孔内液体甩干,每孔用350 μl 1×洗涤工作液充分洗涤5 次,每次洗板间隔10 s,用吸水纸拍干;向每孔中加入100 μl TMB 底物液,轻轻振荡混匀,用盖膜板盖板后室温(20℃~28℃)静置孵育30 min;每孔加入100 μl 反应终止液,轻轻振荡混匀,用酶标仪测定450 nm 处吸光值,并记录各样品于450 nm 下的吸光值;采用酶标仪中自带的分析软件,以宿主菌蛋白质标准品浓度为横坐标,以吸光值为纵坐标,绘制标准曲线并求得回归方程。
2.1.3 标准曲线类型的选择 目前使用ELISA 法检测宿主菌蛋白质残留量数据的处理多为线性回归模型[2,7,9],线性回归模型纳入至各国药典具有较长的应用历史,但线性回归只是在一个范围内对反应的近似模拟,真实的生物学反应多为S 型曲线[10-12]。本研究使用四参数logistic 曲线,方程形式为y=D+(A-D)/[1+(x/C)B],式中y表示反应值;x表示药物作用浓度;A、B、C、D 为4 个特征性参数,其中A为反应下渐近线,D 为反应上渐近线,B 为吸光值增长速率参数,C 为半数反应浓度。通过收集大量的测试结果发现线性拟合方程的R2>0.98,使用四参数logistic 曲线拟合方程R2值能达到0.9999 以上,表明四参数logistic 曲线拟合的方式能更准确地反映样品中宿主菌蛋白质的含量,故选择四参数logistic 法拟合标准曲线。
2.1.4 样品稀释倍数的确定 将三个批次DNA 疫苗原液用原液空白溶剂稀释5 倍作为供试品溶液,对比稀释5 倍的供试品溶液以及DNA 疫苗原液吸光值并计算宿主菌蛋白质含量。由表1 可知原液空白溶剂、DNA 疫苗原液以及稀释5 倍后的供试品吸光值均与0 ng/ml 标准品吸光值接近,宿主菌蛋白质含量检测结果均低于该试剂盒的最低有效定量限(1 ng/ml),表明原液空白溶剂对宿主菌蛋白质的检测无干扰,使用本方法检测宿主菌蛋白质含量时,DNA 疫苗原液不需要稀释。
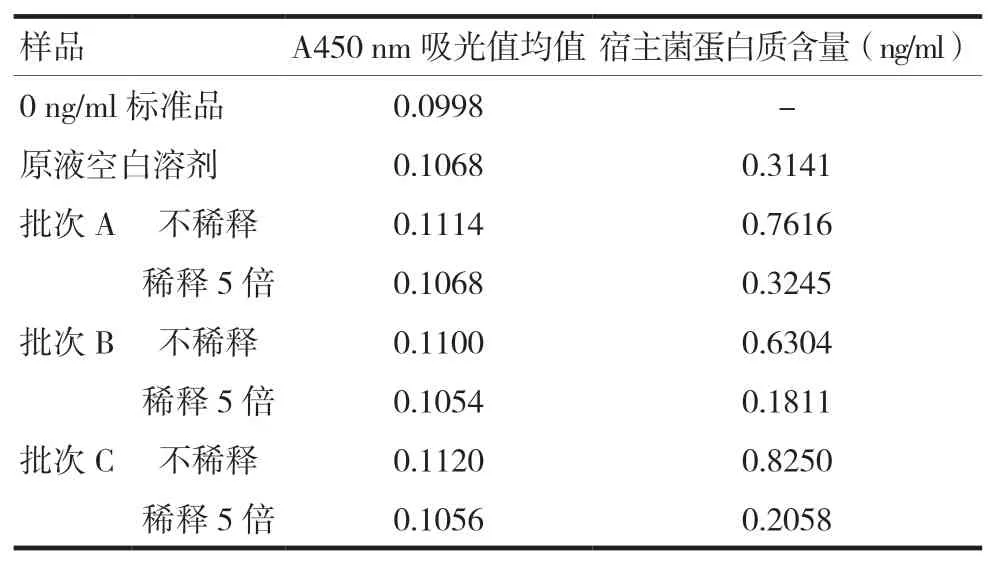
表1 吸光值以及宿主菌蛋白质含量
2.2 方法学验证
2.2.1 专属性 溶液A:0 ng/ml 标准液与DNA 疫苗等比混合;溶液B:80 ng/ml 标准液与DNA 疫苗等比混合;溶液C:40 ng/ml 标准品;溶液A 平行3 个复孔、溶液B 平行3 个复孔,溶液C 平行6 个复孔。照2.1.2 项下对各溶液中宿主菌蛋白质含量进行检测,溶液A 与溶液B 的含量之差如在溶液C 含量测定值的95%可信区间内(即x±2SD),表明供试品不会对该检测方法产生干扰作用。当结果大于可信区间时,表示样品对检测有增强作用;当结果小于可信区间时,表示样品对检测有抑制作用[13]。结果见表2。溶液C 含量均值为42.2581 ng/ml,标准差SD值为0.73,溶液A 与溶液B 的含量之差为43.0206 ng/ml,介于x±2SD区间(40.7981 ~43.7181 ng/ml),表明DNA 疫苗原液对宿主菌蛋白质含量的检测无干扰。

表2 专属性试验结果
2.2.2 检测限与定量限 对0 ng/ml 标准液连续测定6 次,计算吸光值x和SD,根据标准曲线求得“x+3SD”对应的宿主菌蛋白质的含量,即为本试剂盒的检测限;“x+10SD”对应的宿主菌蛋白质含量即为本试剂盒的定量限。由实验结果可知本方法的检测限为0.41 ng/ml,定量限为0.98 ng/ml,其定量限浓度与试剂盒说明书定量限浓度1 ng/ml 相符。
2.2.3 线性和范围 对试剂盒中0、1、3、12、40、100 ng/ml 标准液进行检测,选用四参数方程进行回归分析,回归方程为:y=9.8481+{-9.7831/[1+(x/569.7997)1.0407]},R2值可达0.99999。标准曲线见图1,本方法在0 ~100 ng/ml 范围内线性关系良好。
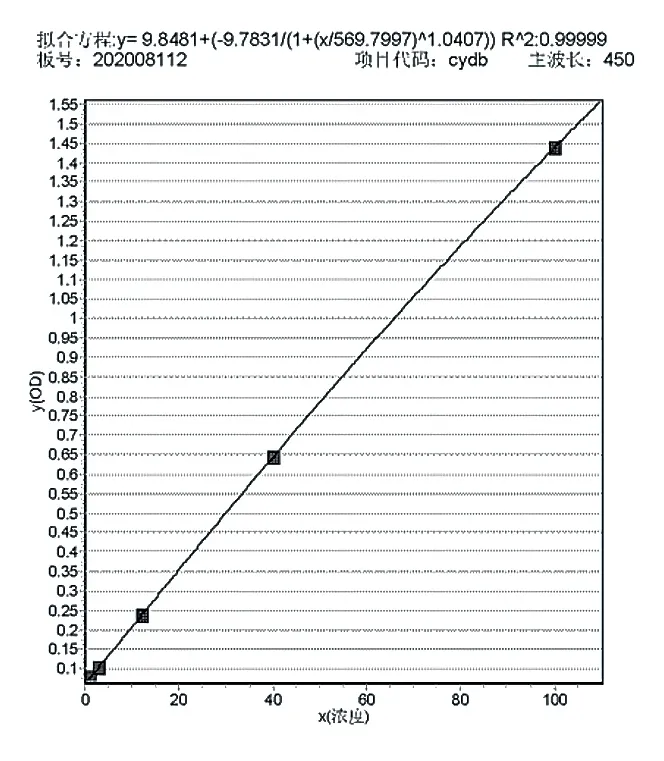
图1 宿主菌蛋白质标准曲线
2.2.4 精密度
2.2.4.1 重复性 将试剂盒中1、12、40 及100 ng/ml的E.coliHCP 标准液重复6 个复孔,计算上述4 个标准溶液宿主蛋白含量的RSD值及回收率。由实验结果可知1 ng/ml 标准液浓度RSD值为11.61%,变异程度较大,但仍符合试剂盒中关于低浓度下变异系数<20% 的要求。当蛋白含量较高时,板孔间变异系数均<10%。回收率测试结果也符合试剂盒关于回收率的规定(回收率:80%~120%)。见表3。

表3 重复性实验结果
2.2.4.2 中间精密度 取本品(Bulk20200602)6 份进行检测,每份供试品测定2 次吸光值。计算6 份供试品中吸光值均值的RSD值以及宿主菌蛋白质含量。由表4 可知6 份供试品吸光值均值RSD值为3.09%,而宿主菌蛋白质含量均低于该方法的定量限1 ng/ml,故无评价RSD值的必要。
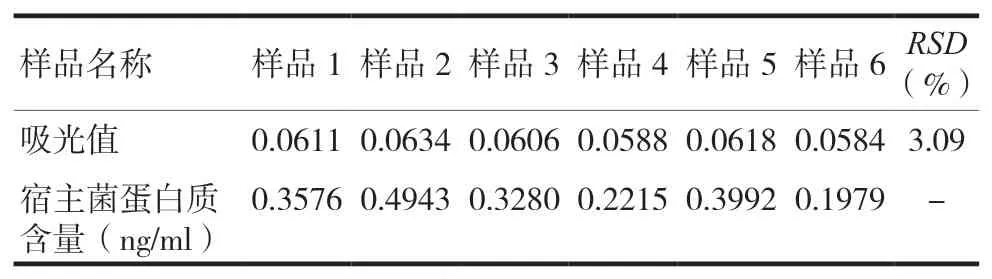
表4 中间精密度实验结果
2.2.5 准确度 将DNA 疫苗原液分别与64、80、100 ng/ml 的E.coliHCP 标准液进行等比混合,作为低、中、高浓度的加标溶液(即宿主菌蛋白质加标量分别为32、40、50 ng/ml),每个浓度的加标溶液平行稀释3 份。将0 ng/mlE. coliHCP 标准液与DNA 疫苗原液等比混合作为本底溶液。照2.1.2 项下对各溶液中宿主菌蛋白质含量进行检测,每种溶液平行3 个复孔,计算低、中、高浓度加标溶液的回收率以及RSD值。9 份溶液的加标回收率均值为100.35%,RSD值为3.58%,该方法的准确度结果良好。见表5。

表5 准确度实验结果
2.2.6 耐用性 分别由不同人员使用不同批次试剂盒对NMM 抗肿瘤DNA 疫苗原液中宿主菌蛋白质含量进行测定,结果显示DNA 疫苗原液中宿主菌蛋白质含量均在该方法的定量限1 ng/ml 左右,表明该方法耐用性良好。
2.3 样品的测定
用该方法对5 批DNA 疫苗原液进行检测,宿主菌蛋白质含量均在该方法的定量限浓度1 ng/ml左右,折算为每毫克质粒DNA 中宿主菌蛋白质残留量,结果显示宿主菌蛋白质残留量均在1 ng/mg左右。见表6。该结果远低于相关指导原则[14]中规定的宿主菌蛋白质残留量不高于1 μg/mg 的质量标准,表明固安鼎泰海规生物科技有限公司(本公司)的纯化工艺可以有效去除产品中宿主菌蛋白质。
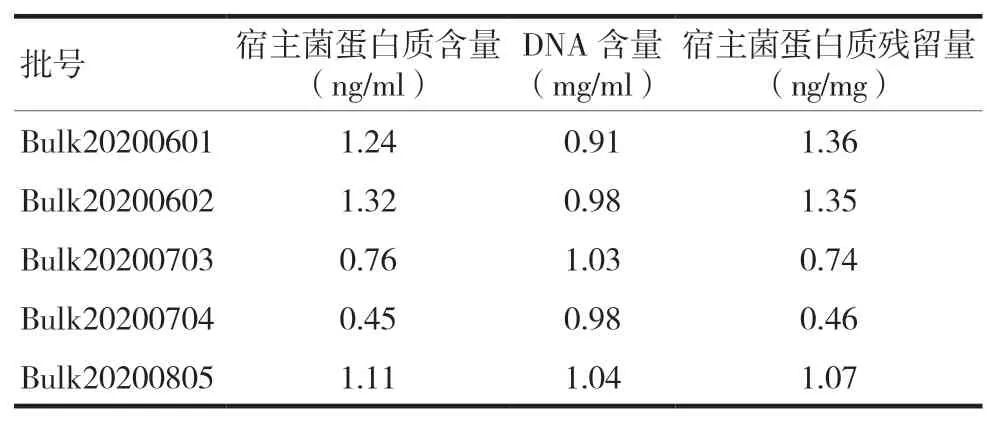
表6 5批产品中宿主菌蛋白质残留量检测结果
3 讨论
大肠杆菌是原核表达系统中应用最普遍的基因工程菌之一,许多人细胞因子类产品,如注射用干扰素、人粒细胞刺激因子、成纤维细胞生长因子都是在该宿主菌中表达。基因治疗用质粒DNA 产品[15]以及DNA 疫苗产品,如子宫颈癌DNA 疫苗[16]、乙肝DNA 疫苗[17]、印度已获批上市的新冠DNA 疫苗[18]等,亦以大肠杆菌作为生产用工程菌。本公司抗肿瘤DNA 疫苗也是采用大肠杆菌作为生产用工程菌,所以要在终产品中检测菌体蛋白质残留量。
本研究采用山羊抗大肠杆菌菌体蛋白抗体建立的双抗体夹心法对产品菌体蛋白质残留量进行检测,该方法具有灵敏度高、重复性好等特点,由于该试剂盒使用了多种大肠杆菌菌体蛋白质的抗体,可作为大肠杆菌菌体蛋白质残留量检测的通用方法。本研究选择四参数logistic 曲线对数据进行处理,可大大降低主观因素对结果的影响,并提高计算的精确度[10]。本研究显示DNA 疫苗对大肠杆菌宿主菌蛋白质残留量的检测无干扰,本方法定量限为0.98 ng/ml,该试剂盒在12 ~100 ng/ml 的范围内浓度变异系数<10%,而在低浓度(1 ng/ml 左右)下变异系数较大,但仍符合试剂盒低浓度下变异系数应<20%的要求。该方法具有良好的回收率,回收率均值为100.35%。经对多批次NMM 抗肿瘤DNA 疫苗原液中宿主菌蛋白质残留量进行检测,结果显示残留量均在1 ng/mg 左右,远低于《中华人民共和国药典》中宿主菌蛋白质残留量不高于1 μg/mg的规定。
本研究成功建立了NMM 抗肿瘤DNA 疫苗原液中大肠杆菌菌体蛋白质残留量ELISA 检测方法,该方法具有良好的专属性、检测限、定量限、线性、精密度、准确度。方法学研究结果表明,Cygnus 大肠杆菌宿主细胞检测试剂盒适用于本公司生产的NMM 抗肿瘤DNA 疫苗原液中宿主菌蛋白质残留量的检测,该方法可为同类产品或其他依托大肠杆菌发酵的重组生物制品中宿主菌菌体蛋白质残留量的检测提供参考。

