驱动基因EGFR/ALK/ROS1 均阴性的肺腺癌和肺鳞癌的临床病理特征研究*
王思伟,董苏博,张 艳,王 峰,李 梅***
(1 南通大学附属医院肿瘤科,南通 226001;2 南通大学医学院;3 徐州医科大学附属宿迁医院肿瘤科)
肺癌是世界范围内具有高发病率和高死亡率的恶性肿瘤[1],根据病理类型,可分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non-small cell lung cancer,NSCLC)。而NSCLC 又包括腺癌、鳞癌、腺鳞癌、大细胞癌等病理类型。目前,二代测序(next-generation sequencing,NGS)技术在临床得到广泛应用,在协助疾病诊断、评估患者预后、指导临床治疗等方面发挥着十分重要的作用。美国国家综合癌症网络指南[2]规定的NSCLC 的8 种驱动基因包括间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)、鼠类肉瘤滤过性毒菌致癌同源体B1(v-Raf murine sarcoma viral oncogene homolog B1,BRAF)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、Erb-B2 受体酪氨酸激酶2(Erb-B2 receptor tyrosine kinase 2,ERBB2)、鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)、间质-上皮细胞转化因子(mesenchymal epithelial transition factor,MET)、Ret 原癌基因(Ret proto-oncogene,RET)、原癌基因1受体酪氨酸激酶(c-ros-oncogene 1 receptor tyrosine kinase,ROS1),均可通过NGS 技术进行检测。国内外关于驱动基因阳性NSCLC 临床病理特征的研究较多见,但很少有单独对驱动基因阴性的肺腺癌和肺鳞癌进行对比研究的相关报道。本研究主要探讨EGFR/ALK/ROS1 均阴性的肺鳞癌和肺腺癌的临床病理特征,加强对此类疾病的认识和把握,从而更好地指导临床诊治工作。
1 对象与方法
1.1 研究对象 收集南通大学附属医院2017 年10月—2019 年10 月收治的NSCLC 96 例患者。所有患者均经过病理组织学或细胞学明确诊断,且基因检测提示EGFR/ALK/ROS1 均阴性。
1.2 研究方法 采用回顾性研究的方法分析本次研究中驱动基因EGFR/ALK/ROS1 均阴性的肺腺癌和肺鳞癌患者的临床病理特征。
1.3 观察指标 性别、年龄、吸烟史、首发症状、血清肿瘤标志物、肿瘤直径大小、淋巴结转移情况、远处转移情况、肿瘤分化程度、TNM 分期、其他基因变异情况、肿瘤突变负荷(tumor mutation burden,TMB)等。
1.4 统计学方法 用Excel 归纳整理搜集到的所有数据,应用统计学软件SPSS 25.0 进行处理,本研究中各类参数均属于计数资料,以率(%)表示,组间比较采用χ2检验或Fisher 确切概率法,P<0.05 表示差异有统计学意义。
2 结果
2.1 腺癌组和鳞癌组临床病理各参数分布差异纳入的96 例样本中,肺腺癌组54 例,肺鳞癌组42例(以下分别简称腺癌组、鳞癌组)。两组在性别(P=0.01)、吸烟史(P<0.001)上差异有统计学意义;血清肿瘤标志物中SCCA(P<0.001)和CYFRA21-1(P=0.007)两组比较差异有统计学意义;在胸闷胸痛症状(P=0.011)、肿瘤直径>7 cm(P=0.02)差异也存在统计学意义;在转移部位上,腺癌组发生的概率从高到低依次为肺内、骨、颅内、肾上腺、肝脏,而鳞癌组依次为肺内、骨、肾上腺、颅内和肝脏,两组均发现同时合并多处转移的患者肺内转移(P=0.045);而在年龄、分化程度、淋巴结转移、有无远处转移方面差异均无统计学意义(均P>0.05),见表1。
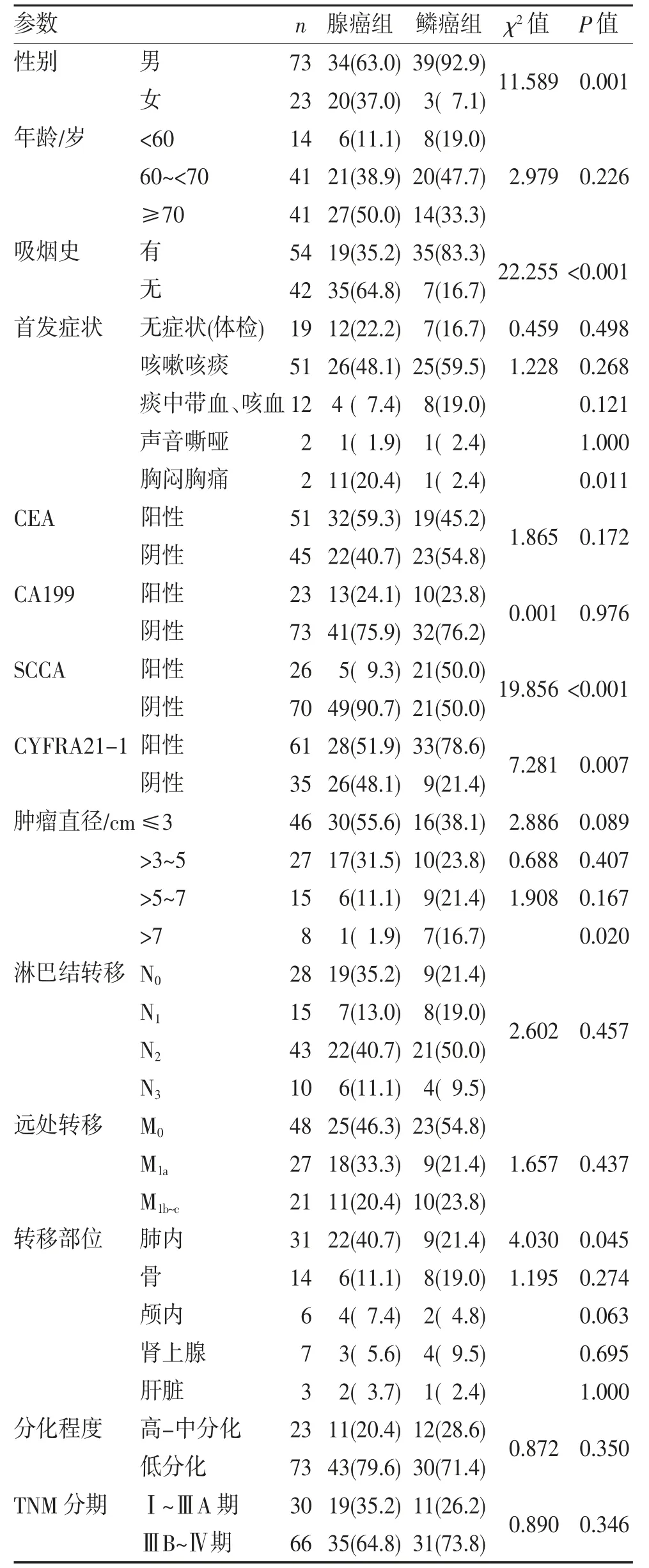
表1 腺癌组和鳞癌组临床病理各参数分布(n,%)
2.2 两组其他基因变异情况及TMB 差异 KRAS基因突变在两组中差异有统计学意义(P<0.05)。对于TMB≥10 个突变/Mb,两组差异有统计学意义(P<0.05),见表2。
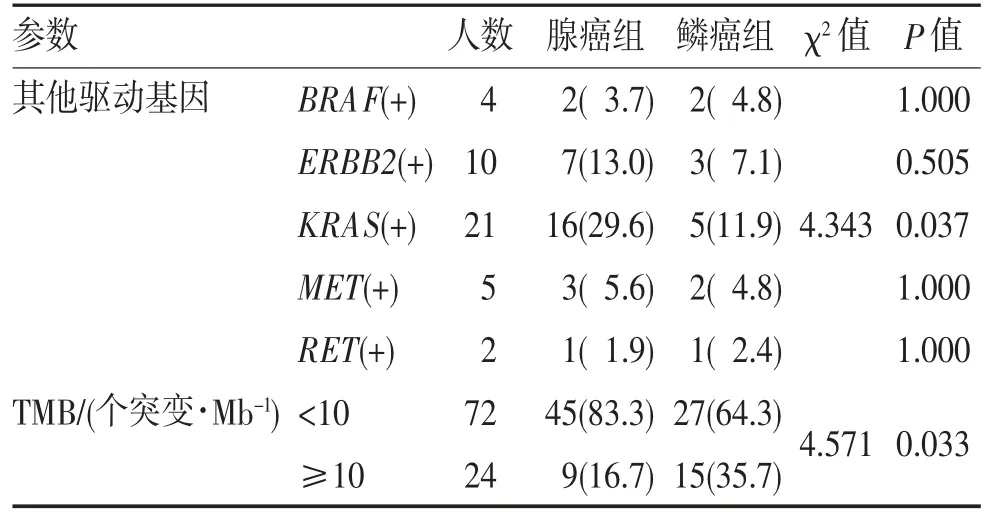
表2 腺癌组和鳞癌组其他特征分布(n,%)
3 讨论
在我国,肺癌的发生率与致死率都是所有癌症中最高的[3],本研究中鳞癌组男性占比高于女性(男∶女为13∶1),与以往研究结果[4]一致。肺腺癌一直是女性的主要亚型,但由于肺鳞癌在男性中的发病率不断降低,以2000 年为界,男性常见的肺癌病理类型已从鳞癌转为腺癌[5]。女性肺腺癌的患病率有逐年增高的趋势,这可能与二手烟、厨房油烟等有关[6],此外,雌激素水平高可能增加了女性患肺癌的风险[7]。年龄是肺癌发病的重要因素。肺癌的高发年龄为50~70 岁[8],本研究患者中≥60 岁占了绝大多数,说明肺癌患者发病的高峰年龄上升,可能与人口老龄化以及随着年龄增长致癌因素接触时间增加等相关。吸烟是促使肺癌发生的危险因素[6],本研究吸烟者均为男性,腺癌组中吸烟与不吸烟的比值为1∶1.84,而鳞癌组则为5∶1,可见吸烟可能与鳞癌发生的关系更大。近年来人们已意识到吸烟问题的严重性,积极倡导戒烟,期待这种严峻形势能够有所改善。
本研究中最常见的首发症状为咳嗽咳痰,鳞癌组占比略高,可能是鳞癌中央型多见而腺癌多为周围型,肿瘤生长易造成支气管狭窄从而引发咳嗽,同理,中央型肺癌的肿瘤组织可侵犯支气管血管,所以痰中带血或咯血的发生机会高于周围型肺癌。SCCA是一种糖蛋白,与鳞状细胞癌分化密切相关,由于鳞状细胞的被动释放,使SCCA 在鳞癌患者外周血中被检测[9],是肺鳞癌的特异性标志物[10]。肺鳞癌患者SCCA 水平显著高于肺腺癌[9],与本研究结果相符。CYFRA21-1 是患者机体细胞角蛋白-19 片段,在肿瘤细胞死亡时,能以溶解片段的形式释放至血清中[11]。CYFRA21-1 在本研究患者中的阳性率均较高,且鳞癌组呈更高表达,分别为51.9%、78.6%,这可能与肺癌细胞表达的异质性,鳞癌组织易坏死、变性有关[11]。CYFRA21-1 在测定肺癌恶性程度上也有较大价值[12]。在影像学上,腺癌组出现胸腔积液的比例高于鳞癌组,而鳞癌组伴有阻塞性肺炎或肺不张的比例高于腺癌组,这与相关研究[13]相近。肺腺癌因有较强的侵袭能力,更易出现肺内转移或是胸膜转移,这也解释了为何肺腺癌患者更易出现胸闷胸痛等症状。肺鳞癌多为中央型,常沿着支气管增殖生长分化,易造成管腔狭窄、甚至阻塞肺叶或肺段引起肺不张,此外肺鳞癌更易发生组织坏死从而出现空洞。在确诊肺癌后,行TNM 分期对治疗方案的选择至关重要。本研究中,在肿瘤直径上,肿瘤直径>7 cm 在鳞癌组(16.7%)中的比例明显高于腺癌组(1.9%)(P=0.02)。研究[14]表明鳞癌原发灶的肿块大小大于腺癌,可能原因为鳞癌易出现短期快速增长而内部新生血管无法进行支撑。从转移部位上看,腺癌组发生肺内转移更为常见,提示腺癌更早且更容易发生转移。最新肺癌诊治指南[15]建议,Ⅰ~Ⅱ期及部分Ⅲ期患者首选手术治疗,Ⅳ期及部分Ⅲ期患者可行放化疗、靶向治疗、免疫治疗或联合治疗等。目前国内获批上市的靶向药多局限于EGFR 或ALK/ROS1 基因变异,部分靶向药仍处于临床研究前期阶段。有研究[16]报道,NSCLC 驱动基因变异存在互斥性,虽然双基因甚至多基因变异被不断发现,但大多数患者为单基因变异,所以当EGFR/ALK/ROS1 均阴性时,其他驱动基因的变异率可能有所上升。本文患者有其他驱动基因的变异,其中阳性率较高的是KRAS(29.6% vs 11.9%),有学者[17]认为KRAS 突变会产生“组学涟漪”,使KRAS 突变成为肺腺癌发生和发展中的“核心基因”,所以KRAS 突变多见于肺腺癌。基因变异存在时间和空间上的异质性,精准治疗过程中基因表达可能会发生变化。因此,在靶向治疗后出现疾病进展时,建议再次行基因检测,为诊疗方案的调整提供依据。
对于驱动基因阴性的晚期NSCLC 患者而言,检测程序性死亡-配体1(programmed cell death-ligand 1,PD-L1)、TMB 具有一定的临床意义。肺癌NCCN 指南[3]推荐当EGFR/ALK 阴性或未知时,PD-L1 表达阳性(肿瘤比例评分≥50%或1%~49%)者无使用帕博利珠单抗或阿特珠单抗的禁忌,但目前没有任何一项能够成为精准免疫治疗的生物标志物,PD-L1也存在一些缺陷[18],联合检测多种标志物可能对免疫治疗有一定的预测作用。TMB 是筛选使用PD-1/PD-L1 抑制剂的重要标志物,是一种新兴的肿瘤标志物,它负荷量的高低可能能够参与评估患者是否能从免疫治疗中获益[19]。本研究发现在TMB≥10 个突变/Mb的患者中,鳞癌组明显高于腺癌组(P=0.033),鳞状细胞癌可能是导致TMB 水平升高的因素之一[20]。也有研究[21]认为包含P53 基因或肿瘤性结肠息肉基因突变在内的多种非驱动基因同时发生突变的情况更常见于TMB 高水平的患者中;在腺癌患者中,视网膜母细胞瘤蛋白1 突变更常见于TMB 高水平患者中;在鳞癌患者中,鳞脂酰肌醇4,5-双磷酸-3-激酶催化亚基α 基因突变更易发生于TMB 高水平的NSCLC。这些都提示免疫治疗在驱动基因均阴性的晚期肺鳞癌患者中可能会取得一定的效果,未来仍需要更进一步的研究。
综上所述,通过本文多方面地综合介绍EGFR/ALK/ROS1 均阴性的肺腺癌和肺鳞癌患者的临床病理特征,增强了对此类疾病的整体认识,掌握二者的异同,可为临床诊疗提供参考依据,减少漏诊和误诊率。

